中药心康方对大鼠心力衰竭模型心肌胶原代谢的影响
叶小汉 吕洪雪 吴锦波
523000 东莞市中医院心内科
基质金属蛋白酶(matrix metalloproteinase,MMP)及其组织抑制因子(tissue inhibitor of matrix metalloproteinases,TIMP)是胶原代谢的重要调节因子[1]。中药心康方功能宣肺平喘、降气利水、益气活血,能改善慢性心力衰竭(chronic heart failure,CHF)患者心功能、降低N末端B型利钠肽原(N-terminal pro B-type natriuretic peptide,NT-proBNP)、增加6 min步行距离、提高生活质量[2];可降低心脏MMP-2、MMP-9、TIMP-1和TIMP-2的基因表达水平,降低胶原容积分数(collagen volume fraction,CVF),但其机制尚不清楚[3]。本研究通过复制大鼠心力衰竭模型,观察中药心康方对CHF大鼠胶原代谢的影响,进一步探讨中药心康方的作用及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性6周龄[体重(240±15)g] Sprague Dawley(SD)大鼠60只,由广州中医药大学动物实验中心提供,动物许可证号:SCXK(粤)2013-0020,动物合格证号:NO.440059000。SPF级净化空间,生长条件为12 h/12 h光照周期,温度(22±3)℃,相对湿度40%~70%,自由摄食、饮水。
1.1.2 药物与试剂 按实验动物与人体表面积比例进行药物剂量换算,大鼠中药剂量采用换算剂量的2倍。中药心康方由葶苈子15 g、杏仁10 g、茯苓15 g、黄芪15 g、陈皮5 g、三菱10 g组成,中药饮片购自东莞市药材公司,由东莞市中医院制成流浸膏,并浓缩至0.13g生药/ml,-20℃保存。
卡托普利(中美上海施贵宝);阿霉素(Medchemexpress LLC);氯胺酮(福建古田药业);地西泮(天津金耀药业);二喹啉甲酸(bicinchoninic acid,BCA)试剂盒(碧云天);抗β-actin、Lamin B、Ⅰ型胶原、Ⅲ型胶原、转化生长因子β1(transforming growth factor beta 1,TGF-β1)、核因子κB的抑制蛋白(inhibitor of nuclear factor kappa B,IκB)、p56、MMP-2、MMP-9、TIMP-1和TIMP-2抗体(Abcam);增强型化学发光(enhanced chemiluminescence,ECL)显色液(美国Millipore);Bestar qPCR RT Kit(德国DBI)。
1.1.3 主要仪器 HP5500心脏超声仪(美国惠普);GDS7600凝胶扫描系统(英国UVP);Agilent Stratagene PCR仪Mx3000P(美国安捷伦)。
1.2 方法
1.2.1 动物造模和分组[4]雄性SD大鼠适应性喂养1周后,采用阿霉素腹腔注射法(用灭菌注射用水溶解成0.25 mg/ml溶液,每次注射剂量为2.5 mg/kg,2周内分6次注射,总剂量15 mg/kg)建立大鼠心力衰竭模型。首次腹腔注射5周后超声心动图检测左心室短轴缩短率(fractional shortening,FS),以心腔扩大,FS<30%作为心力衰竭成模标准。从60只大鼠中随机选取10只作为对照组,予腹腔注射10 ml/kg生理盐水;其余50只大鼠用于造模,将造模成功的大鼠按随机数字表法分为模型组、心康方组和卡托普利组,分别以蒸馏水(10 ml/kg)、心康方中药浸膏(10 ml·kg-1·d-1)和卡托普利(13.5 mg·kg-1·d-1)灌胃,每天1次,连续35 d。
1.2.2 大鼠心功能和左室重构指标的检测 分别于第6周(干预前)和第12周(干预后)采用腹腔注射氯胺酮(50 mg/kg)和地西泮(5 mg/kg)混合麻醉大鼠,超声心动图测量左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、心排血量(cardiac output,CO)、FS和左心室射血分数(left ventricular ejection fraction,LVEF)。并于第12周超声心动图检查后,立即注射2 mmol/L氯化钾,使大鼠心脏停搏在舒张末期,迅速开胸离断心脏,PBS冲洗干净后,显微解剖分离左心室,称重,计算左心室质量指数(left ventricular mass index,LVMI)。
1.2.3 Masson染色检测心肌胶原沉积 取大鼠心室组织常规固定,石蜡包埋、切片;脱蜡,Wayer苏木素染5 min;丽春红酸性品红液染5 min;1%磷钼酸水溶液处理5 min;苯胺蓝液复染1 min。应用IPP 6.0病理图像分析软件分析各组胶原纤维表达,计算CVF(CVF=胶原面积/总面积)。
1.2.4 Western blot检测心肌Ⅰ型胶原、Ⅲ型胶原、TGF-β1、IκB、p56、MMP-2、MMP-9、TIMP-1和TIMP-2的表达 取心肌组织冰上裂解1 h,提取细胞内蛋白,BCA法蛋白定量。取各组蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,转膜后用牛血清蛋白封闭,经Ⅰ抗结合后洗膜,Ⅱ抗结合,洗膜后ECL显色,软件分析。以Ⅰ型胶原、Ⅲ型胶原、TGF-β1、IκB、MMP-2、MMP-9、TIMP-1和TIMP-2的平均灰度值与相应内参照蛋白β-actin的平均灰度值的比值表示目的蛋白的相对表达量,p56的内参照蛋白为Lamin B。
1.2.5 RT-qPCR检测心肌MMP-2、MMP-9、TIMP-1和TIMP-2的mRNA表达 心肌组织匀浆后,Trizol法抽提总RNA,Agilent Stratagene PCR仪Mx3000P进行实时荧光定量PCR。PCR反应条件为反转录94℃灭活反转录酶和预变性2 min,94℃变性20 s,58℃退火20 s,72℃延伸20 s,PCR扩增40循环。以β-actin作为内参基因,采用2-△△Ct公式计算mRNA的相对表达水平。引物设计及PCR反应均由广州维伯鑫生物科技有限公司完成。PCR引物见表1。
1.3 统计学方法
2 结果
2.1 一般情况
采用阿霉素腹腔注射法造模共50只,造模过程中有15只大鼠因出现重度心力衰竭和肝硬化腹水而死亡,死亡率为30.0%;FS不达标5只,成模率为60.0%。30只造模成功大鼠按随机数字表法分成3组:模型组、心康方组和卡托普利组,每组10只,在随后的实验干预中,每组各有1只大鼠因灌胃不当而死亡。CHF大鼠出现不同程度的食欲减退、精神较差、张口呼吸和乏力等症状。干预前,各组成模大鼠平均体重和FS差异均无统计学意义(均为P>0.05);对照组大鼠平均体重和FS均高于各造模组(均为P<0.01),见表2。

表1 RT-qPCR引物序列

表2 各组大鼠体重和FS比较
注:与对照组比较,aP<0.01
2.2 大鼠心功能和左室重构指标
干预后,模型组大鼠的FS、CO和LVEF显著低于对照组,LVEDV、LVESV和LVMI显著高于对照组(均为P<0.01);心康方组和卡托普利组的FS、CO和LVEF显著高于模型组(均为P<0.01),LVEDV、LVESV和LVMI显著低于模型组(均为P<0.01),见表3。
2.3 大鼠心肌CVF和心肌Ⅰ型、Ⅲ型胶原的表达
表3 各组大鼠心功能和左室重构指标的比较
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01
光镜下观察,Masson染色中胶原纤维呈蓝白色,胞质、肌纤维呈红色,胞核蓝褐色。与对照组(0.08%±0.02%)比较,模型组(0.27%±0.11%)CVF增加了237.50%;与模型组比较,心康方组(0.18%±0.04%)和卡托普利组(0.15%±0.09%)CVF分别降低了31.03%和44.44%(P<0.05或P<0.01)(图1)。模型组Ⅰ型胶原和Ⅲ型胶原显著高于对照组,心康方组和卡托普利组Ⅰ型胶原和Ⅲ型胶原显著低于模型组,差异均有统计学意义(均为P<0.01)。
2.4 大鼠心肌TGF-β1、IκB和p56的表达
模型组TGF-β1和p56显著高于对照组,IκB显著低于对照组;心康方组和卡托普利组TGF-β1和p56显著低于模型组,IκB显著高于模型组,差异均有统计学意义(均为P<0.05),见图2。
2.5 大鼠心肌MMP-2、MMP-9、TIMP-1和TIMP-2 蛋白含量和mRNA的相对表达量
模型组MMP-2、MMP-9、TIMP-1和TIMP-2的蛋白含量和mRNA相对表达量显著高于对照组(P<0.01或P<0.05);心康方组和卡托普利组MMP-2、 MMP-9、TIMP-1和TIMP-2 的蛋白含量和mRNA相对表达量显著低于模型组(P<0.01或P<0.05),差异均有统计学意义,见图3~6。各组MMP-2/TIMP-2蛋白比值差异无统计学意义;模型组、心康方组和卡托普利组MMP-9/TIMP-1蛋白比值差异无统计学意义,均显著少于对照组(0.32±0.20、0.34±0.17和0.41±0.30比0.86±0.45,P<0.01或P<0.05)。
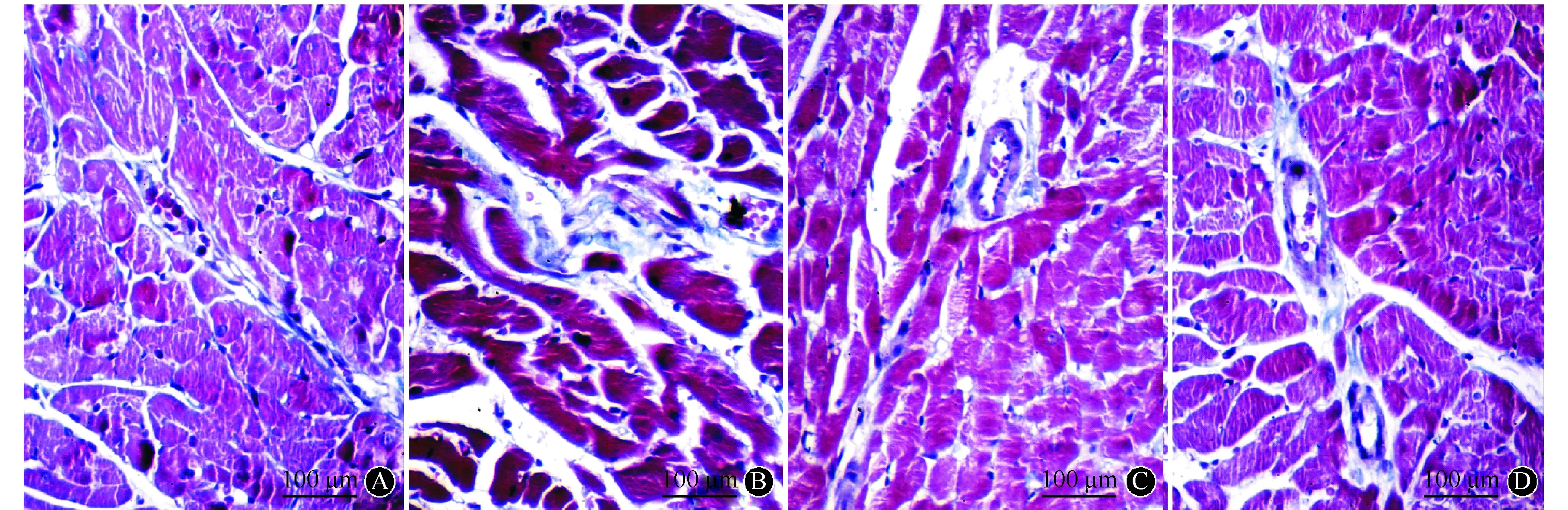
A:对照组;B:模型组;C:心康方组;D:卡托普利组图1 各组大鼠心肌胶原组织Masson染色(×200)
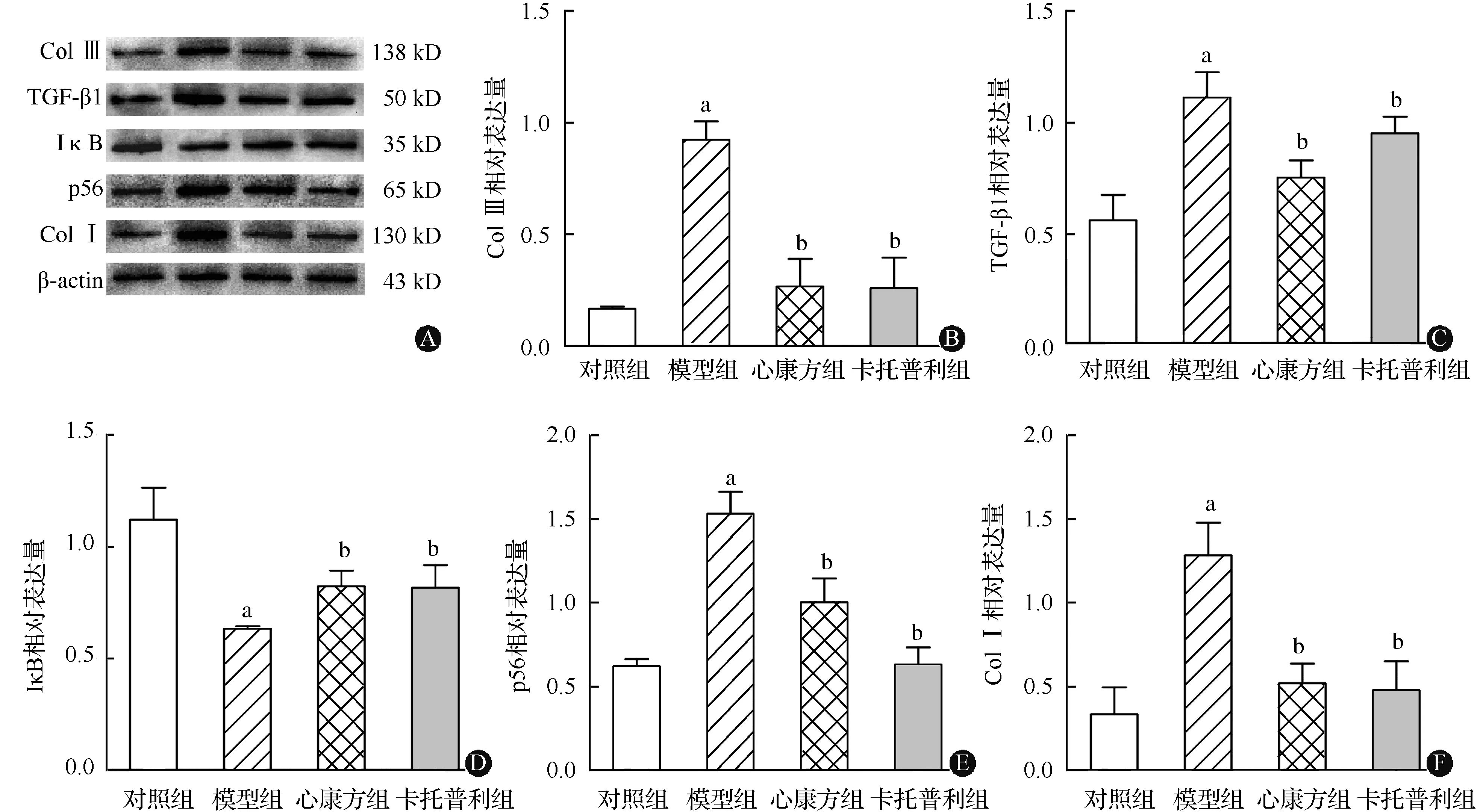
与对照组比较,aP<0.05;与模型组比较,bP<0.05图2 各组大鼠心肌Ⅰ型胶原、Ⅲ型胶原、TGF-β1、IκB和p56的相对表达
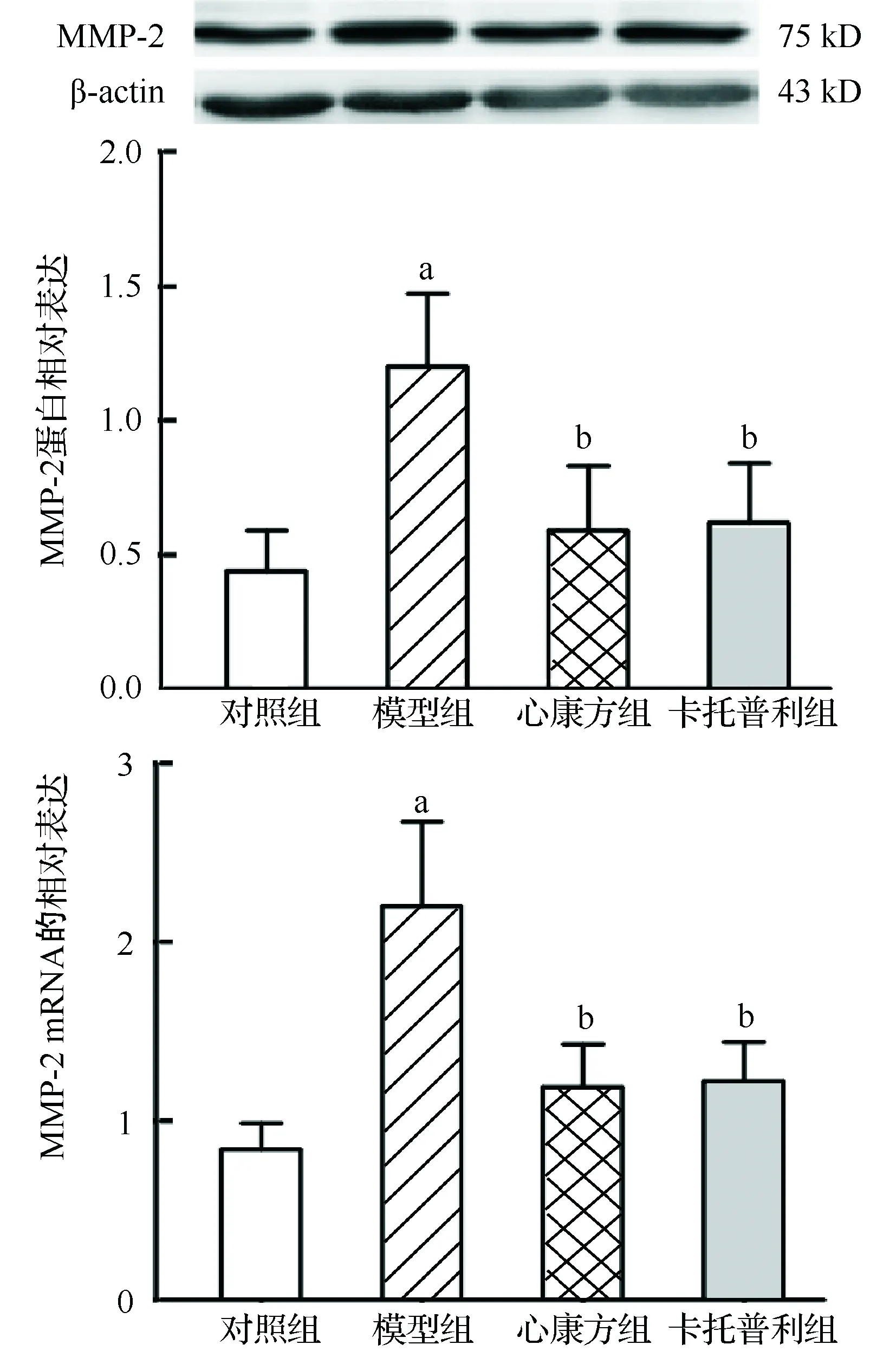
与对照组比较,aP<0.01;与模型组比较,bP<0.01图3 大鼠心肌MMP-2蛋白和mRNA的相对表达量
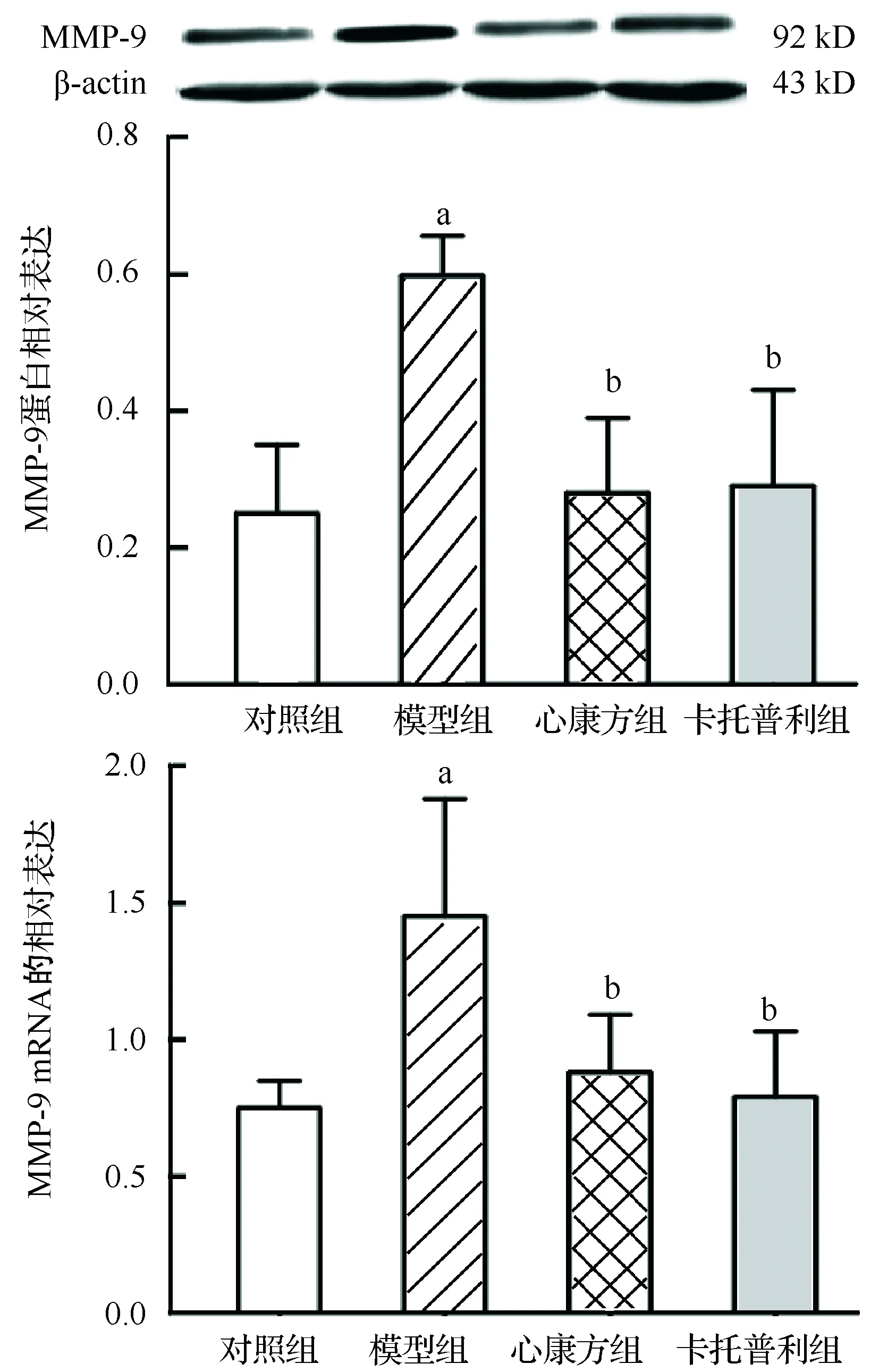
与对照组比较,aP<0.05;与模型组比较,bP<0.05图4 大鼠心肌MMP-9蛋白和mRNA的相对表达量
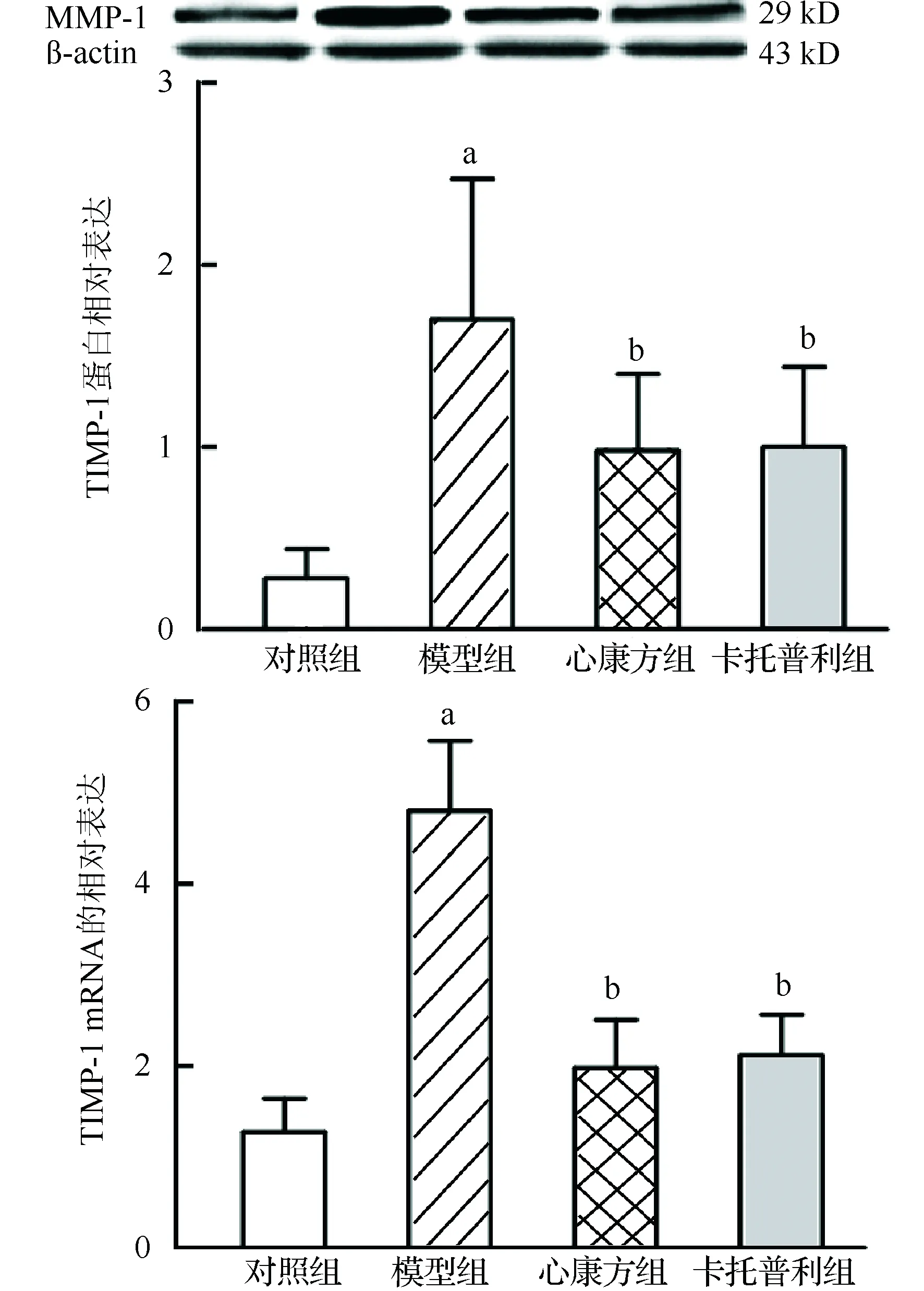
与对照组比较,aP<0.01;与模型组比较,bP<0.01图5 大鼠心肌TIMP-1蛋白和mRNA的相对表达量

与对照组比较,aP<0.01;与模型组比较,bP<0.01图6 大鼠心肌TIMP-2蛋白和mRNA的相对表达量
3 讨论
本研究通过腹腔注射阿霉素建立CHF大鼠模型,Masson染色结果表明CHF大鼠发生心肌纤维化(myocardial fibrosis,MF),而心康方组的纤维化程度显著低于模型组。蛋白印迹试验结果发现CHF大鼠心肌Ⅰ型和Ⅲ型胶原过度沉积,而心康方组和卡托普利组的胶原沉积显著少于模型组,表明中药心康方和卡托普利可以改善心肌胶原代谢,具有抗MF作用。
心肌组织的细胞外基质(extracellular matrix,ECM)是由Ⅰ型和Ⅲ型胶原蛋白、纤连蛋白、层粘连蛋白、原纤维蛋白、弹性蛋白、蛋白聚糖和糖蛋白等物质在心肌细胞附近形成的网架结构[5]。胶原是心脏ECM中含量最多的物质,其中85%是Ⅰ型胶原,11%为Ⅲ型胶原。心肌胶原合成与降解失衡,导致胶原比例改变及过度沉积而形成MF[6]。TGF-β1是与胶原代谢关系最密切的细胞因子[7],可诱导成纤维细胞分化为肌成纤维细胞,合成和分泌大量ECM(主要是Ⅰ型和Ⅲ型胶原)。肌成纤维细胞合成ECM的能力远大于成纤维细胞,是组织纤维化过程中产生过量ECM的主要来源细胞。肌成纤维细胞可迁移至损伤区域并迅速增殖,合成大量ECM,促进ECM间的交联,引起胶原的过度沉积,导致MF发生。本实验中,CHF大鼠心肌TGF-β1表达水平显著升高,胶原代谢紊乱,左室出现病理性重构,提示ECM重构;心康方组TGF-β1表达水平显著低于模型组,提示胶原代谢得到改善,ECM重构减轻。TGF-β1还可抑制MMPs分泌,刺激TIMPs表达,抑制胶原降解[7]。成纤维细胞产生MMPs和TIMPs,MMPs降解ECM,TIMPs抑制MMPs从而抑制ECM降解。其中,MMP-2和MMP-9能降解心肌胶原,TIMP-2能抑制MMP-2活性,TIMP-1能抑制MMP-9活性。本实验中,CHF大鼠心肌MMP-2、MMP-9、TIMP-1和TIMP-2的蛋白和mRNA表达水平均显著升高,提示胶原降解加快,TIMPs加强对MMPs的抑制作用;心康方组MMPs和TIMPs的蛋白和mRNA表达水平均显著低于模型组,提示胶原降解减慢,TIMPs对MMPs的抑制作用减轻;心康方组与模型组MMPs/TIMPs比值无显著差异,可能与检测时间点过晚有关:当ECM重构到达一定程度,MMPs与TIMPs形成新的短暂的动态平衡,ECM降解与合成相对稳定。
研究发现NF-κB可介导TGF-β1上调而促进MF,抑制NF-κB的表达可下调TGF-β1的表达,从而减轻MF[1];应用该理论可以较好地解析我们的实验结果。p65/p50是NF-κB的常见存在形式,IκB是其抑制因子;IκB可被磷酸化降解,p65磷酸化激活而实现NF-κB的功能。本实验中,CHF大鼠心肌p56显著升高,IκB显著降低,提示NF-κB介导TGF-β1上调而促进MF;心康方组p56显著低于模型组,IκB显著高于模型组,提示中药心康方能抑制NF-κB通路,抑制TGF-β1上调而减轻MF。另外,抑制成纤维细胞中NF-κB通路还可以减少Ⅰ型胶原累积,减轻MF[8]。作为阳性对照的卡托普利早已被证实具有抗MF作用,能降低TGF-β1水平[9-10],与本研究结果一致。
MF是CHF左室重构的主要表现,减轻MF可以抑制病理性左室重构,改善心功能。胶原代谢紊乱导致MF,改善胶原代谢可以减轻MF。胶原的合成、分泌和降解都受到机体的严密调控。中药心康方在阿霉素诱导的CHF大鼠模型中能够抑制NF-κB和TGF-β1通路,通过调节MMPs、TIMPs、Ⅰ型和Ⅲ型胶原的表达而减少胶原沉积,减轻MF。TGF-β1通路在胶原代谢中的作用已经比较明确,NF-κB在MF中的作用及其机制仍未达成共识,有待进一步研究。
由于本实验动物样本量少,使用的是小动物,只针对阿霉素诱导的特定HF模型,实验中药的效应及其具体作用机制有待进一步的研究来验证和解答。
利益冲突:无
[1] 李秀,韩科强,石亚男,等.熊去氧胆酸对异丙肾上腺素诱导的小鼠心肌纤维化的作用[J].中华医学杂志,2017,97(5):387-391.DOI:10.3760/cma.J.issn.0376-2491.2017.05.013.
Li X,Han KQ,Shi YN,et al.Effects and mechanisms of ursodeoxycholic acid on isoprenaline-induced myocardial fibrosis in mice [J].Natl Med J China,2017,97(5):387-391.DOI:10.3760/cma.J.issn.0376-2491.2017.05.013.
[2] 苏志远,叶小汉,吴锦波.心康方治疗慢性心力衰竭临床观察[J].新中医,2016,48(3):12-14.DOI:10.13457/j.cnki.Jncm.2016.03.005.
Su ZY,Ye XH,Wu JB.Clinical observation of Xinkang recipe in the treatment of patients with chronic heart failure [J].Journal of New Chinese Medicine,2016,48(3):12-14.DOI:10.13457/j.cnki.Jncm.2016.03.005.
[3] 吴锦波,叶小汉,冼绍祥,等.泻肺利水中药对心力衰竭大鼠左室重构的影响[J].西安交通大学学报(医学版),2017,38(1):136-141,156.DOI:10.7652/j dyxb201701029.
Wu JB,Ye XH,Xian SX,et al.Effects of Xiefei Lishui recipe on left ventricle remodeling in rats with heart failure [J].Journal of Xi′an Jiaotong University(Medical Sciences),2017,38(1):136-141,156.DOI:10.7652/j dyxb201701029.
[4] 白剑,顾蓉,王丙剑,等.过表达整合素连接激酶可改善慢性心力衰竭大鼠心功能 [J].中华心血管病杂志,2014,42(3):225-229.DOI:10.3760/cma.J.issn.0253-3758.2014.03.010.
Bai J,Gu R,Wang BJ,et al.Overexpression of integrin-linked kinase improves cardiac function in a rat model of doxorubicin-induced chronic heart failure [J].Chin J Cardiol,2014,42(3):225-229.DOI:10.3760/cma.J.issn.0253-3758.2014.03.010.
[5] 张蓓蓓,蔡辉.心脏肌成纤维细胞活化的力学调控 [J].中国心血管杂志,2016,21(6):500-504.DOI:10.3969/J.issn.1007-5410.2016.06.017.
Zhang BB,Cai H.Mechanical regulation of cardiac myofibroblast activation [J].Chin J Cardiovasc Med,2016,21(6):500-504.DOI:10.3969/J.issn.1007-5410.2016.06.017.
[6] 吕仕超,张军平,李萌,等.压力超负荷大鼠心肌胶原代谢的动态变化 [J].中国病理生理杂志,2017,33(4):740-743.DOI:10.3969/j.issn.1000-4718.2017.04.027.
Lyu SC,Zhang JP,Li M,et al.Dynamic changes of myocardial collagen metabolism in pressure-overloaded rats [J].Chinese Journal of Pathophysiology,2017,33(4):740-743.DOI:10.3969/j.issn.1000-4718.2017.04.027.
[7] Xu F,Liu C,Zhou D,et al.TGF-/SMAD Pathway and its regulation in hepatic fibrosis [J].J Histochem Cytochem,2016,64(3):157-167.DOI:10.1369/0022155415627681.
[8] Makino S,Mitsutake N,Nakashima M,et al.DHMEQ,a novel NF-kappaB inhibitor,suppresses growth and type I collagen accumulation in keloid fibroblasts [J].J Dermatol Sci,2008,51(3):171-180.DOI:10.1016/j.jdermsci.2008.03.003.
[9] Sayer G,Bhat G.The renin-angiotensin-aldosterone system and heart failure [J].Cardiol Clin,2014,32(1):21-32.DOI:10.1016/j.ccl.2013.09.002.
[10] Sun R,Wang J,Zheng Y,et al.Traditional Chinese medicine baoxin decoction improves cardiac fibrosis of rats with dilated cardiomyopathy [J].Exp Ther Med,2017,13(5):1900-1906.DOI:10.3892/etm.2017.4223.

