Logistic回归和Fisher线性判别分析模型在卵巢肿瘤良恶性鉴别诊断中的价值
桂 林,杨建波,黄远帅△
(西南医科大学附属医院:1.输血科;2.核医学科,四川泸州 646000)
卵巢肿瘤中约70%为良性肿瘤和非赘生性包块。由于卵巢癌早期临床表现与卵巢良性肿瘤相似,故术前较难鉴定肿瘤性质。卵巢癌病死率高达75%,但如果能早期诊断并及时治疗,90%局限于卵巢的肿瘤患者仍有望被治愈[1]。B超、CT等为卵巢肿瘤的定性诊断提供辅助诊断依据,但临床应用仍有一定的局限性且与临床经验有关[2-3]。血清间皮素、表皮生长因子受体(VEGF)等是诊断卵巢肿瘤潜在的标志物,但较少用于临床常规分析[4-5]。因此,本研究以本院收治的卵巢癌和卵巢良性疾病患者为研究对象,分析两组患者血清甲胎蛋白(AFP)、癌胚抗原(CEA)、铁蛋白(SF)、组织多肽抗原(TPA)、糖类抗原125(CA125)、CA72-4和人附睾蛋白4(HE4)水平差异并建立Logistic回归和Fisher线性判别分析模型,探讨两类模型对卵巢肿瘤良恶性的鉴别诊断价值。
1 资料与方法
1.1一般资料 选择 2014 年5 月至2015 年11月在本院妇产科首次入院,病理确诊为卵巢癌患者 284 例(卵巢癌组),平均年龄(43.9±15.4)岁。根据2013年国际妇产科联盟(FIGO)修订的分期标准:Ⅰ/Ⅱ期105例,Ⅲ/Ⅳ期179例。病理分型:浆液性腺癌117例,黏液性腺癌88例,内膜样癌30例,卵巢恶性畸胎瘤27例,混合性癌 14例,透明性细胞癌8例。选取同期卵巢良性疾病患者 200例(对照组),平均年龄(39.7±14.7)岁,包括卵巢浆液性腺瘤 78 例,卵巢黏液性腺瘤 57例,卵巢良性畸胎瘤36例,子宫内膜异位症 20 例,卵巢非赘生性包块9例,两组患者年龄构成差异无统计学意义(P>0.05)。
1.2方法 研究对象均于术前空腹静脉采血3~5 mL,3 000 r/min离心15 min后分离血清。采用日本东曹AIA2000化学发光免疫分析仪测定血清AFP、CEA、SF、TPA、CA125和CA72-4水平,其血清参考范围分别为0~10.00 ng/mL、0~6.00 ng/mL、3.00~150.00 ng/mL、0~70.00 U/L、0~35.00 U/mL和0.21~6.22 U/L。采用罗氏Cobas 601电化学发光免疫分析仪及配套试剂盒测定人附睾蛋白4(HE4),血清HE4的参考范围为0~150.00 pmol/L。
1.3统计学处理 数据以中位数(M)和四分位数间距(P25~P75)表示。组间比较采用独立样本Mann-whiteney U检验,以P<0.05差异有统计学意义。秩和检验、受试者工作特征(ROC)曲线的绘制、Logistic回归和Fisher线性判别模型均采用SPSS 17.0统计软件完成。
2 结 果
2.1两组血清7项指标水平比较 卵巢癌组血清AFP、CEA、SF、TPA、CA125、CA72-4和HE4水平均显著高于对照组,差异有统计学意义(P<0.05),见表1。

表1 卵巢癌组、卵巢良性疾病组血清7项指标水平比较[M(P25~P75)]
a:P<0.05,与对照组比较
2.2血清7项指标诊断效能比较 7项血清指标中CEA、SF、TPA、CA125、CA72-4的诊断效能较高(AUC,0.713~0.889),其中HE4的AUC最高0.889(95%CI:0.854~0.919),在其临界值为125.6 pmol/L时,灵敏度和特异度分别为77.4%和90.0%,见表2。

表2 卵巢癌组和卵巢良性疾病组7项血清指标的AUC比较
2.3基于血清CEA、SF、TPA、CA125和HE4的Fisher线性判别模型 以AUC>0.70的血清CEA、SF、TPA、CA125和HE4 5种指标建立二分类Fisher线性判别模型。判别函数1=0.01×HE4+0.052×CA125+0.964×CEA+0.02×SF+0.085×TPA-14.82。判别函数2=0.002×HE4+0.32×CA125+0.580×CEA+0.011× SF+0.054×TPA-5.24。将每个个体的5项指标带入方程,将观察值分类到判别函数较大的分类函数值中。该模型鉴别诊断卵巢癌和卵巢良性疾病的准确率分别为82.7%(234/283)和98.5%(197/200),采用交叉验证(cross-validated)的原则对个体属性进行验证,即每次留1个个体在外建立分类判别函数。该模型预测卵巢癌和卵巢良性疾病的准确率分为82.3%(233/283)和98.5%(197/200),见图1。
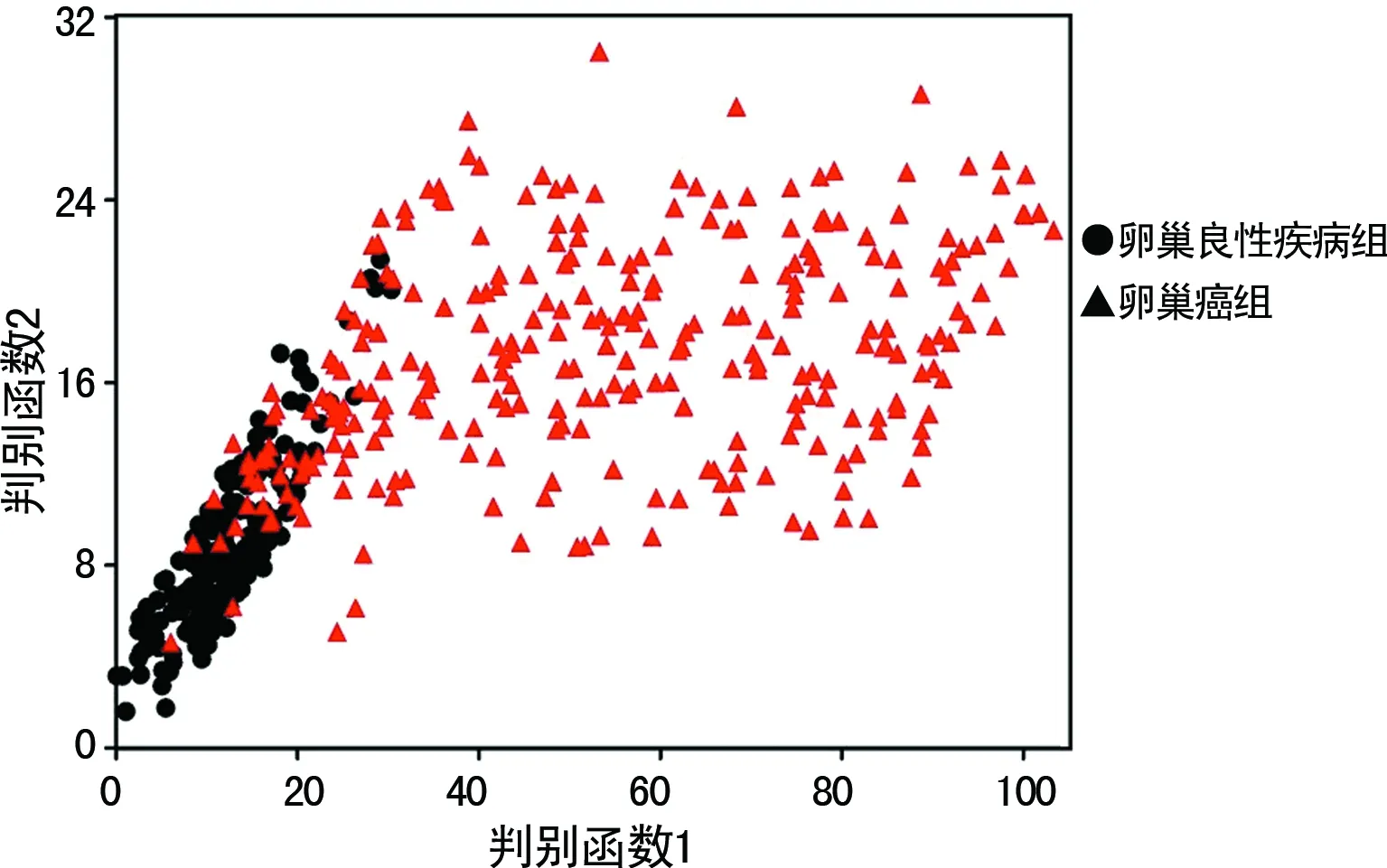
图1 基于血清CEA、SF、TPA、CA125和HE4的Fisher线性判别模型
2.4基于血清CEA、SF、TPA、HE4和CA125的Logistic回归分析模型 该模型中5个变量均有助于卵巢癌和卵巢良性疾病的鉴别诊断,其中最重要的变量为HE4和CA125,其Waldχ2值分别为32.51和31.82(表3)。以血清CEA、SF、TPA、HE4和CA125进行Logistic-ROC曲线分析,在最佳临界值(概率P=0.505)时对个体进行诊断和预测,该模型鉴别诊断卵巢癌和卵巢良性疾病的准确率分别为92.6%(262/283)和95.0%(190/200)。采用交叉验证进行预测,该模型预测卵巢癌和卵巢良性疾病的准确率分别为90.5%(256/283)和97.0%(194/200)。

表3 基于血清CEA、SF、TPA、CA125和HE4的Logistic回归分析
3 讨 论
卵巢癌的发病率在妇科恶性肿瘤中仅次于宫颈癌和子宫内膜癌但病死率却高居首位,故鉴别诊断卵巢癌和卵巢良性疾病有助于改善卵巢癌患者的生活质量,提高生存率[6]。CA125是诊断和监测卵巢癌的首选标志物,但易受月经周期和妇科疾病如子宫腺肌病、内膜异位症、妇科炎症等的影响[7]。ROMAGNOLO等[8]发现,CA125单项在临界值为98.4 U/mL时诊断卵巢癌的灵敏度为78.3%,特异度为90.0%,临界值为147.3 U/mL时,灵敏度为65.2%,特异度为95.0%。笔者对两组患者血清CA125水平对比分析也证实,CA125鉴别诊断卵巢癌和卵巢良性肿瘤的灵敏度较低、特异度中等,可能与本研究中较多Ⅰ/Ⅱ期卵巢癌患者且对照组为卵巢良性疾病有关。HE4是一种从附睾上皮远端分离、在女性生殖系统上皮(如输卵管、宫颈内腺、前庭大腺等)和男性生殖系统(附睾和输精管)高度表达的分泌蛋白[9]。研究表明,HE4在健康人和卵巢良性疾病患者中表达水平低,在卵巢癌患者的癌组织和血清中则高表达,故HE4被认为是诊断卵巢癌的新型标志物[10]。范亚平等[11]进一步研究了HE4和CA125对卵巢癌的诊断效能,发现HE4诊断卵巢癌的灵敏度较低但特异度优于CA125。血清HE4和CA125诊断卵巢癌的Meta分析证实,HE4检测具有较高的特异度,与CA125并联检测具有较高的敏感度[12]。CEA是常规肿瘤标志物,单项或联合CA125检测对卵巢癌的辅助诊断仍有一定的临床应用价值[13]。TPA 是组织角质素分解片段的沉积物,在正常上皮细胞分解后释放至邻近的外分泌腺管道。恶性细胞由于异常基因的去抑制作用,其内容物分泌至邻近组织经溶蛋白酶消化后入血,故恶性肿瘤患者血清TPA水平升高。有研究报道,血清TPA 在卵巢癌中有较高阳性率,联合CA125能提高卵巢癌诊断的阳性率[14]。此外,SF是一类储铁蛋白,在快速分裂的卵巢癌细胞中含量较高而在其他肿瘤中含量相对较低,故有助于卵巢癌的鉴别诊断。本研究中,卵巢癌患者血清中HE4、CA125、CEA、TPA和SF显著高于卵巢良性疾病且具有较高的诊断效能和OR值,但单项的敏感度和特异度均不高。因此,单项指标鉴别诊断卵巢肿瘤的良恶性仍有一定的应用局限性。
目前,多指标联合检测是提高疾病诊断准确度的有效措施,但并联实验提高灵敏度时牺牲了特异度,串联实验提高了特异度却影响了灵敏度。联合检测的项目越多,试剂成本越高,患者医疗负担也越重。利用多元统计分析方法建立分类诊断模型可避免各项目简单相加导致的特异度下降,提高了诊断准确度,可实现对未知患者的预测分析。为了进一步阐明多元统计分析方法对卵巢癌和卵巢良性疾病的鉴别诊断价值,本研究对比分析了Fisher线性判别分析法和Logistic回归分析法的诊断和预测效果。Fisher线性判别分析法是常用的多元分析方法,在变量服从正态分布、没有显著相关或变量的平均值和方差不相关时效果较好[15]。关伟等[16]联合12种血清肿瘤标志物建立Fisher线性判别模型,该模型对妇科肿瘤诊断准确率为78.5%,显著高于单项或联合检测的准确度。目前,鲜有Fisher线性判别分析用于卵巢癌辅助诊断和预测分析的相关报道。本研究中,笔者对血清7项标志物进行ROC曲线分析,进一步以诊断效能最优的5项指标建立Fisher线性判别模型,诊断和预测效果较为理想。尽管如此,由于临床数据的多样性和复杂性,采用模型对比分析更有助于临床实践和数据的合理应用[17]。Logistic回归分析是常用的分类模型,该模型以最大似然估计法(MLE)对参数进行估计,以概率大小对个体属性进行预测,故应用较广泛。王丹丹等[18]采用Logistic回归分析了血清CA125、CA19-9、CA72-4和CEA对卵巢癌的联合诊断价值,发现4个指标联合的诊断效能均优于单一指标。本研究发现,Logistic回归分析较Fisher线性判别模型具有更高的诊断和预测准确率,提示不同的数据模型的对比分析有望挖掘更多有价值的信息、提高疾病辅助诊断和预测的准确性。
综上所述,联合检测血清CEA、SF、TPA、HE4和CA125的Logistic回归分析模型更有助于卵巢癌和卵巢良性疾病的鉴别诊断。尽管如此,筛选最佳的数据处理模型还需后续大样本深入分析和临床验证,从而更好地辅助诊断疾病和服务于临床。
[1]BADGWELL D,BAST R C.Early detection of ovarian cancer[J].Dis Markers,2015,23(5/6):397-410.
[2]MEYS E M,KAIJSER J,KRUITWAGEN R F,et al.Subjective assessment versus ultrasound models to diagnose ovarian cancer:a systematic review and meta-analysis[J].Eur J Cancer,2016,58(58):17-29.
[3]NICK A M,GANESHAN D,LYER R,et al.Personalizing surgical therapy for advanced ovarian cancer:CT imaging may not predict disease resectability[J].Gynecol Oncol,2016,141(2):160-160.
[4]LAMBERTS L E,VAN OORDT C W,TER WEELE E J,et al.ImmunoPET with anti-mesothelin antibody in patients with pancreatic and ovarian cancer before anti-mesothelin antibody-drug conjugate treatment[J].Clin Cancer Res,2016,22(7):1642-1652.
[5]李明远.VEGF和miR-205及靶蛋白Ezrin和LaminA/C在卵巢癌中的表达及意义[J].现代预防医学,2016,43(10):1915-1916,1920.
[6]EDGELL T,MARTIN-ROUSSETY G,BARKER G,et al.Phase Ⅱ biomarker trial of a multimarker diagnostic for ovarian cancer[J].J Cancer Res Clin Oncol,2010,136(7):1079-1088.
[7]GASIOROWSKA E,MICHALAK M,WARCHO W,et al.Clinical application of HE4 and CA125 in ovarian cancer type Ⅰ and type Ⅱ detection and differential diagnosis[J].Ginekol Pol,2015,86(2):88-93.
[8]ROMAGNOLO C,LEON A E,FABRICIO A S,et al.HE4,CA125 and risk of ovarian malignancy algorithm (ROMA) as diagnostic tools for ovarian cancer in patients with a pelvic mass:An Italian multicenter study[J].Gynecol Oncol,2016,141(2):303-311.
[9]GISLEFOSS R E,LANGSETH H,BOLSTAD N,et al.HE4 as an early detection biomarker of epithelial ovarian cancer investigations in prediagnostic specimens from the Janus serumbank[J].Int J Gynecol Cancer,2015,25(9):1608-1615.
[10]严婷,王萍玲,赵来刚,等.血清HE4与CA125对卵巢上皮性癌诊断价值及其与临床病理特征的关系研究[J].实用妇产科杂志,2015,31(8):595-598.
[11]范亚平,孙黎,牛爱军,等.血清人附睾蛋白4、CA125在卵巢癌诊断中的价值[J].山东医药,2014,54(29):64-65.
[12]金霞霞,沈波,颜海希,等.血清HE4和HE4/CA125并联检测对人卵巢癌诊断试验的Meta分析[J].中华检验医学杂志,2013,36(1):72-76.
[13]贺贵福,宋炳胜,赵义,等.CEA、CA125升高水平与PET/CT显像评估卵巢癌治疗后复发及转移的价值[J].中国老年学杂志,2015,35(6):1494-1496.
[14]李慧新,李君.血清脂质结合唾液酸、组织多肽抗原、组织蛋白酶、卵巢癌抗原X1及CA125联合检测对卵巢上皮性癌的诊断价值[J].中国实用妇科与产科杂志,2012,28(12):942-944.
[15]宋志刚,谢蕾蕾,何旭洪.SPSS实用教程[M].北京:人民邮电出版社,2008:233.
[16]关伟,王东,李增鹏,等.多肿瘤标志物蛋白芯片检测及判别函数在妇科肿瘤诊断中的应用[J].重庆医学,2009,38(18):2324-2325,2328.
[17]田刚,周明术,杭永伦,等.肿瘤标志对肺癌诊断价值PLS-DA和ANN-MPL模型评估[J].中华肿瘤防治杂志,2014,21(5):380-383,392.
[18]王丹丹,王敏.CA125联合 CA19-9、CEA、CA72-4检测在上皮性卵巢癌诊断中的意义[J].现代肿瘤医学,2016,24(5):818-821.

