脊髓CXCL13在大鼠骨癌痛形成中的作用
吴艳琼,柯昌斌,许先成,孙艳玲,王贤裕
(湖北省十堰市太和医院麻醉科 442000)
骨癌痛是一种复杂难治的慢性疼痛,其确切的发病机制尚未明了。趋化因子CXC配体13(CXCL13)是CXC趋化因子的一种,主要参与机体的免疫及炎性反应。近年来研究发现,CXCL13在神经系统中存在表达,并通过激活神经胶质细胞参与慢性疼痛的形成与维持,如神经病理性痛、炎性痛等[1]。骨癌痛中小胶质细胞的激活已被证实[2-4],其激活参与神经元结构与功能的重塑,介导痛觉过敏的产生和痛觉的持续状态,而CXCL13是否参与骨癌痛的病理、生理过程,有待探讨。因此,本研究拟观察胫骨癌痛大鼠CXCL13表达水平及小胶质细胞活化情况,评价CXCL13在骨癌痛中的作用。
1 材料与方法
1.1材料 健康成年雌性SD大鼠120只,体质量160~200 g,实验室温、湿度分别保持为22~24 ℃和40%~60%,采用12 h昼夜周期光照,自由进食、饮水。阴性对照siRNA和CXCL13-siRNA均由上海吉凯基因化学技术有限公司合成。将120只大鼠分为4组:假手术组(S组)、骨癌痛组(BP组)、小干扰RNA(siRNA)阴性对照(NC-siRNA)组(NC组)和CXCL13-siRNA组(CS组),每组5例。
1.2方法
1.2.1大鼠胫骨癌痛模型制备 将冻存于液氮中的Walker-256乳腺癌细胞复苏后,种植于传代用雌性SD大鼠腹腔,饲养7 d左右出现大量腹水,局部消毒后从腹腔抽取含肿瘤细胞的腹水20 mL;经离心沉淀后,稀释至所需浓度约每毫升1×108个细胞,保存于冰上备用。腹腔注射氯胺酮50 mg/kg麻醉,BP组、NC组和CS组均采用胫骨髓腔内注射等量Walker-256乳腺癌细胞的方法建立大鼠胫骨癌痛模型,三组大鼠于左胫骨上段切开约5 mm小口,暴露胫骨,5 mL注射器针头于骨上穿刺打孔,再用微量注射器缓慢注入肿瘤细胞悬浮液5 μL(1×104个),骨蜡封堵针孔,冲洗并缝合皮肤,创口处涂青霉素钠粉末预防感染。S组胫骨髓腔内注射等量生理盐水,其余处理同上。于造模即刻起,NC组鞘内注射NC-siRNA慢病毒10 μL(108TU/mL);CS组鞘内注射CXCL13-siRNA慢病毒10 μL(108TU/mL)。
1.2.2机械痛阈检测 参照文献[5]分别于造模前1 d,术后7、9、14、21 d时采用von FreyTM动态足底触觉测量仪(意大利UGO公司)测定大鼠机械缩足阈值(MWT)。大鼠置于金属笼(10 cm×10 cm×15 cm),适应环境20 min,处于静息状态时,开始测定,von Frey丝由下向上垂直刺激右侧足底中部皮肤,设定20 s内刺激逐渐由0升高为50 g,当出现快速缩足反应时,刺激自动停止,记录压力值,共测3次,间隔5 min,取其平均值作为MWT。
1.2.3HE染色观察骨结构破坏情况 取假手术和造模后大鼠胫骨。先用4%多聚甲醛固定1周,再在含10%乙二胺四乙酸(EDTA)的固定液中脱钙4周,石蜡切片。HE染色,镜下观察肿瘤生长和骨结构的破坏情况。
1.2.4免疫荧光双标检测 痛阈测定结束后,麻醉下迅速暴露心脏,用4%多聚甲醛经左心室灌注,取L4~L6脊髓组织常规固定,30%蔗糖脱水至沉底,冰冻连续切片(厚15 μm),加入封闭液,室温孵育30 min,PBS漂洗后,同时加入1∶500多克隆山羊抗大鼠CXCL13抗体(美国Abcam公司)和1∶1 000单克隆小鼠抗大鼠NeuN抗体(美国Millipore公司),孵育12 h后,PBS洗涤3次,加入相应荧光标记二抗,室温孵育2 h后,PBS洗涤3次,用50%甘油封片。激光共聚焦荧光显微镜(德国Zeiss公司)观察CXCL13在神经元上的表达情况和小胶质细胞活化情况。
1.2.5Western blot检测CXCL13和Iba-1蛋白表达 取L4~L6脊髓,加组织裂解液,经冰浴匀浆后抽提总蛋白,用BCA法进行蛋白浓度定量,取上样蛋白50 μg(20 μL),经10%SDS-PAGE凝胶分离蛋白转膜2 h,5%脱脂牛奶室温封闭膜1 h;用TBST洗膜3次,加入β-actin(1∶3 000,美国Chemicon公司)和1∶1 000稀释的羊抗大鼠CXCL13抗体、1∶1 000稀释的兔抗大鼠Iba-1抗体,洗膜3次,再加二抗(美国Jackson 公司),室温孵育2 h,洗膜3次,加入ECL显色液显色。应用全自动凝胶图像分析系统对显影胶片进行扫描与分析,以CXCL13和Iba-1条带积分光密度值与β-actin条带吸光度值的比值反映CXCL13和Iba-1的蛋白表达。
1.2.6RT-PCR法检测CXCL13和Iba-1 mRNA表达 从组织标本提取总mRNA,-70 ℃冻存。采用反转录试剂盒将mRNA反转录为cDNA,遵循PCR引物没计原则,以GAPDH作为内参照,引物由上海生物工程公司合成,序列见表1。扩增条件:94 ℃预变性5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 20 s,共45个循环;72 ℃延伸10 min。计算CXCL13和Iba-1与内参照GAPDH的比值作为目的基因的相对表达量。

表1 RT-PCR 引物序列

2 结 果
2.1各组大鼠术后不同时点机械痛阈的比较 与S组比较,BP和NC组接种后第9天机械痛阈显著下降,并持续至实验结束(P<0.05);与BP组比较,CS组造模后第9天机械痛阈显著升高,并持续至实验结束(P<0.05),见表2。

表2 各组大鼠术后不同时点机械痛阈的比较
a:P<0.05,与S组比较;b:P<0.05,与N组比较
2.2HE染色结果 光镜下观察显示S组骨髓腔内见各种正常的骨髓细胞,无异常骨结构的改变,模型组术后7 d大鼠注射侧胫骨骨髓腔内及骨小梁间被大量肿瘤细胞填充,肿瘤细胞生长活跃,已穿破骨皮质,侵及周围肌肉及软组织,后期出现骨质破坏和病理性骨折,见图1。

A:S组;B:模型组术后7 d;C:模型组术后14 d;D:模型组术后21 d
图1 S组与模型组骨结构病理学结果(×300)

图2 脊髓小胶质细胞在各组中的活化情况(×40)

图3 CXCL13在各组大鼠脊髓中的表达分布(×20)
2.3免疫荧光双标结果 骨癌痛大鼠脊髓小胶质细胞明显活化,CXCL13-siRNA慢病毒脊髓注射则明显减少其活化(图2);CXCL13在神经元中存在表达,骨癌痛大鼠脊髓中CXCL13表达升高;CXCL13-siRNA慢病毒脊髓注射则明显减少CXCL13的表达(图3)。
2.4CXCL13和Iba-1蛋白及mRNA表达水平 与S组比较,BP和NC组CXCL13和Iba-1蛋白及mRNA水平明显上调(P<0.05);与BP组比较,CS组CXCL13和Iba-1蛋白及mRNA表达水平显著下调(P<0.05),见表4、5。
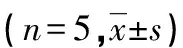
表4 各组大鼠术后脊髓CXCL13、Iba-1蛋白表达的比较
a:P<0.05,与S组比较;b:P<0.05,与BP组比较
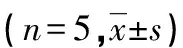
表5 各组大鼠术后脊髓CXCL13、Iba-1 mRNA表达的比较
a:P<0.05,与S组比较;b:P<0.05,与BP组比较
3 讨 论
本实验参照文献[6]建立大鼠胫骨癌痛模型,该模型操作简单,评价方法成熟,与人类骨癌痛病理生理学特征相似,已被广泛应用于骨癌痛的实验研究。本研究中,模型组大鼠术后各测量时点机械痛阈降低,并出现渐行性加重的自发痛行为,胫骨HE染色显示骨质严重破坏,假手术组未见明显异常,行为学及骨破坏研究结果均提示该模型制备成功。
趋化因子CXCL13属CXC类趋化因子,是定向趋化B细胞的主要调节因子,与B细胞表面的相应受体发生特异性结合后可调控B细胞的定向趋化。在慢性疼痛、肿瘤、自身免疫性疾病及多种感染性疾病中,各种T、B、单核细胞都会大量聚集,诱导CXCL13在脊髓及局部组织中大量表达,从而导致疼痛、炎症的发生及局部组织器官的损伤[7-8],由此可见CXCL13的异常在许多疾病的发生和发展过程中有着重要作用。本研究结果表明,鞘内注射CXCL13-siRNA慢病毒干扰后,CXCL13在神经元的表达下调,脊髓CXCL13表达亦下调,大鼠对疼痛的耐受程度增强,提示CXCL13参与了骨癌痛的发生与发展。
在脊髓水平,胶质细胞不仅对神经元起营养与支持作用,还参与了疼痛的调节和整合[8]。研究证实,小胶质细胞在慢性神经病理性疼痛的发病机制中发挥重要作用,抑制小胶质细胞的活化,可减少促炎因子的分泌,抑制兴奋性氨基酸、一氧化氮等致痛物质的释放,从而导致脊髓背角痛觉神经元的兴奋性降低[9]。在骨癌痛研究中证实,脊髓小胶质细胞大量激活是引起癌症患者产生疼痛的重要因素,鞘内给予小胶质细胞抑制剂,可使癌痛大鼠的痛阈显著增加,明显减轻其痛行为[10]。本研究中,与S组比较,BP、NC组术后各测量时点Iba-1蛋白表达上调,同时脊髓背角小胶质细胞明显增生、肥大,而CS组则出现小胶质细胞数目及突起数降低,胞体皱缩,提示小胶质细胞的活化参与了大鼠胫骨癌痛的形成。
本研究中,通过检测小胶质细胞特异性标记物Iba-1的表达,发现注射CXCL13-siRNA慢病毒后大鼠脊髓小胶质细胞活化程度受到明显地抑制,CXCL13的表达和小胶质细胞的活化具有同步性,证实了CXCL13的活化是调节疼痛敏感的重要环节。其作用机制可能是癌痛产生后神经元通过自身合成分泌的免疫因子参与小胶质细胞活性的调控,激活小胶质细胞,从而增强突触后脊髓背角痛觉传递神经元的敏感性和反应性,导致中枢敏化[11],加重骨癌痛。
综上所述,脊髓CXCL13通过激活小胶质细胞参与了大鼠骨癌痛的形成与维持,抑制CXCL13与小胶质细胞之间的活化通路,能够有效地阻止或逆转疼痛的发生。
[1]FESTA ED,HANKIEWICZ K,KIM S,et al.Serum levels of CXCL13 are elevated in active multiple sclerosis[J].Mult Scler,2009,15(11):1271-1279.
[2]CAO H,ZHANG YQ.Spinal glial activation contributes to pathological pain states[J].Neurosci Biobehav Rev,2008,32(5):972-983.
[3]OLSON JK.Immune response by microglia in the spinal cord[J].Ann NY Acad Sci,2010,1198(10):271-278.
[4]MILLIGAN ED,WATKINS LR.Pathological and protective roles of glia in chronic pain[J].Nat Rev Neurosci,2009,10(1):23-36.
[5]CHAPLAN SR,BACH FW,POGREL JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55-63.
[6]姚明,杨建平,王丽娜,等.腹水传代与体外培养Walker256癌细胞株建立大鼠骨癌痛模型的可行性[J].中华医学杂志,2008,88(13):880-884.
[7]WANG D,DUBOIS RN,RICHMOND A.The role of chemokines in intestinal inflammation and cancer[J].Curr Opin Pharmacol,2009,9(6):688-696.
[8]商剑,柯昌斌,邱飞梅,等.脊髓趋化因子CXC配体13在大鼠神经病理性痛中的作用[J].中华麻醉学杂志,2013,33(5):569-572.
[9]WACNIK PW,KEHL LJ,TREMPE TM,et al.Tumor implantation in mouse humerus evokes movement-related hyperalgesia exceeding that evoked by intramuscular carrageenan[J].Pain,2003,101(1/2):175-186.
[10]TSUDA M,SHIGEMOTO-MOGAMI Y,KOIZUMI S,et al.P2X4 receptors induced in spinal microglia gate tactile allodynia after nerve injury[J].Nature,2003,424(6950):778-783.
[11]申文,孙玉娥,苏小虎,等.鞘内注射氟代柠檬酸和/或米诺四环素对骨癌痛小鼠脊髓胶质细胞增殖及活化的影响[J].肿瘤学杂志,2009,15(10):903-907.

