XELOX方案与贝伐单抗联合治疗转移性结直肠癌的疗效观察
高颖斐,高颖雯,张 强
(1.昆明医科大学第二附属医院检验科,昆明 650101 ;2.云南省昆明市盘龙区妇幼保健计划生育服务中心妇保科 650000;3.昆明医科大学第三附属医院/云南省肿瘤医院体检中心,昆明 650118)
结直肠癌是常见的恶性肿瘤,在我国发病率和病死率均呈上升趋势[1]。目前尚未完全明确其病因与发病机制,或与遗传、免疫、病毒感染有关,同时与环境因素如生活习惯、体质量等也密切相关[2]。结直肠癌患者近半数可在早期发现并通过手术治愈,但有多数患者未能及时发现,就诊时肿瘤已发生转移。为了改善转移性结直肠癌患者的治疗效果和生活质量,通常采用化疗作为主要的治疗手段。笔者回顾性评价了奥沙利铂+卡培他滨(XELOX)联合贝伐单抗的方案与单独使用XELOX方案分别治疗转移性结直肠癌的临床疗效,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2013年6月至2016年12月昆明医科大学第二附属医院收治的56例转移性结直肠癌患者,所有患者均经病理组织学确诊。患者中男31例,女25例;年龄42~78岁,其中≥60岁30例,<60岁26例;结肠癌37例,直肠癌19例,病理类型均为腺癌。入选标准:功能状态评分(Karnofsky评分)≥70分;预计生存期超过6个月;无明显化疗禁忌证;排除心率失常、心肌梗死病史者;通过调整后各项指标达到相应标准,治疗前1个月内未接受过抗肿瘤治疗。按随机数字表法,将上述患者分为观察组和对照组各28例,两组患者的性别、年龄、病变部位、病理类型、分化程度、身体状况等方面差异无统计学意义(P>0.05),具有可比性。
1.2方法 对照组采用XELOX方案:奥沙利铂注射液,第1天,130 mg/m2,静脉滴注2~6 h;卡培他滨片,1 000 mg/m2,第1~14天,口服,2次/天,于早晚餐后服用;21 d为1个疗程。治疗组:贝伐珠单抗注射液,第1天,5 mg/kg,静脉滴注;同时联合XELOX方案,具体方法同对照组;21 d为1个疗程。化疗过程中出现呕吐者给予昂丹司琼止吐,出现手足综合征者给予维生素B6和外用尿素霜治疗,发生粒细胞减少者给予重组人粒细胞刺激因子治疗,发生骨转移者采用唑来膦酸治疗。
1.3评价标准 近期疗效评价:每例患者治疗时间不低于2个周期,治疗期间密切监测血常规、肝肾功能,每两个周期进行CT和肿瘤标志物的复查。采用RECIST1.1实体瘤疗效评价标准对疗效进行评价,将总疗效评价分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD);有效率(RR)=(CR例数+PR例数)/总例数×100%;疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%;无进展生存时间(PFS);不良反应评价:根据抗癌药物常见不良反应分级标准将患者治疗过程中所发生的不良反应分为0~Ⅳ度。对完成治疗的患者进行随访。条件允许者建议定期至门诊进行复查,并对其结果进行跟踪;条件不便者通过电话随访以了解情况。

2 结 果
2.1近期疗效评价 化疗结束后对两组结果进行评价,结果显示两组患者的RR分别为42.86%和32.14%,差异无统计学意义(P>0.05);两组患者的DCR分别为85.71%和67.86%,差异有统计学意义(P<0.05)。见表1。
2.2远期疗效评价 两组均无失访病例。其中治疗组的中位PFS为8个月(95%CI:6.52~9.48),对照组的中位PFS为11个月(95%CI:9.52~12.40),治疗组的中位PFS较对照组高,两组对比差异有统计学意义(P<0.05)。治疗组和对照组的中位总生存时间分别为14个月(95%CI:11.41~16.59)和21个月(95%CI:15.81~26.19),表明治疗组的中位总生存时间较对照组高。两组对比差异有统计学意义(P<0.05)。
2.3不良反应评价 两组患者的不良反应主要为骨髓抑制及胃肠道反应,治疗组的不良反应发生率较对照组高,两组对比差异无统计学意义(P>0.05)。患者通过相应的对症治疗后均得到有效控制。见表2。

表1 两组患者近期疗效评价[n(%)]
注:与对照组比较,*P<0.05
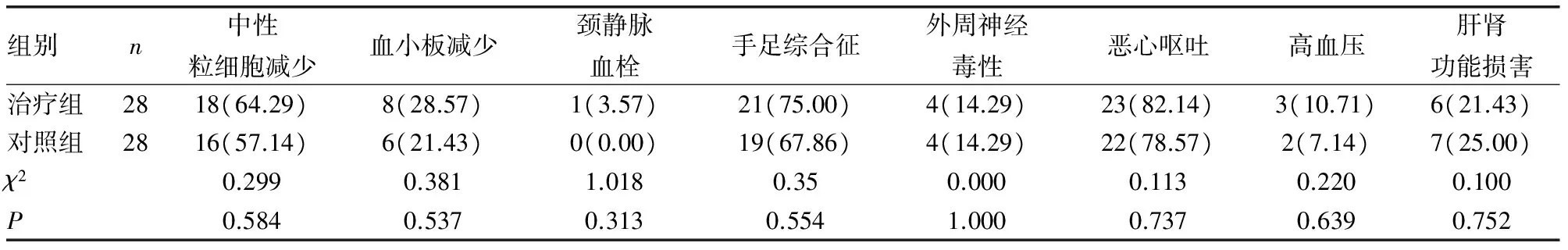
表2 两组不良反应比较[n(%)]
3 讨 论
结直肠癌为世界范围内发病率和病死率的恶性肿瘤。手术治疗是早期结直肠癌的有效治疗手段,但对于术后复发和已发生转移的患者而言,化疗是改善生存率和生存质量的重要手段。近年来,新的化疗药物,如奥沙利铂、卡培他滨、伊立替康等,以及贝伐单抗和西妥昔单抗等新型分子靶向治疗药物的出现,为患者提供了更多的治疗方案[3]。
血管内皮生长因子(VEGF)被认为是促进肿瘤播散、转移的物质,特异性地作用于血管内皮细胞,参与肿瘤的新生[4-5]。有研究表明,VEGF对结直肠癌的发生发展具有重要作用[6]。因此抑制VEGF的表达则成为抑制肿瘤血管生成、治疗肿瘤的重要途径。贝伐单抗是一种直接阻断VEGF与其受体结合的人源化、人鼠嵌合体单克隆抗体[7],目前在治疗结直肠癌、脑胶质瘤、非小细胞肺癌等疾病中获得了较好的效果。
目前在我国,XELOX方案在治疗晚期结直肠癌上已经使用相当普遍。有研究表明,XELOX方案较奥沙利铂-亚叶酸钙-氟尿嘧啶(FOLFOX)方案显示出一定的优势[8]。通过上述分析,本研究将XELOX方案与贝伐单抗联合,进行疗效及不良反应评价。
本研究结果显示,近期疗效中,两组的RR比较差异无统计学意义(P>0.05),但治疗组的DCR明显高于对照组,差异有统计学意义(P<0.05)。对于长期疗效评价,XELOX方案与贝伐单抗联合使用可显著提高中位PFS和中位总生存时间。不良反应比较显示,两组均存在一定的不良反应,差异无统计学意义(P>0.05),表明二者不良反应差异较小。不良反应均可通过对症治疗得到控制。因此可认为贝伐单抗临床应用是安全、有效的。
综上所述,XELOX方案与贝伐单抗联合使用相对于单独应用XELOX方案,疗效更好且不良反应相当,可将其作为治疗结直肠癌的一线药物。
[1]董志伟,乔友林,李连弟,等.中国癌症高发现场报告[J].中国肿瘤,2009,18(1):4-9.
[2]WATANABE T,NISHIWAKI N,KAJIWARA Y,et al.Efficacy of chemotherapy combined with bevacizumab for unresectable advanced or recurrent colorectal cancer[J].Gan To Kagaku Ryoho,2013,40(1):71-74.
[3]BENDELL J C,BEKAII-SAAB T S,COHN A L,et al.Treatment patterns and clinical outcomes in patients with metastatic colorectal cancer initially treated with FOLFOX-bevacizumab or FOLFIRI-bevacizumab:results from Aries,a bevacizumab observational cohort study[J].Oncologist,2012,17(12):1486-1495.
[4]刘刚.血管内皮生长因子与肿瘤生长的关系[J].解放军医学院学报,2010,13(1):93-94.
[5]陈映霞,秦叔逵,刘秀峰,等.重组人血管内皮抑制素联合化疗治疗转移性结直肠癌的临床观察[J].临床肿瘤学杂志,2010,15(8):728-732.
[6]KIM J Y,BAE B N,KWON J E,et al.Prognostic significance of epidermal growth factor receptor and vascular endothelial growth factor receptor in colorectal adenocarcinoma[J].APMIS,2011,119(7):449-459.
[7]常琳,宗红,王留兴,等.贝伐单抗联合FOLFIRI方案治疗晚期结直肠癌的临床观察[J].肿瘤防治研究,2013,40(5):485-488.
[8]郭宇.对比XELOX方案与FOLFOX方案针对转移性结直肠癌的疗效和安全性的meta分析[D].重庆:重庆医科大学,2014.

