不同放疗方案辅助治疗中晚期宫颈癌合并盆腔淋巴结转移对比观察
吴明梅,魏 坤,李正清
(1.四川省达州华康医院妇产科 635000;2.四川省达州市中心医院妇产科 635000)
流行病学研究显示,我国宫颈癌发病人数及发病率均呈逐年升高趋势,并已居于我国女性生殖系统肿瘤发病及病死率首位,严重威胁生命安全[1]。对于中晚期宫颈癌患者的临床治疗,通常首选同步放化疗方案[2];而随着调强放疗技术发展及普及,宫颈癌临床放疗已进入精确治疗时代,并取得令人满意疗效[3]。目前相关临床诊疗指南仅在宫颈癌放疗靶区勾画方面制订了统一标准[4],而对于合并淋巴结转移者采用何种方式进行放疗补充尚缺乏相关随机对照研究。本次研究以四川省达州市华康医院2011年6月至2013年6月收治的中晚期宫颈癌合并盆腔淋巴结转移共100例患者作为研究对象,分别在顺铂化疗基础上同步采用后程与同期调强放疗加量方案辅助治疗,探讨两种调强放疗加量方案辅助治疗中晚期宫颈癌合并盆腔淋巴结转移患者的疗效及安全性差异,现将结果报道如下。
1 资料与方法
1.1一般资料 选取四川省达州市华康医院2011年6月至2013年6月收治的中晚期宫颈癌合并盆腔淋巴结转移患者共100例,以随机数字表法分为A组和B组,每组50例。A组患者年龄38~67岁,平均(51.80±6.22)岁;依据国际妇产科协会(FIGO)分期,Ⅱa期12例,Ⅱb期20例,Ⅲa期6例,Ⅲb期12例;根据病理分型,鳞癌41例,腺癌7例,腺鳞癌2例。B组患者年龄40~69岁,平均(51.92±6.27)岁;依据FIGO分期,Ⅱa期14例,Ⅱb期21例,Ⅲa期5例,Ⅲb期10例;根据病理分型,鳞癌41例,腺癌7例,腺鳞癌2例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)经宫颈TCT及病理活检确诊宫颈癌,符合FIGO分期Ⅱa~Ⅲb期[5];(2)入院时未接受任何放化疗治疗;(3)出现盆腹腔淋巴结转移;(4)卡氏评分≥70分;(5)研究方案经医院伦理委员会批准;(6)患者及家属签署知情同意书。排除标准:(1)有放化疗禁忌证;(2)既往有盆腹腔手术史;(3)有其他系统恶性肿瘤;(4)有胃肠道及膀胱基础疾病;(5)有精神系统疾病;(6)有血液系统疾病;(7)有重要脏器功能障碍;(8)妊娠哺乳期女性;(9)临床资料不全。
1.2方法 入选患者放疗前均行CT模拟定位,扫描范围包括胸10椎体上缘治股骨中段,扫描层厚5 mm。临床靶区勾画采用Eclipse 8.0系统;根据美国肿瘤放射治疗协作组织(RTOG)根治性宫颈癌靶区勾画共识进行照射区域确定;其中GTV-n和GTV-t分别为阳性区域淋巴结区、宫颈原发肿瘤区;CTV-t区包括宫颈病灶GTV、全部宫颈、宫旁、宫体及病变下方3 cm阴道区域;CTV-n淋巴引流区包括双侧闭孔、髂内、髂外、髂总及骶前淋巴结。A组患者采用后程调强放疗加量方案,即首先给予1.85 Gy/f×25 f放疗,之后给予阳性淋巴结区域2 Gy×7 f放疗,总剂量60 Gy。B组患者采用同期调强放疗加量方案,即2.4 Gy/f×25 f,总剂量60 Gy;而GTV-t、CTV-t及CTV-n区域放疗方案相同,即1.85 Gy/f×25 f,外照射完成后再行腔内后程放疗,A点每次剂量为600 cGy,每周2次,共5次,宫颈病灶处累积剂量应大于或等于85 Gy。两组均同期给予顺铂(江苏豪森药业股份有限公司生产,规格10 mg,国药准字H20040812)同步化疗,40 mg/m2静脉滴注,每周1次,共行6次;化疗前采用托烷司琼预防恶心呕吐,如白细胞计数<3.0×109/L者应立即给予重组人类粒细胞集落刺激因子(rhG-CSF)。
1.3观察指标 (1)随访3年,记录患者总生存期(OS),无进展生存期(PFS)及远处转移时间(DMR),计算中位值;其中FPS是指治疗开始至随访结束时无肿瘤复发或死亡[5];(2)随访3年,记录患者放射野内淋巴结转移例数、宫颈/阴道复发例数及远处转移例数,计算百分比;(3)记录患者小肠Dmax、小肠D2cc、直肠Dmax及膀胱D1cc危及器官剂量,计算平均值;(4)药物不良反应判定标准依据美国肿瘤放射治疗协作组织/欧洲癌症治疗研究组织(RTOG/EORTC)急性放射性损伤分级标准进行评价[5],包括放射性直肠炎、放射性膀胱炎、骨髓抑制、消化道反应及肝功能损伤等。
1.4疗效评价标准[5]疗效评价参照WHO实体瘤治疗效果判定标准(RECIST):(1)完全缓解(CR),病灶完全消失,维持时间大于4周;(2)部分缓解(PR),病灶体积缩小在基础水平的50%以上,维持时间大于4周,且未发现新病灶;(3)稳定(SD),病灶体积缩小在基础水平的50%以上或病灶体积增大在基础水平的25%以下,且未发现新病灶;(4)进展(PD),病灶体积增大在基础水平的25%以上或发现新病灶。总有效率=(CR例数+PR例数)/总例数×100%。

2 结 果
2.1两组患者临床疗效比较 B组患者放疗完成时临床疗效显著优于A组(P<0.05);两组患者放疗后3个月临床疗效比较差异无统计学意义(P>0.05)。见表1。
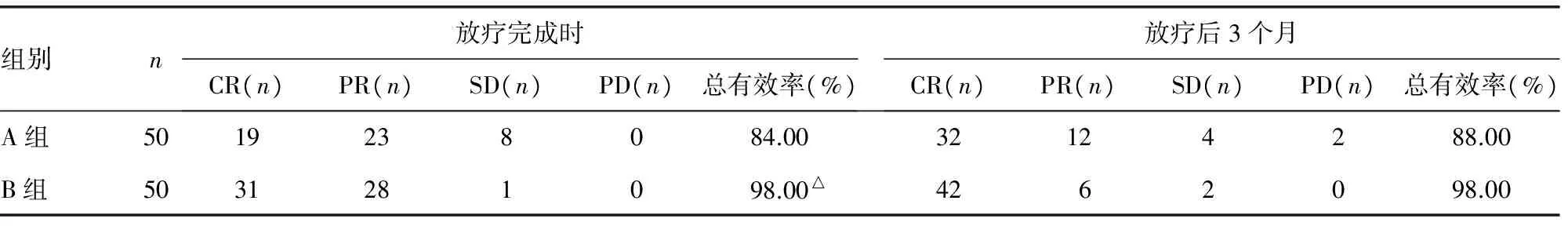
表1 两组患者临床疗效比较[n(%)]
注:与A组比较,△P<0.05
2.2两组患者中位OS、PFS及DMR时间比较 A组患者中位OS、PFS及DMR时间分别为18.1个月(95%CI:18.5~24.1)、13.7个月(95%CI:12.7~18.8)、15.0个月(95%CI:15.3~21.6);B组患者中位OS、PFS及DMR时间分别为23.2个月(95%CI:18.0~24.0)、16.4个月(95%CI:12.2~18.5)、18.7个月(95%CI:15.0~21.2);B组患者中位OS、PFS及DMR时间均显著长于A组,差异有统计学意义(P<0.05)。
2.3两组患者复发转移率比较 B组患者放射野内淋巴结转移率显著低于A组(P<0.05);两组患者宫颈/阴道复发率和远处转移率比较差异无统计学意义(P>0.05),见表2。

表2 两组患者复发转移情况比较[n(%)]
注:与A组比较,△P<0.05
2.4两组患者危及器官放射剂量比较 B组患者小肠Dmax、直肠Dmax及膀胱D1cc放射剂量显著低于A组(P<0.05);两组患者小肠D2cc放射剂量比较差异无统计学意义(P>0.05)。见表3。
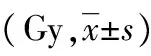
表3 两组患者危及器官放射剂量比较
注:与A组比较,△P<0.05
2.5两组患者药物不良反应发生率比较 两组患者放射性直肠炎、放射性膀胱炎、消化道反应及肝功能损伤发生率比较差异无统计学意义(P>0.05);B组患者骨髓抑制发生率显著低于A组(P<0.05),见表4。

表4 两组患者药物不良反应发生情况比较[n(%)]
注:与A组比较,△P<0.05
3 讨 论
已有研究显示,宫颈癌已居于我国女性生殖系统恶性肿瘤发病率第1位,而合并盆腹腔淋巴结转移则是患者预后不良的重要独立危险因素[6]。宫颈癌患者常规给予病灶区域45 Gy照射,尽管可对亚临床病灶进行有效控制,但难以降低合并淋巴结转移者远期复发转移风险[7]。国外学者研究证实,对阳性淋巴结区域进行补充照射有助于延长宫颈癌患者生存时间,改善临床预后[8]。既往二维放疗方案进行盆腹腔补充放疗易造成严重不良反应,损伤盆腹腔重要脏器,治疗依从性和耐受性较差;以调强放疗技术为代表的精确放射治疗方案具有提高病灶区照射剂量,降低周围组织受量及不良反应等优点,并逐渐在阳性淋巴结补充放疗中得到大量应用[9]。
欧美宫颈癌临床诊疗指南认为对于合并盆腹腔阳性淋巴结患者推荐进行加量放疗,但具体照射方式和剂量均无明确规定[10];以往采用后程调强放疗加量方案在常规45 Gy方案基础上再延长放疗时间1~2周;但大量临床报道证实,宫颈癌患者放疗时间超过8周后,5年生存率随放疗时间延长而降低,即每延长1 d生存率下降超过2%[11-12]。而同期调强放疗加量则是一种以固定野调强放疗为基础,在同一放射野内对高危和低危区域进行差异化剂量应用的放疗方案;该方案可实现高危靶区与低危靶区同步放疗,以往多用于头颈部肿瘤、宫颈癌术后阴道残端补充放疗,而对于阳性淋巴结区域应用效果和安全性方面的报道较少[13-14]。
本次研究结果中,B组患者放疗完成时临床疗效显著优于A组(P<0.05);B组患者中位OS、PFS及DMR时间均显著长于A组(P<0.05);B组患者放射野内淋巴结转移率显著低于A组(P<0.05),证实同期调强放疗加量方案用于中晚期宫颈癌合并盆腔淋巴结转移患者治疗有助于延缓病情进展,提高生存率及降低转移复发风险。B组患者小肠Dmax、直肠Dmax及膀胱D1cc放射剂量显著低于A组(P<0.05),说明中晚期宫颈癌合并盆腔淋巴结转移患者给予调强放疗加量方案辅助治疗可有效减少盆腹腔脏器照射剂量,提高治疗安全性;而两组患者小肠D2cc放射剂量比较差异无统计学意义(P>0.05),笔者认为这可能与小肠持续蠕动导致最大照射剂量点并未处于小肠部位同一区域密切相关。需要注意行后程调强放疗加量方案者直肠和膀胱区域照射量较同期方案增加,但两组患者放射性直肠炎和放射性膀胱炎发生率比较差异无统计学意义(P>0.05),造成这一现象原因可能为盆腔阳性淋巴结多分布于直肠膀胱两侧,而后程放疗中在直肠前壁和膀胱后壁三角是直肠和膀胱区域最大照射剂量点,两者基本无重叠区域[15]。
本次研究结果中,B组患者骨髓抑制发生率显著低于A组(P<0.05),提示同期调强放疗加量方案辅助治疗中晚期宫颈癌合并盆腔淋巴结转移在降低骨髓抑制发生,改善治疗依从性方面优势明显;已有研究显示,骨性盆腔造血功能约占全身的40%~50%,故放疗后骨髓抑制是宫颈癌患者主要不良反应之一[16];相较于后程调强放疗加量方案,同期调强加量方案仅在低危区和淋巴结转移区域进行照射,未对骨盆照射剂量和时间产生影响,这是该方案在避免骨髓抑制方面具有优势的重要原因之一。
综上所述,同期调强放疗加量方案辅助治疗中晚期宫颈癌合并盆腔淋巴结转移可有效控制病情进展,延长生存时间,降低淋巴结内转移风险,且有助于减轻骨髓抑制程度,价值优于后程调强放疗加量方案。
[1]FERNANDEZ-OTS A,CROOK J.The role of intensity modulated radiotherapy in gynecological radiotherapy:present and future[J].Rep Pract Oncol Radiother,2013,18(6):363-370.
[2]HOSAKA M,WATARI H,KATO T,et al.Clinical efficacy of paclitaxel /cisplatin as an adjuvant chemotherapy for patients with cervical cancer who underwent radical hysterectomy and systematic lymphadenectomy[J].J Surg Oncol,2012,105(6):612-616.
[3]ZHANG W Z,ZHAI T T,LU J Y,et al.Volumetric modulated arc therapy vs C-IMRT for the treatment of upper thoracic esophageal cancer[J].PLoS ONE,2015,10(3):e0121385.
[4]YU C X,TANG G.Intensity-modulated arc therapy:principles,technologies and clinical implementation[J].Phys Med Biol,2011,56(5):R31-R54.
[5]陈惠祯,蔡红兵.现代妇科肿瘤学[M].武汉:湖北科学技术出版社,2006:206-207.
[6]REIG A,MEMBRIVE I,FORO P,et al.Long-term results and prognostic factors of patients with cervical carcinoma treated with concurrent chemoradiotherapy[J].Clin Transl Oncol,2011,13(7):504-508.
[7]VALE C L,TIERNEY J F,DAVIDSON S E,et al.Substantial improment in UK cervical cancer survival with chemoradiotherapy:results of a Royal College of radiologists′audit[J].Clin Oncol,2010,22(7):590-601.
[8]ABE A,FURUMOTO H,NISHIMURA M,et al.Adjuvant chemotherapy following concurrent chemoradiotherapy for uterine cervical cancer with lymphadenopathy[J].Oncol Lett,2012,3(3):571-576.
[9]WEI L C,WANG N,SHI M,et al.Clinical outcome observation of preoperative concurrent chemoradiotherapy/radiotherapy alone in 174 Chinese patients with local advanced cervical carcinoma[J].Oncol Targets Ther,2013,33(6):67-74.
[10]HANSEN H,HOGDALL C,ENGELHOLM S.Radiation therapy without cisplatin for elderly cervical cancer patients[J].Int J Radiat Oncol Biol Phys,2014,90(1 Suppl):S484-S485.
[11]JOHNSTON M,CLIFFORD S,BROMLEY R,et al.Volumetric-modulated arc therapy in head and neck radiotherapy:a planning comparison using simultaneous integrated boost for naso pharynx and oropharynx carcinoma[J].Clin Oncol,2011,23(8):503-511.
[12]KATRIEN V,PHILIPPE T,AMIN M,et al.Postoperative intensity-modulated arc therapy for cervical and endometrial cancer:A prospective report on toxicity[J].Int J Radiation Oncol Biol Phys,2012,84(2):408-414.
[13]CHUNG H H,CHEON G J,KANG K W,et al.Preoperative PET/CT FDG standardized uptake value of pelvic lymph nodes as a significant prognostic factor in patients with uterine cervical cancer [J].Eur J Nucl Med Mol Imaging,2014,41(4):674-681.
[14]JIA M X,ZHANG X,YIN C,et al.Peripheral dose measurements in cervical cancer radiotherapy:a comparison of volumetric modulated arc therapy and step- and- shoot IMRT techniques[J].Radiat Oncol,2014,7(1):1-7.
[15]RENARD-OLDRINI S,GUINEMENT L,SALLERON J,et al.Dosimetric comparaison between VMAT and tomotherapy with paraaortic irradiation for cervix carcinoma[J].Cancer Radiother,2015,19(8):733-738.
[16]SHARFO A W,VOET P W,BREEDVELD S,et al.Comparison of VMAT and IMRT strategies for cervical cancer patients using automated planning[J].Radiother Oncol,2015,114(3):395-401.

