静息状态下MOC对慢性心力衰竭患者预后的影响*
韦雪锋,张疆华,周贤惠,李耀东,邢 强,汤宝鹏
(新疆医科大学第一附属医院心脏中心心脏起搏电生理科,乌鲁木齐 830011)
慢性心力衰竭(CHF)是各种心血管疾病发展的终末阶段,尽管循证医学得到了快速发展,CHF的预防及治疗得到了很大的提高,但其发病率与病死率仍呈逐年增加的趋势,总体预后较差。因此,早期筛查并诊断心血管事件风险较高的患者,对其治疗及预后具有一定的临床实用价值。
CHF可代偿性的引起心率加快、心肌收缩力增强及外周血管收缩,使心肌耗氧量(MOC)增加。心脏由冠状动脉供血,心肌摄取冠状动脉循环中可利用的氧,继而经冠状动脉窦回流入右心房,造成了冠状动脉与冠状动脉窦之间的血氧饱和度差值,该差值可以间接反映MOC[1-2]。已有相关的研究证实,冠状动脉窦血氧含量与CHF的预后有显著的相关性[3],而MOC与CHF预后之间的关系研究较少。本文旨在探讨静息状态下MOC对CHF预后的影响,为CHF的临床研究及预后判断提供更多的依据。
1 资料与方法
1.1一般资料 根据2007年中国CHF诊断治疗指南[4],连续选取2014年3月至2015年9月于本院心内科住院确诊为CHF的患者79例,其中男48例,女31例,平均年龄(61.15±9.75)岁。入选标准:(1)具有明确的器质性心脏病病史,且病史>6个月;(2)有心力衰竭的症状和体征;(3)左心室射血分数(LVEF)<50%;(4)能完成本研究相关病史采集,愿意行冠状动脉造影检查,并签署知情同意。排除标准:(1)无器质性心脏病病史;(2)有明确的器质性心脏病病史,但LVEF≥50%;(3)同时患有甲状腺功能亢进、贫血等增加MOC者;(4)不能配合完成本研究所需标本的采集、不能完成随访者。所有入选参加本研究的患者均签署知情同意书。入选的79例患者,按美国纽约心脏病协会(NYHA)心功能分级标准:Ⅰ级7例,Ⅱ级9例,Ⅲ级22例,Ⅳ级6例;基础病变:冠心病24例,扩张型心肌病43例,高血压性心脏病4例,瓣膜性心脏病8例。患者入院后测得MOC,其水平为64.44%±6.58%,取均数近似值65%为界,分为高MOC组(MOC>65%)和低MOC组(MOC≤65%)。按随访时间内是否发生心血管事件(定义为心源性死亡或因心力衰竭再住院),分为心血管事件组(事件组)和非心血管事件组(非事件组)。
1.2方法
1.2.1MOC测定 采用心导管法采血,所有患者行冠状动脉造影检查之前均进行相关治疗,其心功能已恢复至纽约心功能分级Ⅱ级及以上;患者取平卧位,于一侧股静脉及对侧股动脉分别置入冠状动脉造影导管,在造影剂及X线透视下采集冠状窦、冠状动脉开口处及股静脉血各4 mL,加入促凝真空试管中,采用Abbott i-STAT EG7+(Abbott Park,IL,USA)进行血气分析,测定氧分压、血氧饱和度,分别测定两次,取平均值,MOC可用主动脉弓血氧饱和度与冠状动脉窦血氧饱和度[SpO2(CS)]差值表示。
1.2.2随访方法 详细记录入选患者性别、年龄、病因、NYHA分级、心力衰竭病史、血压、血液指标及超声心动图结果,患者出院后门急诊治疗情况和患者的联系方式均有明确记录。所有患者出院后满3个月至少进行1次门诊或电话随访,查阅门诊病历,记录长期治疗情况,死亡患者记录死亡时间及死亡原因。所有数据分析截止至2016年3月,仍存活的患者随访时间按入院时间至最后随访时间计算;对死亡的患者,随访时间按入院时间至死亡时间计算。

2 结 果
2.1低MOC组与高MOC组临床资料及随访结果的比较 低MOC组男25例、女20例,高MOC组男18例、女16例,两组性别比较差异无统计学意义(P>0.05)。与高MOC组相比,两组年龄、收缩压(SBP)、舒张压(DBP)、血红蛋白(Hb)、肌酐(CR)、丙氨酸氨基转移酶(ALT)、肌酸激酶同工酶(CK-MB)、左室舒张末期容积(LVED)、左心房内径(LA)差异无统计学意义(P>0.05);与低MOC组相比,高MOC组B型利钠肽(BNP)、MOC均较高,LVEF、SpO2(CS)均较低,差异有统计学意义(P<0.05)。见表1。随访结果:79例患者出院后随访7~24个月,低MOC组失访3例,高MOC组失访1例,总失访4例,失访率5.0%。75例随访患者中因心力衰竭再次入院患者共31例,心源性死亡共13例,发生心血管事件共34例。两组心血管事件发生率比较:高MOC组再次入院率、心源性死亡率、心血管事件发生率均高于低MOC组,差异有统计学意义(P<0.05)。见表2。进一步计算RR,高MOC组再次入院、心源性死亡、总的心血管事件发生的风险分别是低MOC组的2.68、3.56、3.08倍,95%CI分别为:1.04~6.90、0.99~12.86、1.19~7.94。

表1 低MOC组与高MOC组临床资料的比较
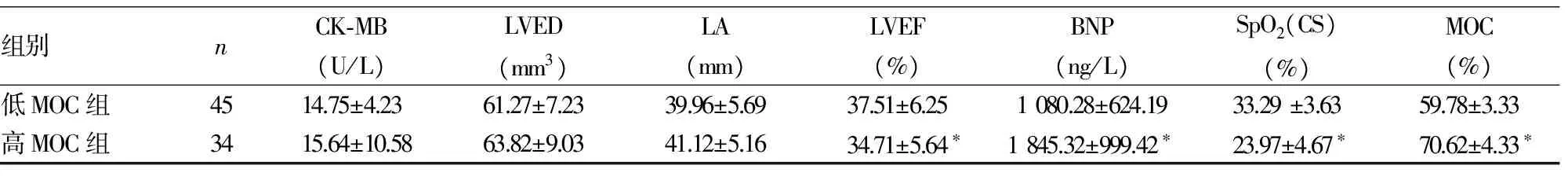
组别nCK⁃MB(U/L)LVED(mm3)LA(mm)LVEF(%)BNP(ng/L)SpO2(CS)(%)MOC(%)低MOC组4514.75±4.2361.27±7.2339.96±5.6937.51±6.251080.28±624.1933.29±3.6359.78±3.33高MOC组3415.64±10.5863.82±9.0341.12±5.1634.71±5.64∗1845.32±999.42∗23.97±4.67∗70.62±4.33∗
注:与低MOC组比较,*P<0.05
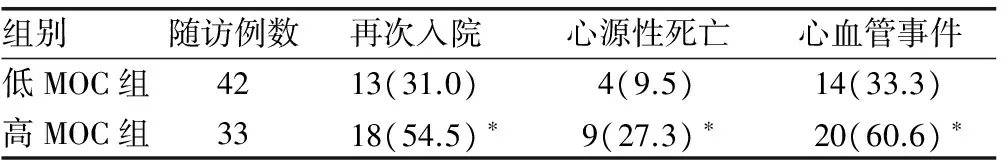
表2 低MOC组与高MOC组不良事件发生率比较[n(%)]
注:与低MOC组比较,*P<0.05
2.2事件组和非事件组的资料比较 非事件组男19例、女22例;事件组男20例、女14例,两组性别构成比较,差异无统计学意义(P>0.05)。同时,两组年龄、病史、SBP、DBP、Hb、CK-MB、LVED、LA的比较差异无统计学意义(P>0.05)。事件组MOC、BNP均高于非事件组,LVEF、SpO2(CS)低于非事件组,差异均有统计学意义(P<0.05)。见表3。
2.3事件组患者的危险因素分析 采用Cox比例风险回归模型,以性别、年龄、SBP、DBP、HB、ALT、CR、CK-MB、LVEF、LA、动脉血氧分压[SpO2(A)]、SpO2(CS)、MOC等参数为协变量,采用向后(条件法)进行分析,分析结果显示,MOC、SpO2(CS)、BNP和LVEF是预测再发心血管事件的重要指标,其他因素均不是再发心血管事件的独立危险因素。
2.4CHF患者MOC与LVEF和BNP的相关性 采用线性相关对79例心力衰竭患者MOC、SpO2(CS)与LVEF的相关性进行分析,结果显示,MOC与LVEF呈负相关(r=-0.265,P=0.018),与BNP呈正相关(r=0.489,P<0.05)。即LVEF越低,MOC越大;MOC也随着BNP的升高而增大,但两者间的因果关系尚不能确定。
2.5MOC水平预测CHF患者2年内发生心血管事件的ROC曲线分析 根据是否发生心血管事件,作MOC水平对CHF患者预后判定的ROC曲线,其曲线下面积为0.636,95%CI:0.509~0.763(P<0.05)。当MOC取64.5%时,其预测心力衰竭患者发生心血管事件的灵敏度和特异度均较高,分别为61.8%和68.3%。
2.6不同MOC水平患者在随访期间心血管事件发生率 MOC水平越高,心源性死亡和再次入院率越高,以64.5%作为危险分组界值,通过Kaplan-Meier法作不同水平患者在随访期间心血管事件发生率曲线分析,可见MOC≤64.5%组(低危组)的生存曲线高于MOC>64.5%组(高危组),Log-Rank检验表明,低危组与高危组心血管事件发生率的差异有统计学意义(P<0.05)。

表3 事件组和非事件组临床资料的比较

组别nCK⁃MB(U/L)LVDE(mm3)LA(mm)LVEF(%)BNP(ng/L)SpO2(CS)(%)MOC(%)非事件组4114.61±3.6562.95±8.2440.29±6.0437.49±5.90△1149.29±655.51△30.90±5.10△62.81±5.90△事件组3415.55±10.6461.50±8.1340.12±4.7134.50±5.091684.28±988.0127.15±6.2266.18±6.84
注:与事件组比较,△P<0.05
3 讨 论
心脏是一个高耗能和高耗氧的器官,MOC在安静状态下为27 mL/min,占全身总耗氧量的12%,是人体耗氧量最多的器官之一,也是人体耐缺氧力最差的器官之一。MOC主要由心肌张力、心肌收缩强度和心率决定,不同病理状态下,MOC水平不同[4-5]。发生心力衰竭时MOC增加,因此理论上认为,MOC水平越高,表明心脏功能越差,预后越差,但国内外尚无此方面的相关研究证实[6-7]。
以往的研究表明,SpO2(CS)可以作为心力衰竭患者预后的预测指标,SpO2(CS)越低,患者预后越差[3]。近年来,也有一些研究证实,动脉血氧饱和度与心力衰竭患者的病死率及再住院率有关,动脉血压饱和度越低,心力衰竭的预后越差[8-10]。然而,动脉血氧饱和度反映的是全身的氧气供应,并不能代表MOC水平。因此,在一定程度上,这个结论是有争议的[11-12]。SpO2(CS)虽然在一定程度上可以反映MOC水平,但也并不能完全代表MOC。本研究通过直接采集冠状动脉窦与冠状动脉开口处血液进行血气分析,利用两者血氧饱和度的差值来表示MOC,与传统的无创性方法相比,能更准确地反映心脏真实的耗氧量。
本研究表明,高MOC组患者的LVEF、BNP、SpO2(CS)与低MOC组相比差异均有统计学意义(P<0.05),高MOC组患者LVEF、SpO2(CS)低于低MOC组,BNP高于低MOC组。通过对79例CHF患者进行6~24个月的随访,发现高MOC组再入院率、病死率、总的不良事件发生率均高于低MOC组,高MOC组再入院、心源性死亡、总的不良事件发生的风险分别是低MOC组的2.68、3.56、3.08倍。据随访结果进一步分组分析,MOC水平在事件组远高于非事件组,差异有统计学意义(P<0.05)。
本研究对随访的79例患者进行相关性分析,表明心力衰竭患者SpO2(CS)与BNP呈负相关,MOC水平与BNP呈正相关,提示BNP越高,SpO2(CS)越低,MOC越大。Cox比例风险回归模型结果表明,MOC、SpO2(CS)和BNP是预测再发心血管事件的重要指标。已有大量的研究证实BNP是CHF诊断、治疗监测和预后评估的金标准[13-14],本研究结果表明MOC与BNP呈正相关,因此,MOC可以作为CHF预后的预测指标。
MOC可以预测CHF患者预后的原因:(1)心脏收缩和(或)舒张功能障碍,导致心脏输出量下降,故代偿性的引起心率加快,心肌收缩力增强,因此MOC增加。(2)交感神经激活,一方面使心率加快,另一方面可收缩外周血管,使心脏负荷加重,均增加MOC。(3)MOC与LVEF呈负相关,MOC水平越高,LVEF越低,提示MOC越高,有效循环血量越少。(4)MOC与BNP呈正相关,MOC水平越高,BNP越高,提示MOC越高,心室结构重塑越严重,预后愈差。
本研究对静息状态下不同MOC水平预测CHF的预后进行了研究。取预测CHF 2年内发生心血管事件灵敏度和特异性均较高的MOC值65.5%为界值,对心血管事件的发生进行分析,结果表明,MOC>65.5%的CHF患者预后较差,2年内发生心血管事件的风险明显高于MOC≤65.5%的CHF患者。
本研究样本量相对较少,随访时间偏短,为单中心研究,存在一定的局限性;且CHF患者的预后受多种因素的影响,如服药的依从性及规范性、感染等,因此需要进一步大样本、多中心的研究进一步证实。此外,虽然目前心导管法是测定MOC的金标准,但鉴于其有创性及术后并发症,如心包出血、心律不齐等,使得MOC的测定很难在临床上普及[15]。因此,可采用临床上常用的“心率×SBP”来估计MOC,为CHF患者临床病情的判断及预后的评估提供依据。
[1]HOOD W B.Regional venous drainage of the human heart[J].Br Heart J,1968,30(1):105-109.
[2]SETHNA D H,MOFFITT E A.An appreciation of the coronary circulation[J].Anesth Analg,1986,65(3):294-305.
[3]WHITE M,ROULEAU J L,RUDDY T D,et al.Decreased coronary sinus Oxygen content:A predictor of adverse prognosis in patients with severe congestive heart failure[J].J Am Coll Cardiol,1991,18(7):1631-1637.
[4]中华医学会心血管病学分会,中华心血管病杂志编辑委员会.2007中国慢性心力衰竭诊断治疗指南[J].中华心血管病杂志,2007,35(12):l-29.
[5]VLASOV I A,OKUNEVA G N.Specific oxygen consumption in the myocardium of patients with congenital and acquired heart defects[J].Fiziol Cheloveka 2003,29(2):133-137.
[6]VLASOV I,OKUNEVA G N,LITASOVA E E,et al.Correlation between specific Oxygen consumption in the myocardium and myocardial mass in healthy People and in patients with heart defects[J].Fiziol Cheloveka,1995,21(4):92-99.
[7]PENDINO J C,HESS L,BELTRAME S,et al.Oxygen saturation and lactate concentration gradient from the right atrium to the pulmonary artery in the immediate postoperative following cardiac surgery with extracorporeal circulation[J].Rev Bras Ter Intensiva,2017,29(3):287-292.
[8]KWON Y,PICEL K,ADABAG S,et al.Sleep-disordered breathing and daytime cardiac conduction abnormalities on 12-lead electrocardiogram in community-dwelling older men[J].Sleep Breath,2016,20(4):1161-1168.
[9]MASIP J,GAYA M,PAEZ J,et al.Pulse oximetry in the diagnosis of acute heart failure[J].Rev Esp Cardiol,2012,65(10):879-884.
[10]MINANA G,NUNEZ J,BANULS P,et al.Prognostic implications of arterial blood gases in acute decompensated heart failure[J].Eur J Intern Med,2011,22(5):489-494.
[11]KARLSEN T,LEINAN I M,AAMOT I L,et al.Safety of the CO-Rebreathing Method in Patients with Coronary Artery Disease[J].Med Sci Sports Exerc,2016,48(1):33-38.
[12]KAINUMA S,FUNATSU T,SAWA Y,et al.Surgical intervention for bilateral coronary artery fistulas to the pulmonary artery[J].Eur J Cardiothorac Surg,2016,49(5):1527-1529.
[13]中华医学会心血管病血分会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2014[J].中华心血管病杂志,2014,24(2):98-122.
[14]ZHANG J,SHAN C,ZHANG Y U,et al.Blood gas analysis of the coronary sinus in patients with heart failure[J].Biomed Rep,2015,3(3):379-382.
[15]ALGHAMDI M H,ELFAKI W,AL-HABSHAN F,et al.Bilateral superior vena cava with right superior vena cava draining into left atrium[J].J Saudi Heart Assoc,2015,27(2):123-126.

