大连地区表观健康人群同型半胱氨酸参考区间的建立*
刘 彤,马建军,杨建敏,王 波,薛邦禄
(1.辽宁省大连市中心医院检验科 116033;2.大连医科大学检验学院,辽宁大连 116044)
同型半胱氨酸(HCY)是蛋氨酸和半胱氨酸的代谢产物,是人体内的一种含硫氨基酸。如今已经证实HCY是一种血管损伤性氨基酸,高HCY是心脏、外周脑血管疾病的独立危险因素[1]。高HCY血症与糖尿病并发的肾病具有相关性,动态监测血清HCY和尿微量清蛋白对糖尿病患者具有重要意义[2]。血清HCY水平升高是脑卒中的一个独立危险因素,如果HCY水平过高,也会提高脑卒中的危险性[3-4]。因此血清HCY对身体健康水平评估及临床疾病的诊治、预后有着重要意义。但目前为止,国内外对HCY水平的流行病学方面的探讨研究比较多,其参考区间的分析相对较少。且大多数医院在进行检测时选择以试剂说明书上的参考范围为标准,忽略了对不同地域、年龄、民族等差异性的分析。本研究采用循环酶比色法检测体检2 449例表观健康人群,检测其血清HCY水平,探讨性别和年龄对HCY水平的影响,初步建立大连地区表观健康人群HCY参考区间。
1 资料与方法
1.1一般资料 选取大连市中心医院体检中心2015年12月至2016年12月体检健康人群的血清标本2 449例,其中男1 314例(≥20~29岁273例、≥30~39岁260例、≥40~49岁361例、≥50~59岁286例、≥60~69岁102例、≥70岁32例);女1 135例(≥20~29岁267例、≥30~39岁271例、≥40~49岁238例、≥50~59岁223例、≥60~69岁108例、≥70岁28例)。
1.2仪器与试剂 仪器为西门子ADVIA 2400全自动生化分析仪。试剂包括HCY体外诊断试剂盒、校准品及质控品,均由北京九强生物技术股份有限公司提供。
1.3方法
1.3.1标本的选取 对体检人员进行问卷调查,调查人员通过查看体格检查和实验室检查的报告进行筛选,能够同时满足以下多种要求方为合格标本[5]。纳入标准:(1)自觉健康;(2)无下列疾病,包括糖尿病、高尿酸血症、痛风、甲状腺功能亢进症、甲状腺功能减退、动脉粥样硬化、血管疾病、心脏病、肝硬化、胆石病、肺炎、肺结核、贫血、白血病、肌病、肥胖[体质量指数(BMI)≥28 kg/m2]和消瘦(BMI<18.5 kg/m2)等;(3)2周内未服用药物,4个月内未参加过献血、输血等活动,6个月内未进行手术;(4)无酗酒(长期饮酒或2周内大量饮酒)、嗜烟(吸烟量>20支/天)、营养不良、素食;(5)近期无剧烈运动或重体力劳动;(6)女性未处于妊娠或哺乳期。排除标准:(1)丙氨酸氨基转移酶>80 U/L;(2)天门冬氨酸氨基转移酶>80 U/L;(3)L-γ-谷氨酰基转移酶>80 U/L;(4)三酰甘油≥2.26 mmol/L;(5)总胆固醇≥6.22 mmol/L;(6)空腹血糖≥7.0 mmol/L;(7)尿素>8.5 mmol/L;(8)肌酐>130 μmol/L;(9)男性尿酸<500 μmol/L,女性尿酸<400 μmol/L;(10)男性血红蛋白<120 g/L,女性血红蛋白<110 g/L;(11)乙肝表面抗原阳性、丙型肝炎病毒抗体阳性、艾滋病抗体阳性。
1.3.2标本的采集与处理 受检者空腹12 h后晨起抽取静脉血。使用真空采血管取静脉血4 mL,室温下静置30 min后离心(3 500 r/min ×5 min),将血清分装于1.0 mL的Eppendorf管内,-80 ℃冰箱里冻存备用。
1.3.3标本检测 HCY检测按说明书进行参数设置,使用校准品获得校准曲线,每批次进行两水平室内质控检测,保证仪器处于在控状态。将冷冻的血清室温放置1 h溶解,反复混匀,上机检测,获得HCY检测结果。
1.4统计学处理 采用SPSS22.0对数据进行处理。非正态分布的计量资料采用中位数和四分位数间距[M(P25,P75)]表示。组间采用非参数Kruskal-WallisH检验。HCY参考区间的建立用P2.5和P97.5计算95%的参考区间。以P<0.05为差异有统计学意义。
2 结 果
2.1剔除数据中异常值 用SPSS22.0软件对2 449个数值进行标准化处理,将得到的标准化HCY数值中绝对值大于2的异常值舍弃,经过处理剔除了102个异常值。最后,男性共1 222例(≥20~29岁247例、≥30~39岁232例、≥40~49岁338例、≥50~59岁276例、≥60~69岁101例、≥70岁28例);女性1 125例(≥20~29岁264例、≥30~39岁270例、≥40~49岁236例、≥50~59岁220例、≥60~69岁108例、≥70岁27例)。
2.2HCY水平性别、年龄差异分析 结果显示,大连地区表观健康人群的HCY水平在男女之间差异有统计学意义,男性明显高于女性(P<0.05)。且不论男女性,血清HCY水平的均表现为年龄≥20~29岁到年龄≥30~39岁时降低,40岁以后随着年龄的增大而逐渐升高。采用非参数Kruskal-WallisH检验,对男、女性人群的6个年龄组分别进行两两比较,不同性别不同年龄段的检测结果差异也有统计学意义(P<0.05)。其中男性年龄≥30~39岁与年龄≥60~69岁、≥70岁两个年龄段比较,差异有统计学意义(P=0.028、0.007);≥40~49岁与年龄≥60~69岁、≥70岁两个年龄段比较,差异有统计学意义(P=0.015、0.005)。女性年龄≥20~29岁与年龄≥50~59岁、≥60~69岁、≥70岁这3个年龄段比较,差异有统计学意义(P=0.007、0.001、0.002);≥30~39岁与年龄≥50~59岁、≥60~69岁、≥70岁这3个年龄段比较,差异有统计学意义(P值均小于0.001);≥40~49岁与年龄≥50~59岁、≥60~69岁、≥70岁这3个年龄段比较,差异有统计学意义(P=0.004、0.001、0.002)。同时,经分析得到,男、女性的HCY水平在年龄≥20~29岁、≥30~39岁、≥40~49岁这3个年龄段比较差异均无统计学意义(P>0.05),可以合并参考区间;年龄≥50~59岁、≥60~69岁、≥70岁这3个年龄段比较,差异均无统计学意义(P>0.05),可以合并参考区间。见表1。
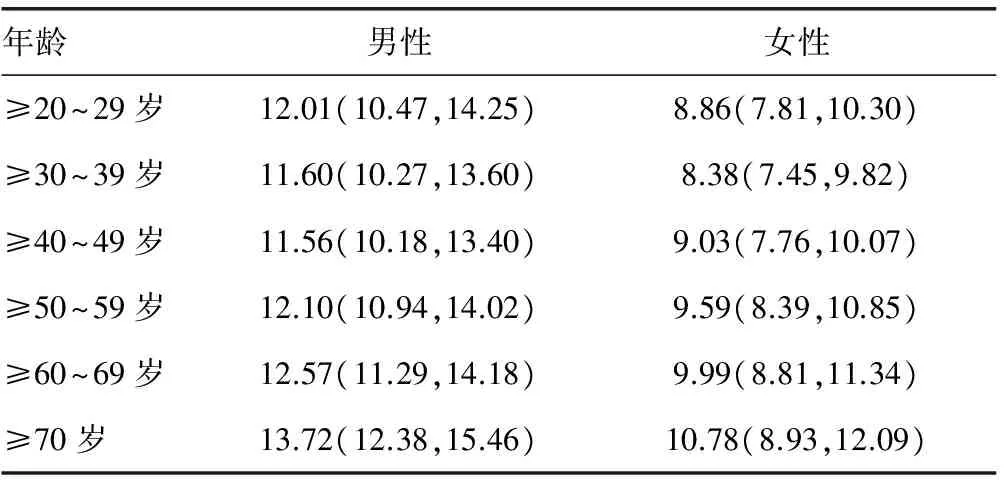
表1 不同年龄、性别血清HCY水平[μmol/L,M(P25,P75)]
2.3男、女各年龄段的参考区间 经分析得到,男性年龄≥20~49岁、≥50岁的HCY参考区间分别为8.12~24.08、8.73~21.53 μmol/L;女性年龄≥20~49岁、≥50岁的HCY参考区间分别为5.84~17.77、6.52~16.43 μmol/L。
3 讨 论
HCY属于蛋氨酸循环中的中间产物,是一种含巯基的非必需氨基酸[4]。HCY本身并不参与到蛋白质的合成过程中,在正常的生理状态下,人体血浆中HCY的水平很低。但是,作为一种反应性血管损伤性氨基酸,任何导致其代谢所需酶或相关因子缺陷以及代谢物的异常均会对人体血浆中HCY的水平产生影响。如果它在血液中标准数值高于10 mol/L,就会对血管产生危害。
研究表明,HCY可通过抑制一氧化氮合成或者氧自由基产生,是一种对血管内细胞有直接毒性作用的物质,可见HCY是心脑血管疾病的危险因素,它的异常参与心脑血管疾病的发生[5]。HCY水平检测对判断心脑血管疾病严重程度、预测心脑血管事件的危险有重要的价值,临床还可以指导高危人群通过饮食和药物控制HCY的水平,以控制、降低心脑血管疾病的发病风险[6-7]。同时也有试验结果显示,高HCY血症与糖尿病肾病的发病具有相关性[8-9]。BOYSEN等[10]研究105例曾发生过脑梗死的患者,结果显示脑梗死患者发病前的血浆HCY水平显著高于对照组。BOUSHEY等[11]表明HCY除与动脉粥样硬化相关之外,还具有致病效应,是导致动脉粥样硬化性血管病的一个独立危险因素。35%的2型糖尿病患者伴有高HCY血症,而在糖尿病肾病、视网膜以及心血管并发症的患者中更为显著[12-13]。以上研究结果均表明,HCY和其他相关指标联合作用与某些疾病有关,例如脑出血、糖尿病肾病、老年痴呆症等,HCY值的改变在这些疾病的发生、发展中有明显的变化,因此可作为某些疾病的诊断与不良事件预测指标[14]。通过文献已经得知,各个地区人群的HCY值并不相同[15-16]。分析相关原因,可能不同的性别、民族、年龄的研究对象受到环境和遗传因素的影响,血浆HCY水平也存在一定的差异。本研究采用循环酶比色法检测标本的HCY水平,由相关参考文献得知循环酶法检测HCY的方法性能验证,符合临床要求[17]。
本研究结果显示,2 347例的血清HCY水平不符合正态分布(P<0.05),男女HCY水平比较,差异有统计学意义(P<0.05);各个年龄组组间比较显示,男女性HCY水平在年龄≥20~29岁、≥30~39岁、≥40~49岁这3个年龄段差异均无统计学意义(P>0.05);在年龄≥50~59岁、≥60~69岁、>70岁这3个年龄段差异也均无统计学意义(P>0.05),因此男性HCY参考区间:≥20~49岁为8.12~24.08 μmol/L,≥50岁为8.73~21.53 μmol/L;女性HCY参考区间:20~49岁为5.84~17.77 μmol/L,≥50岁为6.52~16.43 μmol/L。
HCY水平与检测的试剂、仪器均有关系,本研究数据仅供参考,希望以上结果能够对大连地区人群的体检报告、疾病的诊断及鉴别有一定的临床意义。
[1]SOUISSI M,FEKI M,MOURALI S,et al.Homocysteinaemia and coronary artery disease:a case-control study in a Tunisian population[J].Arch Mal Coeur Vaiss,2006,99(9):781-785.
[2]张彦,杨永长,范小明.血清同型半胱氨酸测定在糖尿病肾病中的临床意义[J].实验与检验医学,2011,29(1):53-54.
[3]顾炳权,王多宁.血浆同型半胱氨酸水平及临床诊断意义[J].中国血液流变学杂志,2004,14(4):630-634,638.
[4]程德君,朱星成.β2-MG、CysC、Hcy在肾病疾病中的临床应用[J/CD].中华临床医师杂志(电子版),2013,5(40):980-981.
[5]张芸.北京地区社区人群同型半胱氨酸水平与心血管事件的相关性研究[D].北京:中国人民解放军医学院,2015.
[6]李保华,陶云海,王克义,等.脑梗死患者血浆同型半胱氨酸检测的临床意义[J].浙江临床医学,2006,8(1):17-18.
[7]徐建五,申俊俊,朱留洋,等.同型半胱氨酸检测对心脑血管疾病的应用[J].中华临床应用杂志,2016,4(10):235-235.
[8]王锦霞,杨西爱.血清同型半胱氨酸检测在心血管疾病中的应用[J].河北医学,2014,20(1):123-125.
[9]CHICO A,PEREZ A,CORDOBA A,et al.Plasma homocystein in related to album in excretion rate in patients with diabetes mellitus a new Link between diabetic nephropathy and cardiovascular disease[J].Diabetologia,1998,41(6):684-693.
[10]BOYSEN G,BRANDER T,CHRISTENSEN H,et al.Homocysteine and risk of recument stroke[J].Stroke,2003,34(5):1258-1261.
[11]BOUSHEY CJ,BERESFORD SA,OMENN GS,et al.A quantitative assessment of plasma homocysteine as a risk factor for vascular disease.Probable benefits of increasing folic acid intakes[J].JAMA,1995,274(13):1049-1057.
[12]BECKER A,HENRY R M,KOSTENSE P J,et al.Plasma homocysteine and Sadenosylmethionine in erythrocytes as determinants of carotid intimamedia thickness different effects in diabetic and non-diabetic individuals.The Hoorn Study[J].Aterosclerosis,2003,169(2):323-330.
[13]迟锦瑜,任彩丽,王红宁,等.精神分裂症血浆硫化氢,同型半胱氨酸,叶酸及维生素B6水平研究[J].临床精神医学杂志,2016,6(3):65-65.
[14]杨双全.同型半胱氨酸(HCY)检测方法及临床意义[J].首都食品与医药,2015,22(20):110-111.
[15]DE BREE A,VERSCHUREN W M,BLOM H J,et al.Association between B vitamin intake and plasma homocysteine concentration in the general Dutch population aged 20-65 y[J].Am J Clin Nutr,2001,73(6):1027-1033.
[16]REFSUM H,NURK E,SMITH A D,et al.The Hordaland homocysteine study:a community-based study of homocysteine,its determinants,and associations with disease[J].J Nutr,2006,136(Suppl 6):1731S-1740S.
[17]尚红,王毓三,申子瑜,等.全国临床检验操作规程(第4版)[M].北京:人民卫生出版社,2015.

