电针通过PI3K/AKT信号通路动员脑缺血/再灌注大鼠骨髓内皮祖细胞至外周血
胥虹贝,母松,朱艳含,朱君,周雪灵,罗勇*
(1重庆医科大学附属第一医院神经内科,重庆400016;2贵州医科大学附属医院肛肠外科,贵州550004)
在缺血性脑血管病治疗中,如何提高缺血半暗带内血流,挽救濒死神经元一直是缺血性脑血管病的治疗难点。缺血性脑损伤发生后,骨髓内皮祖细胞(endothelial progenitor cells,EPCs)可在多种细胞因子,如缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)、基质细胞衍生因子-1α(stromal cell-derived factor-1α,SDF-1α)和趋化因子受体4(C-XC chemokine receptor type 4,CXCR4)等诱导下从骨髓动员至外周血,并归巢至脑缺血区参与血管再生[1-4]。磷脂酰肌醇-3激酶/蛋白激酶B/内皮型一氧化氮合酶(phosphatidylinositol -3 kinase/protein kinase B/endothelial nitric oxide synthase,PI3K/AKT/eNOS)是与EPCs增殖、迁移、归巢相关的代表性信号转导通路[1,5,6]。本课题组前期研究表明,电针可加速局灶脑缺血/再灌注大鼠骨髓EPCs动员至外周血,上调骨髓和外周血EPCs数量[1,7-9],但其具体机制尚不十分明确。本研究旨在通过观察电针及PI3K特异性拮抗剂LY294002干预后,大鼠骨髓和外周血CD34+EPCs数量变化情况和大脑皮质缺血区内CD34+微血管再生情况,以期深入探讨电针促进局灶脑缺血/再灌注后脑内血管再生的可能机制。
材料与方法
1 实验动物分组
192只SPF级成年雄性SD大鼠(250-300g),由重庆医科大学动物中心[动物资格证:SCXK(渝)2018-0003]提供。大鼠随机分为假手术组(Sham)、缺血组(I/R)、缺血+电针组(I/RE)和缺血+电针+LY294002组(I/REL)。脑缺血90min后,根据再灌注时间不同将各组大鼠分为再灌注24h、48h和7d 三个亚组。
2 主要试剂和仪器
小鼠抗PE-CD34多克隆抗体(Santa Cruz Biotechnology公司,美国)、兔抗CD34多克隆抗体(CST公司,美国)、FITC标记的山羊抗兔荧光二抗(Proteintech,美国)、红细胞裂解液(碧云天,中国)、LY294002(Sigma,美国)、p-AKT(磷酸化AKT)和总AKT ELISA试剂盒(ab126433,Abcam,美国)、eNOS ELISA试剂盒(ab230938,Abcam),G6850型电针治疗仪(购自北京精工仪器厂),流式细胞仪(FACS vantage SE,BD公司,美国),激光扫描共聚焦显微镜(尼康,日本)。
3 局灶脑缺血/再灌注模型
采用改良线栓法[10]结合罗勇等[11]的方法,制备SD大鼠右侧大脑中动脉缺血/再灌注模型(transient middle cerebral artery occlusion/reperfusion,tMCAO)。大鼠术前禁食一晚,不禁饮。3.5%水合氯醛腹腔注射(1mg/100g)麻醉大鼠后,将大鼠仰卧位固定于操作台,除颈部毛发,行颈正中纵行切口,钝性分离颈部肌肉,充分暴露右侧颈总动脉、颈外动脉和颈内动脉颅外段,结扎颈外动脉远端,沿颈内动脉分离翼颚动脉,结扎起点端。在颈外动脉残端剪一斜行切口,缓慢插入提前准备好的头端圆润、直径为0.25~0.27mm的线栓,当线栓头端距颈总动脉分叉处约18~20mm处可感到明显阻力时,表明线栓头端已达大脑中动脉起始端。栓塞90min后将线栓拔出至颈外动脉残端实现再灌注。待大鼠完全清醒后,采用Longa 5分法[10]进行神经功能评分,评分为2~3分者视为造模成功,入选实验。Sham组在造模过程中,插入的线栓距颈总动脉分叉处约10mm即可,其余操作同上。因各种原因所致各组大鼠不足预设数量,均按随机抽样原则补齐实验动物。
4 电针治疗和PI3K/AKT通路抑制处理
参照中国针灸学会实验针灸委员会制定的实验动物穴位图谱,选取大鼠“百会”穴(GV20)及左侧“四关”穴(合谷 LI4/太冲 LR3)为电针穴位,利用直径为0.38mm,长度为1寸的华佗牌不锈钢银针于“百会”穴处斜刺入头皮1mm,直刺“四关”穴2mm,针刺“百会”穴及“四关”穴通电刺激。连接电针治疗仪,刺激参数为:频率2/20 Hz,疏密波型,强度以大鼠肢体轻微震颤为宜。I/RE和I/REL组首次电针刺激于再灌注后1h进行,刺激时间20min/次,每天治疗1次,最长7d。I/REL组动物在造模成功后立即腹腔注射和PI3K/AKT通路抑制剂LY-294002。LY294002溶解于二甲亚砜,终浓度为0.1mg/ml,计量为0.3mg/kg/d[12]。
5 流式细胞术检测
3.5%水合氯醛腹腔注射麻醉大鼠后,用含肝素钠的抗凝管取腹主动脉血约2ml备用。后用含2%胎牛血清的IMDM培养基冲洗出大鼠胫骨和股骨的骨髓细胞,吹打混匀后,采用70μm细胞筛过目,离心后重悬细胞,采用1% PBS调整细胞数为1×106左右备用[1]。取骨髓和外周血细胞悬液各100μl,各加2μl PE-CD34抗体,4℃避光孵育20min,后加 ml红细胞裂解液,4℃避光孵育10min,4℃ 1500r/min离心5min,弃上清,加入2ml PBS重悬细胞,4℃1500r/min 离心5min,最后用100μl PBS重悬细胞,流式细胞仪上机检测。
6 酶联接免疫吸附剂测定(ELISA)
将清洗干净的玻璃匀浆管行高温高压灭菌备用,加入1ml蛋白裂解液RIPA和10μl PMSF,在各指定时间点分别提取各组大鼠股骨和胫骨新鲜骨髓,放入匀浆管中充分匀浆至组织溶解,将组织匀浆液移入离心管,于4℃条件下12000rpm/min离心10min,取上清备用。按照ELISA操作步骤按照说明书分别检测各样本p-AKT、AKT、eNOS含量。
7 CD34+ 微血管密度的免疫荧光检测
将各组大鼠脑组织冰冻切片(厚度为10μm)于-80℃冰箱取出,室温放置10min,PBS冲洗5min,加入5% Trition 于37 ℃孵育30min,PBS洗5min共3次,后用5% 山羊血清于37℃封闭1h,甩干血清,兔抗CD34一抗(1∶50)孵育,4℃过夜。第二天,37℃复温1h,后用FITC标记的山羊抗兔二抗于37℃孵育1h。激光扫描共聚焦显微镜观察、拍照和计数。CD34+微血管密度判定方法:在20倍(物镜)视野下计数血管直径<20μm或单个细胞阳性,但和周围细胞分界清楚视为一个新生血管,微血管数(个/HP)为每个视野下的血管数。
8 统计学分析
数据均用均数±标准差表示,应用SPSS19.0统计软件处理数据,采用单因素方差分析,两组间比较采用LSD-t检验,P<0.05具有统计学意义。
结 果
1 LY294002抑制电针对脑缺血再灌注大鼠骨髓和外周血中CD34+ EPCs数量的增加
流式细胞术检测显示,脑缺血再灌注后24h和48h,大鼠骨髓和外周血中CD34+EPCs数量较Sham组明显增多,再灌注后第7d,CD34+EPCs数量高于Sham组,但差异无统计学意义(P>0.05)。缺血再灌注后进行EA处理,骨髓和外周血中CD34+EPCs数量在各个观察时间点均较未进行电针处理的缺血再灌注大鼠均明显增多,而用LY294002阻断PI3K/AKT通路后,电针处理不再增加缺血再灌注大鼠骨髓和外周血CD34+EPCs数量(图1)。
2 LY294002抑制电针对脑缺血再灌注大鼠骨髓p-AKT和eNOS含量的增加
ELISA检测显示,脑缺血再灌注后24h、48h和72h,大鼠骨髓p-AKT和eNOS含量较Sham组明显增多;缺血再灌注后进行EA处理,骨髓p-AKT和eNOS含量在各个观察时间点均较未进行电针处理的缺血再灌注大鼠均明显增多,而用LY294002阻断PI3K/AKT通路后,电针处理不再增加缺血再灌注大鼠骨髓p-AKT和eNOS。不同组别在缺血再灌注后各个时间点总AKT蛋白含量差异无统计学意义。

图1 电针对脑缺血再灌注大鼠骨髓及外周血CD34+ EPCs数量的影响。A1,骨髓CD34+ EPCs代表性流式细胞术检测结果;A2,骨髓CD34+EPCs数量统计分析;B1,外周血CD34+ EPCs代表性流式细胞术检测结果; B2,外周血CD34+ EPCs数量的统计分析;*,P<0.01 vs Sham组;#,0.01<P<0.05 vs I/R组;&,0.01<P<0.05 vs I/REL组;n=6Fig.1 Effect of electronacupuncture on the number of CD34+ EPCs in the bone marrow and peripheral blood of the rats with cerebral ischemia/reperfusion. A1, representative flow cytometry results of CD34+ EPCs in the rat bone marrow; A2, statistical analysis for the number of CD34+ EPCs in the rat bone marrow; B1, representative flow cytometry results of CD34+ EPCs in the rat peripheral blood; B2, statistical analysis for the number of CD34+EPCs in rat peripheral blood; *, P<0.01 vs Sham group; #, 0.01<P<0.05 vs I/R group; &, 0.01<P<0.05 vs I/REL group; n=6
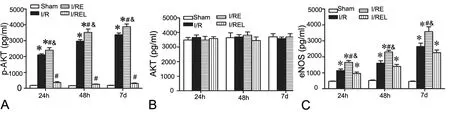
图2 LY294002和电针对脑缺血再灌注大鼠骨髓p-AKT 和eNOS含量的影响。A,ELISA检测骨髓pAKT含量的统计学分析;B,ELISA检测骨髓总AKT含量的统计学分析比较;C,ELISA检测骨髓eNOS含量的统计学分析;*,P<0.01 vs Sham组;#,0.01<P<0.05 vs I/R组;&,P<0.01 vs I/REL组;n=4Fig.2 Effect of LY294002 and electroacupuncture on the content of p-AKT, AKT and eNOS in the bone marrow of the rats with cerebral ischemia/reperfusion. A, statistical analysis for the content of pAKT detected by ELISA in the bone marrow; B, statistical analysis for the content of total AKT detected by ELISA in the bone marrow; C, statistical analysis for the content of eNOS detected by ELISA in the bone marrow; *, P<0.01 vs Sham group; #, 0.01<P<0.05 vs I/R group; &, P<0.01 vs I/REL group; n=4
3 LY294002抑制电针对脑缺血再灌注大鼠缺血区大脑皮质CD34+微血管密度的增加
免疫荧光共聚焦结果显示,再灌注后24h,大脑皮质缺血区CD34+的新生血管以单个细胞为主,管腔较小,再灌注后7d缺血区新生血管密度增加,多种管径大小的血管并存。脑缺血再灌注后24h、48h和7d,大鼠大脑皮质缺血区CD34+MVD较Sham组明显增多。缺血再灌注后进行EA处理,大脑皮质缺血区CD34+MVD在各个观察时间点均较未进行电针处理的缺血再灌注大鼠均明显增多,而用LY294002阻断PI3K/AKT通路后,电针处理不再增加缺血再灌注大鼠大脑皮质缺血区CD34+MVD。

图3 LY294002和电针对脑缺血再灌注大鼠缺血区大脑皮质CD34+ 微血管密度的影响。A,大脑皮质CD34+微血管密度的免疫荧光检测;B,CD34+微血管密度的统计分析;*,P<0.01 vs Sham组;#,0.01<P<0.05 vs I/R组;&,P<0.01 vs I/REL组;n=6Fig.3 Effect of LY294002 and electroacupuncture on the CD34+ microvessel density in the ischemia cerebral cortex of the rats with cerebral ischemia/reperfusion. A, immuno fluorescent detection for CD34+ microvessel density in the cerebral cortex; B, statistical analysis for the CD34+ microvessel density; *, P<0.01 vs Sham group; #, 0.01<P<0.05 vs I/R group; &, P<0.01 vs I/REL group; n=4
讨 论
修复受损内皮细胞、促进脑血管再生一直是缺血性脑卒中的治疗难题。近年来, EPCs以其强大的促血管再生潜能成为缺血性脑卒中治疗的研究热点。EPCs是一类主要来源于骨髓,具有游走性,并能定向分化为成熟内皮细胞特性的未成熟内皮细胞[13]。缺血性脑卒中后患者外周血EPCs水平与患者脑梗死面积及预后明显相关[14,15]。近年来对脑缺血后EPCs在脑血管再生中的作用研究多采用细胞移植手段,研究发现移植的EPCs可定向归巢至脑缺血区参与血管再生[16,17]。本课题组前期从整体水平出发,对局灶脑缺血/再灌注大鼠胫骨骨髓腔注射可被EPCs特异性摄取的Dil标记的乙酰化低密度脂蛋白(DIL-acLDL),追踪活体内骨髓EPCs的运行轨迹,于再灌注后第1-7d均在大鼠外周血检测出DIL-acLDL+CD34+EPCs,直观证实了脑缺血损伤后机体可动员自身内源性骨髓EPCs至外周血参与血管再生[18]。然而生理条件下,机体骨髓和外周血EPCs数量相当有限[19],尽管脑缺血后脑内血管生成机制立即被启动,但机体的自我修复能力有限,远不足以代偿原有血供。因此,在缺血性脑损伤修复过程中,探索如何促进骨髓EPCs动员到外周血,归巢到脑内,促进脑内血管再生至关重要。
大量研究表明,电针治疗可有效上调局灶脑缺血/再灌注大鼠骨髓和外周血EPCs数量。由于EPCs具有许多细胞表面标记物,如CD34、CD133、CD144、CD31、Vwf、VEGFR2、Tie2和c-kit/CD117等,在EPCs增殖分化为成熟内皮细胞过程中,EPCs可呈现多种动态细胞表面标记组合,至今尚无特异性鉴定EPCs的方法。因此,在研究电针对缺血性脑卒中大鼠骨髓及外周血EPCs数量时,不同研究所选取的标记物有所不同。王秀志等[20]发现,电针可增加局灶脑缺血/再灌注大鼠外周血VEGFR2+PECAM-1+EPCs数量,上调脑缺血皮质VEGFR-2、PECAM-1的表达,促进缺血区脑血管形成。赵瑛等[21]研究表明,电针可通过上调局灶脑缺血/再灌注大鼠外周血CD31+VEGFR2+EPCs数量、上调外周血VEGF的表达从而促进血管再生,推测电针动员大鼠内源性EPCs的机制可能与VEGF表达上调有关。Xie等[1]研究表明,电针治疗可上调局灶脑缺血/再灌注大鼠外周血和骨髓CD34+VEGFR2+EPCs数量,该作用与电针治疗增加大鼠骨髓、外周血和大脑缺血皮质SDF-1α表达,促进SDF-1α浓度梯度的形成,增加SDF-1α浓度梯度差值并延长作用时间有关。此外,电针亦可上调缺血性脑卒中大鼠骨髓及外周血VEGFR2+EPCs、CD34+EPCs数量。由于CD34是一直存在于不同时期EPCs表面的标记物,对鉴定EPCs具有敏感性、特异性和可靠性,是科研及临床研究与应用中较好的标记物等[22,23],故本研究选取CD34作为EPCs表面标记物。本研究结果表明,电针可上调局灶脑缺血/再灌注大鼠骨髓和外周血CD34+EPCs数量,其中骨髓内CD34+EPCs数量于再灌注后24h达到高峰,后随再灌注时间的延长逐渐减少,而外周血中CD34+EPCs数量于再灌注后24h开始增高,48h时升至最高,后逐渐减少,骨髓CD34+EPCs数量逐渐减少,而外周血CD34+EPCs数量逐渐升高,但再灌注后48h,外周血CD34+EPCs数量随再灌注时间延长而呈递减趋势,推测该结果与CD34+EPCs在机体内先由骨髓内动员至外周血,之后又归巢到脑缺血区有关。
研究表明,PI3K/AKT是具有代表性的与EPCs增殖、迁移、归巢相关的信号转导通路[4-6]。在各种病生理条件刺激下,机体骨髓PI3K/AKT信号途径被激活,AKT磷酸化增多,活化的AKT可诱导eNOS合成,使一氧化氮(NO)合成增多,NO促进基质金属蛋白酶-9(MMP-9)硝基化,活化的MMP-9使EPCs易于脱离骨髓微环境,参与缺血区血管生成[24-26]。本团队前期研究表明,电针治疗可通过PI3K/AKT信号促进脑缺血后脑内血管再生[8,27]。Ying等[24]发现采用LY294002阻断PI3K作用后,EPCs的细胞活力降低,EPCs促血管再生的能力明显减弱。Wang等[25]研究发现,当PI3K作用被wortmannin阻断后,骨髓EPCs的迁移能力显著降低。此外,研究表明缺乏eNOS的小鼠,VEGF诱导的骨髓EPCs的动员能力明显减弱[26],提示PI3K/AKT信号途径在促进骨髓EPCs动员及血管再生中具有重要作用。由于目前关于骨髓PI3K/AKT/eNOS信号途径在电针上调骨髓及外周血EPCs数量中的作用尚不十分明确,故本研究通过采用药物干预,探讨电针对骨髓EPCs的动员作用是否是通过对PI3K/AKT的调控来实现的。本研究结果表明,脑缺血可诱导骨髓pAKT和eNOS蛋白表达增多,且pAKT和eNOS蛋白表达随再灌注时间延长逐渐增多,而总AKT蛋白含量不变,提示脑缺血损伤可诱导机体骨髓内源性PI3K/AKT/eNOS信号途径的激活。根据本研究结果,电针治疗使得骨髓PI3K/AKT/eNOS信号途径被进一步激活,同时电针可促进骨髓EPCs动员至外周血,这提示我们两者之间是否具有某种关联呢?为进一步证实电针上调骨髓、外周血EPCs是否是通过进一步促进骨髓PI3K/AKT信号途径激活完成,本研究采用腹腔注射LY294002特异性阻断PI3K作用的方式,探讨电针促进骨髓EPCs动员的可能机制。研究表明,采用0.3mg/kg剂量的LY294002腹腔注射,可以有效抑制SD大鼠体内PI3K/AKT信号通路,故本研究亦采用该剂量[12]。本研究结果表明,腹腔注射LY294002后,电针未能促进AKT蛋白磷酸化,且未能明显上调eNOS蛋白表达。同时,电针促进骨髓CD34+EPCs动员至外周血的作用被明显削弱,表现为LY294002处理可抑制电针对EPCs再生能力的增加,提示电针可通过动员骨髓内EPCs至外周血的作用是通过其促进骨髓PI3K/AKT信号通路完成的。研究表明,归巢至缺血区的EPCs可通过参与缺血组织的血管重建和损伤血管的再内皮化发挥促血管再生的作用。由于CD34广泛分布于毛细血管内皮细胞及其前体细胞,在成熟血管内皮中的表达很低[28],采用CD34作为细胞表面标记计数微血管密度,具有较高的特异性、敏感性和可重复性[29]。因此本研究采用CD34作为微血管的标记物。本研究发现,当阻断PI3K/AKT通路后,电针治疗未能提高大脑皮质缺血区CD34标记的微血管密度,表明电针治疗促进脑内血管再生的作用被明显抑制,而这一结果可能与电针促进骨髓EPCs动员至外周血的效应被抑制有关。
本研究在既往研究的基础上,采用腹腔注射LY294002特异性阻断PI3K作用,抑制AKT磷酸化,同时研究不同时间点大脑皮质缺血区内脑内血管再生情况。我们发现电针上调局灶脑缺血/再灌注大鼠骨髓和外周血EPCs数量以及促进大脑皮质缺血区血管再生的效应在阻断PI3K/AKT信号通路后明显减弱,直接证实了电针可通过PI3K/AKT介导骨髓EPCs动员至外周血,为电针在临床上治疗缺血性脑卒中提供了一定的理论依据。

