复元醒脑汤对糖尿病脑梗死大鼠脑组织梗死体积及形态学影响的实验研究*
凌 丽 沈俊逸 陈 淼 方邦江
(1.上海市中医医院,上海 200071;2.南京军区南京总医院,江苏 南京,210002;3.上海交通大学医学院附属新华医院,上海 200092;4.上海中医药大学附属龙华医院,上海 200032)
脑梗死具有高发病率、高死亡率和高致残率的特点,一直是国内外研究的重点与热点。糖尿病是脑梗死的重要独立危险因素,糖尿病患者脑梗死发病率比普通人群高2~6倍[1-2]。糖尿病并发脑梗死是糖尿病最常见的血管合并症,占糖尿病合并脑血管病变的88%以上[3],可能与糖尿病代谢紊乱、血液高凝状态、微血管病变等因素有关。临床应用复元醒脑汤治疗糖尿病脑梗死取得了良好的疗效。为了进一步探讨复元醒脑汤治疗糖尿病脑梗死机制,本实验拟在建立糖尿病脑梗死大鼠模型的基础上,观测复元醒脑汤对其脑组织梗死体积、脑组织病理形态学改变的干预作用。现报告如下。
1 材料与方法
1.1 实验动物 健康SD大鼠,雌雄各半,22月龄,体质量(200±)g,SPF级,共 150只,由上海杰思捷实验动物有限公司提供,饲养于张江复旦药学院动物房。
1.2 试药与仪器 链脲佐菌素(STZ),美国Sigma公司;TTC 染色液(2%)、戊二醛固定液(2.5%),上海远慕生物科技有限公司;4%多聚甲醛,上海复申生物科技有限公司;苏木精染液、伊红染液,上海国药集团化学试剂公司;高脂饲料,上海仕林生物科技有限公司;电子天平,奥豪斯仪器(上海)有限公司;欧姆龙血糖仪HGM-114,欧姆龙健康医疗(中国)有限公司;MCAO栓线,北京西浓科技有限公司;大鼠脑立体定位仪,深圳市瑞沃德生命科技有限公司;-80℃冰箱DW-86L388A,中国海尔;冷冻离心机FC5515R,奥豪斯仪器(上海)有限公司;石蜡包埋机,德国Leica;BX51光学显微镜,日本Olympus。实验药物:复元醒脑汤[人参10 g(单煎),生天南星 15 g,石菖蒲 12 g,三七 10 g,水蛭 10 g,益母草 30 g,制大黄 10 g(后下)],由上海中医药大学附属龙华医院制剂室生产提供,浓度为388 g生药/L。盐酸二甲双胍缓释片,规格:0.5 g/片,中美上海施贵宝制药有限公司。尼莫地平片,规格:20 mg/片,正大青春宝药业有限公司。
1.3 造模与分组 健康SD大鼠,共150只,饲养于SPF级动物实验室,在常规适应性分笼喂养4 d后随机分为正常组30只与糖尿病模型组120只,糖尿病组采用STZ腹腔注射法制备糖尿病模型[4-5]。糖尿病模型造模成功后,连续高脂饲料喂养2周,高脂饲料成分:60%常规饲料+15%蔗糖+15%猪油+5%全脂奶粉+5%蛋黄。再将糖尿病模型组按每组均等例数随机分为糖尿病脑梗死假手术组(假手术组)、糖尿病脑梗死模型组(模型组)、糖尿病脑梗死西药治疗组(西药治疗组)和糖尿病脑梗死中药治疗组(中药治疗组)4组。糖尿病脑梗死大鼠模型采用线栓法制备[6-7],假手术组除不插入线栓外,余手术步骤同糖尿病脑梗死组。完成造模后,中药治疗组给以复元醒脑汤10.4 g/(kg·d)灌胃,西药治疗组以二甲双胍27 mg/(kg·d)、尼莫地平2.16 mg/(kg·d)灌胃(参照陈奇主编《中药药理实验方法学》依实验动物与人体表面积比计算),正常组、假手术组、模型组均给以等容量的0.9%氯化钠溶液灌胃,各实验组每天的灌胃量均分为2次完成,连续灌胃14 d后处死取材。
1.4 标本采集与检测 1)脑梗死体积测定。造模结束后每组各取7只大鼠进行TTC染色测定出梗死体积。10%水合氯醛溶液0.3~0.35 mL/100 g腹腔内注射深度麻醉后,快速断头冰上取脑,剪开皮肤暴露头及颈段,从颈椎处剪断脊髓,剥离颈部肌肉,用止血钳剔除颅骨,去除硬脑膜,从小脑处向上推起脑组织,剪断脑神经,取出完整的脑组织。将脑组织置于-20℃的冰箱中速冻20 min,由前极向后用大鼠脑立体定位仪行冠状切片,每片厚2 mm,一般切成5~6片。切片置于含0.05%TTC的浓度为0.2 mol/L的磷酸盐缓冲液(pH7.4)中,37 ℃温水浴避光孵育 15~30 min,每间隔5 min轻柔晃动平皿。然后将TTC液倒出,在PBS液中洗3次,每次1 min。最后放入4%的多聚甲醛溶液中固定。正常组织被染成红色,梗死区域为苍白色。采用图像分析软件通过色彩分割等方法对薄层扫描仪扫出的图像进行分析,由同一名操作者在盲法状态下计算各实验组脑梗死体积(像素数)。2)脑组织病理形态学观察。造模结束后每组各取3只大鼠进行HE染色、2只大鼠进行透射电镜检查以观察脑组织病理形态学改变。HE染色:每组各取3只大鼠,10%水合氯醛腹腔注射深度麻醉后,迅速开胸暴露心脏,左心室插入灌注针头至主动脉根部,剪开右心耳;灌注0.9%氯化钠注射液约200 mL,时间约4~5 min;待流出血液逐渐变浅,肝脏、眼珠也逐渐变白,接着用4%多聚甲醛约300 mL快速灌注固定约30 min,观察大鼠的身体反应,尾巴竖起,四肢伸直变硬。依前法开颅取脑,放入4%多聚甲醛中,固定时间约为4~6 h,在4℃冰箱中固定。经梯度酒精序列脱水、透明、浸蜡、石蜡包埋、切成厚4 μm切片、烤片、脱蜡、脱水、HE染色、脱水、透明、封片、光镜下拍照观察脑组织病理形态学改变。3)透射电镜下观察脑皮质微血管。每组各取2只大鼠,10%水合氯醛腹腔注射深度麻醉后,置冰上迅速断头取脑,沿视交叉处前后1 mm切开,在缺血梗死周围皮质取大约1 mm3(1 mm×1 mm×1 mm)组织,置入4℃ 2.5%戊二醛固定液中约2 h,配制0.1 mol/L磷酸缓冲液漂洗3次并固定2 h或更长时间,4℃保存,移入1%锇酸固定液中固定2~3小 h,0.1 mol/L磷酸缓冲液漂洗3次。经脱水、包埋、固化、超薄切片机50~60 nm切片、3%醋酸铀-枸橼酸铝双染色、透射电镜观察并拍片。
1.5 统计学处理 应用SAS9.3统计软件。计量资料以(±s)表示,组间均数比较采用方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 入组情况 见表1。共150只大鼠,分为5组,每组30只。正常组中有2只因死亡退出实验,另外120只大鼠中有20只糖尿病未成模,余100只平均分为4组,每组25只。假手术组、模型组、西药治疗组、中药治疗组分别有2只、10只、9只、7只因死亡退出实验。因此各组入组数据分别为正常组28只、假手术组23只、模型组15只、西药治疗组16只、中药治疗组18只。每组取7只大鼠经TTC染色测定脑组织梗死体积;每组取3只大鼠进行HE染色、2只大鼠通过透射电镜观察脑组织病理形态学改变;余大鼠做其余指标的检测。

表1 大鼠造模后入组情况统计(n)
2.2 脑梗死体积测定 见图1~图2和表2。采用TTC染色法[8-9]测定计算脑组织梗死体积,正常组织被染成红色,梗死区域为苍白色。从TTC染色图片中可见正常组和假手术组大鼠的脑组织无梗死灶,模型组、西药治疗组和中药治疗组均有明显的脑梗死病灶,梗死范围主要位于额叶、顶叶、部分颞叶皮质、背侧丘脑、内囊和纹状体等大脑中动脉支配区域,其中西药治疗组和中药治疗组脑组织的梗死范围均较模型组有所减小。西药治疗组梗死体显著低于模型组(P<0.01),中药治疗组梗死体积亦显著低于模型组(P<0.01),西药治疗组与中药治疗组在减小脑梗体积方面无明显差异(P>0.05)。
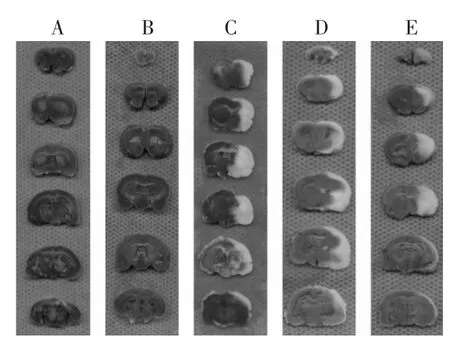
图1 各组大鼠脑组织TTC染色图片
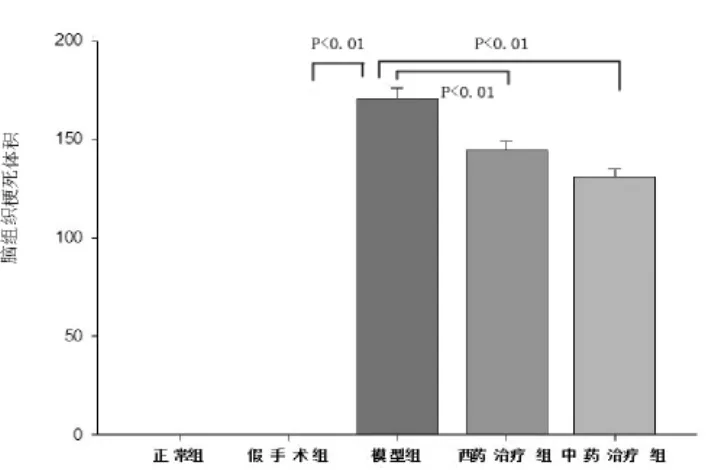
图2 各组大鼠缺血脑组织的梗死体积
表2 各实验组大鼠缺血脑组织的梗死体积比较(±s)

表2 各实验组大鼠缺血脑组织的梗死体积比较(±s)
与假手术组比较,*P<0.01;与模型组比较,△P<0.01。下同。
组 别 n 梗死体积正常组 7 0.00假手术组 7 0.00模型组 7 169.110±11.980*西药治疗组 7 140.580±12.826△中药治疗组 7 132.721±8.994△
2.3 脑组织病理形态学观察 见图3~图6。HE染色(图3)见正常组细胞排列整齐,结构完整,细胞核居中,数量较多,染色较深,细胞质的染色较均匀,未出现细胞变性和坏死现象。假手术组细胞结构有轻微损伤,出现了细胞核固缩现象,细胞质的染色欠均匀。模型组细胞结构模糊,细胞之间的间隙增大,排列紊乱,细胞核固缩、破裂甚至消失,胞浆染色不均匀,有明显的细胞变性和坏死。西药治疗组和中药治疗组的脑梗死组织结构得到改善,细胞排列趋向于规则、有序、清晰,细胞核固缩和弥散现象减弱,胞浆染色较模型组均匀,体积膨大的细胞数量减少,细胞损伤明显得到改善。
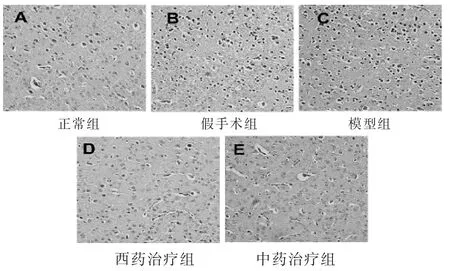
图3 各组大鼠脑组织HE染色图片(400倍)

图4 各组大鼠脑皮质微血管(Bar值为2 μm)

图5 各组大鼠脑皮质神经元细胞核(Bar值为2 μm)
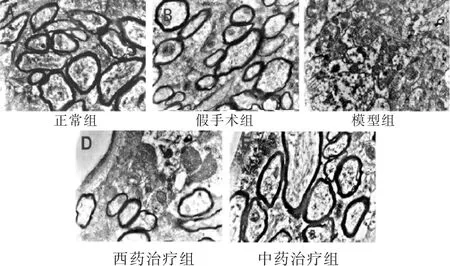
图6 各组大鼠脑组织神经元髓鞘(Bar值为2 μm)
透射电镜(图4、图5、图6)可以观察到正常组脑皮质微血管的血管壁厚,电镜下染色深,血管内皮细胞之间紧密连接,基底膜紧密连接;神经元细胞核大而圆,染色均匀,表面光滑。胞内可见基本正常的线粒体,线粒体呈杆状,椭圆形,结构完整,形态均匀,分布有序;白质中髓鞘电镜下染色较深,大小相对一致,形态层次分明。假手术组脑皮质微血管的管径出现增粗,管壁相对较薄,血管内皮细胞增大,其紧密连接微量变化,基底膜疏松;神经元细胞核开始出现弥散现象,染色不均一,表面相对光滑,细胞核周围可以观察到溶酶体的存在,线粒体数量减少,明显肿胀;白质中髓鞘排列渐变紊乱,形态出现层次分离,但没有明显的脱髓鞘现象。模型组血管形状不规则出现变形,细胞壁染色浅,甚至破损。血管内皮细胞的胞质严重水肿,胞核弥散,紧密连接断裂不规则,基底膜疏松;神经元细胞核严重弥散,染色不均一,细胞核周围可以观察到溶酶体的存在,线粒体数量减少,破坏严重,核糖体等细胞器也破坏明显;白质中髓鞘排列严重紊乱,脱髓鞘现象明显。西药治疗组及中药治疗组与模型组相比管壁相对增粗,血管内皮细胞的胞质水肿减轻,胞核弥散减轻,紧密连接逐渐恢复规则化,基底膜疏松减弱;神经元细胞核弥散现象减弱,染色比较均一,表面相对光滑,核膜结构完整,部分线粒体空化,线粒体损伤较模型组明显减轻;白质中髓鞘损伤得到一定的修复,层次清晰化,染色渐深,脱髓鞘现象得到明显改善。
3 讨 论
随着我国膳食结构的西方化和人口老龄化,以及人口基数的不断增加,糖尿病脑梗死患病率和患病的绝对人数还将不断攀升[10-12]。积极探索和深入研究糖尿病脑梗死的发病机制与有效防治方法,是一项具有重要社会意义和科学意义的医学课题。
糖尿病并发脑梗死,属中医学“消渴病中风”病范畴,其理论渊源最早可追溯到《黄帝内经》中。有关糖尿病脑梗死的中医病机一般认为气阴两虚、瘀阻脉络居多[13],痰瘀互结、痰热生风为病机核心。 《素问·上古天真论》云“女子七七”“男子八八”“天癸绝”,肾元亏虚,形神俱伤,可为中风的发病基础,正如元代沈金鏊提出“元气虚为中风之根也”,痰、瘀为元气虚所导致的中间病理产物,又为新的病理过程启动之因,痰瘀互阻,气血痹阻或者日久化火生风,风火相煽,遂发“中风”。复元醒脑汤以扶持元气为主,佐以逐瘀化痰、泄热熄风、通络为辅,治疗糖尿病脑梗死取得良好临床疗效。方中人参大补元气为君,补脾益肺,脾气健运,肺气宣畅,则痰浊自消,为扶正祛邪,治本之药;石菖蒲与胆南星均为祛痰要药,石菖蒲功擅豁痰辟秽、开窍宁神,胆南星力偏清热化痰,息风定惊,两者合用可治疗痰湿与风邪交阻脑窍之症;三七活血化瘀,大黄通腑泻下,清热解毒,兼具活血化瘀之功,与三七合用一通一涩,止血不留瘀,且能通过通腑达到涤痰泻浊之功;水蛭活血化瘀、消癥破结,近人张锡纯氏认为本品“破瘀血而不伤新血,专入血分而不损气分”,为化瘀峻品;益母草为血家圣药,尤善解郁平肝、活血祛风,诸药合用,方小力专,起“复元醒脑、逐瘀化痰、泄热息风”之功。
既往诸多实验研究表明:中药可以缩小局灶性脑缺血后大鼠脑组织梗死体积,促进脑梗死周围区的血管新生,改善脑缺血后神经功能恢复[9,14-15]。 本实验结果显示正常组和假手术组未出现梗死灶,但假手术组脑组织形态学出现了轻微的病理改变,细胞出现了轻微的损伤,脑组织微血管超微结构开始发生改变。模型组和治疗组均有明显的梗死灶及形态学改变,其中西药治疗组和中药治疗组的梗死范围和脑组织病理形态学改变均较模型组有所改善,中药治疗组相较于西药治疗组,在缩小脑梗范围方面无统计学差别。复元醒脑汤能明显缩小脑组织梗死体积,改善组织结构和细胞损伤,逐渐恢复脑内毛细血管内皮细胞之间的紧密连接,改善神经元的损伤,进而改善神经缺损功能,达到治疗糖尿病脑梗死的目的。
复元醒脑汤能明显缩小脑组织梗死体积,但神经功能缺失评分与脑梗死体积的相关性还有待深入研究,已有的研究存在着观察持续时间较短[16]、采用的神经功能评分方法不全面的问题[17]。近年来,越来越多的研究将视角转向神经元及其轴突、胶质细胞和血脑屏障(BBB)等组成的复合体——神经血管单元(NVU)[18]。神经血管单元各组分正常的信号转导、相互作用组成协调统一的整体,维护着血-脑屏障的稳定。神经元一直被视为中枢神经系统中最重要的细胞,其损伤、功能失调甚至死亡将直接导致神经功能的缺失。神经元和微血管的联系不仅仅是血流的调节,还与血-脑屏障的通透性有关。BBB是NVU的核心结构,由脑微血管内皮细胞、基底膜基质、周细胞、星形胶质细胞足突等组成。微血管内皮细胞既是缺血性损伤的靶点,也是缺血性损伤的平台,作为脑微血管的特殊结构,还有复杂的内分泌、代谢功能,与多种细胞组织、器官相互联系,脑血管内皮细胞还可以通过分泌脑源性神经因子的方式,使神经元免受缺血、缺氧和应激等损害[19]。NVU与缺血性脑损伤的发生发展关系密切。缺血时血管系统与神经组织之间相互损伤,NVU的完整性和功能的全面性被破坏,神经元、胶质细胞和血管内皮之间的损伤存在相互促进的关系,NVU中任何组分的损伤都会波及其他组分[20]。卒中后,血管的新生对患者的恢复非常重要,治疗性血管新生是目前研究的热点与难点,然而,血管新生并不是血管内皮细胞独立发挥作用,而是NVU多种细胞间相互作用的整合;血管新生与神经再生、突触重塑等多种修复机制密切互补。复元醒脑汤能明显改善缺血脑组织的组织结构与细胞损伤,改善脑内毛细血管内皮细胞与神经元的损伤,这种针对缺血损伤中神经血管单元中的各组成成分,进行多途径、多方位的治疗,可能是该方有效治疗糖尿病脑梗死的原因,其具体的机制尚有待进一步探讨。
[1]Kernan WN,Viscoli CM,Inzucchi S,et al.Piogli tazone improves insulin sensitivity among nondiabetic patients with a recent transient ischemic attack or ischemic stroke [J].Stroke;a Journal of Cerebral Circulation,2003,34(6):1431-1436.
[2]Pencina MJ,Larson MG,Massaro JM.et al.Predicting the 30-year risk of cardiovascular disease:The Framingham Heart Study[J].Circulation,2009,19(24):13078-3084.
[3]丁学屏.中西医结合糖尿病学[M].北京:人民卫生出版社,2004:318.
[4]孙丽华,崔海峰,孙明杰,等.链脲佐菌素制备糖尿病大鼠模型探讨[J].中国实验动物学报,2012,20(6):15-17.
[5]王海涛,杨明峰,孙保亮,等.糖尿病并脑梗死大鼠模型的建立体会[J].中西医结合心脑血管病杂志,2013,11(8):971-972.
[6]包新杰,赵浩,赵英杰,等.线栓法插线深度对大鼠脑梗死模型制备的影响[J].中国实验动物学报,2011,19(3):233-236.
[7]李艳红,孙晓萍,欧丽娟,等.线栓法大鼠局灶性脑缺血模型制作方法的改进及评价[J].解剖学杂志,2007,30(5):597-601.
[8]T SOBRINO,O HURDATO,MA MORO,et al.The increase of circulating endothelial progenitor cells after acute ischemic stroke is associated with good outcome[J].Stroke,2007,38(10):2759-2764.
[9]梁燕玲,高敏,刘子凡,等.银杏叶提取物对大鼠局灶性脑缺血后血管新生的影响[J].中国医药科学,2013,3(20):14.
[10]林兰.糖尿病中西医结合诊疗规范[M].北京:军事医学科学出版社,2010:58-68.
[11]Aljada A,Friedman J, Dandona P,et al.Glucose ingestion induces an increase in intranuclear factor KappaB,a fall in cellular inhibitor KappaB and an increase in tumornecrosis factor alpha messenger RNA by mononuclear cells in healthy human subjects[J].Metabolism,2006,55(9):1177-1185.
[12]刘远静,戴江华,肖顺泰,等.糖尿病性脑梗死的临床研究[J].国际神经病学神经外科杂志,2008,35(2):123-124.
[13]李创鹏,谌剑飞,彭敏,等.糖尿病缺血性中风中脏腑、中经络证候与高凝血症及胰岛素抵抗关系的研究[J].中国中西医结合杂志,2002,22(3):185-187.
[14]孟华,朱妙章,郭军,等.中药当归、川芎、丹参提取液促血管生成作用的实验研究[J].中药材,2006,29(6):574-576.
[15]高冬,陈文元,林薇,等.血府逐瘀汤促血管新生中VEGF通路的作用研究[J].中国中药杂志,2012,37(17):2622-2625.
[16]Boyko M,Ohayon S,Goldsmith T,et al.Morphological and neuro-behavioral parallels in the rat model of stoke[J].Behav Brain Res,2011,233(1):17-23.
[17]刘小蒙,王荣亮,罗玉敏.大鼠脑缺血神经功能缺损行为学评价的研究进展[J].中国脑血管病杂志,2012,9(4):208-212.
[18]del Zoppo GJ.Stroke and neurovascular protection[J].N Engl J Med,2006,354:553-555.
[19]赵全明,宋岳涛.星形胶质细胞条件培养液对体外模拟脑缺血再灌注损伤神经元的作用[J].解剖学杂志,2006,9(4):468-472.
[20]del Zoppo GJ.Inflammation and theneurovascular unit in the setting of focal cerebralischemia[J].Neuroscience,2009,158(3):972-982.

