基于ESR光谱技术检测食品中自由基的研究进展
李延华 王伟军 陈望华 张仲慧 俞佳丽 楼锦雯
(浙江工商大学食品与生物工程学院1,杭州 310018) (浙江一鸣食品股份有限公司2,温州 325000)
食品中涉及的脂质氧化反应是食物腐败变质的重要原因之一,并影响保质期和产品质量。食物中不饱和脂质的氧化可视为酸败,同时蛋白质的氧化也可能导致其他异味,且在某些情况下会导致质地的变化。维生素和多不饱和脂肪酸的氧化会降低营养价值,并形成潜在的有毒氧化产物,同时食品中天然色素的氧化会导致食品变色。食品中不同组成成分在氧化过程中会发生一系列反应,如自动氧化、光敏氧化、酶促氧化等,自由基是一些反应的中间体[1]。自由基又称游离基,是指外层轨道含有不成对电子的原子、原子团或特殊状态的分子。
目前,可以采用分光光度法、高效液相色谱法、化学发光技术、电化学法、毛细管电泳技术及电子顺磁共振技术等方法检测自由基[2]。采用电子顺磁共振(ElectronParamagneticResonance,EPR)可以检测出生物材料中自由基的存在,ESR可以应用于食品氧化破坏性反应的早期阶段[3]。此外,通过ESR检测自由基所提供重要的机理信息,可用于来设计食品的抗氧化防护措施[4-5]。采用ESR检测自由基来预测食品的氧化稳定性,并进一步量化预测食品质量的变化具有重要意义。
1 食品中自由基的ESR检测
1.1 ESR检测食品中自由基的原理
ESR也被称为电子磁共振(Electronmagneticresonance,EMR)可在原子和自由基中检测未成对电子。波谱学研究中,通常是把被测物质放在静磁场中,来控制不成对电子之间产生的能级分裂。ESR基本原理为电子是具有一定质量和带负电荷的一种基本粒子,它能进行两种运动:一是在围绕原子核的轨道上运动,二是通过本身中心轴所做的自旋。由于电子运动产生力矩,在运动中产生电流和磁矩,在外加磁场中,简并的电子自旋能级将产生分裂。若在垂直外磁场方向加上合适频率的电磁波,能使处于低自旋能级的电子吸收电磁波能量而跃迁到高能级,从而产生电子的顺磁共振吸收现象[3,6]。
ESR光谱以G因子为特征,其与塞曼效应有关,且由公式确定。其中h是普朗克常数(6.626 075 5·10-34J·S),υ为应用微波辐射的频率,β为Bohr磁子(9.274 015 4·10-24J·T-1),B为磁场。
hυ=gβB
顺磁核往往可以引起ESR线超精细分裂,所形成的未成对电子相互作用,提供有用的结构信息使自由基被识别。大多数商业ESR仪器操作的微波频率约为10GHz(X波段)。固体和液体可用宽温度范围内的ESR研究,且样品不需要透明,这使得该技术可用于研究食物。非常高的灵敏度使得该技术可检测出食品氧化早期阶段的自由基,可采用ESR技术比较几种食品样品中自由基的相对浓度。在这种情况下,样品尽可能保持一致是非常重要的。因此,当必须计算自由基的绝对浓度时,使用具有尽可能与样品相同的已知浓度的稳定自由基作为参考样品至关重要。1.2ESR在不同食品中存在的自由基的检测中的应用
在食物氧化过程中形成的基团通常是高度反应性物质,因此,在大多数情况下仅作为具有非常低的稳态浓度的短寿命中间体被遇到。自由基的寿命往往在固体样品中急剧增加,例如干燥或冷冻的食物,其中的分子成分被物理捕获,从而防止或减缓化学反应,否则将迅速淬灭自由基的形成[7]。通常可以实现:在室温下采用ESR直接检测干燥食物中的持续性自由基,其中ESR可检测的物理捕获自由基浓度可在生产和储存期间累积。在干燥食品的ESR光谱中仅观察到G值范围在2.003~2.006的一条单线和总振幅宽度为4~12高斯(图1)。此外,由于Mn2+的存在,在很多情况下生物组织的ESR谱中可以观察到到六重线(图1)[8]。
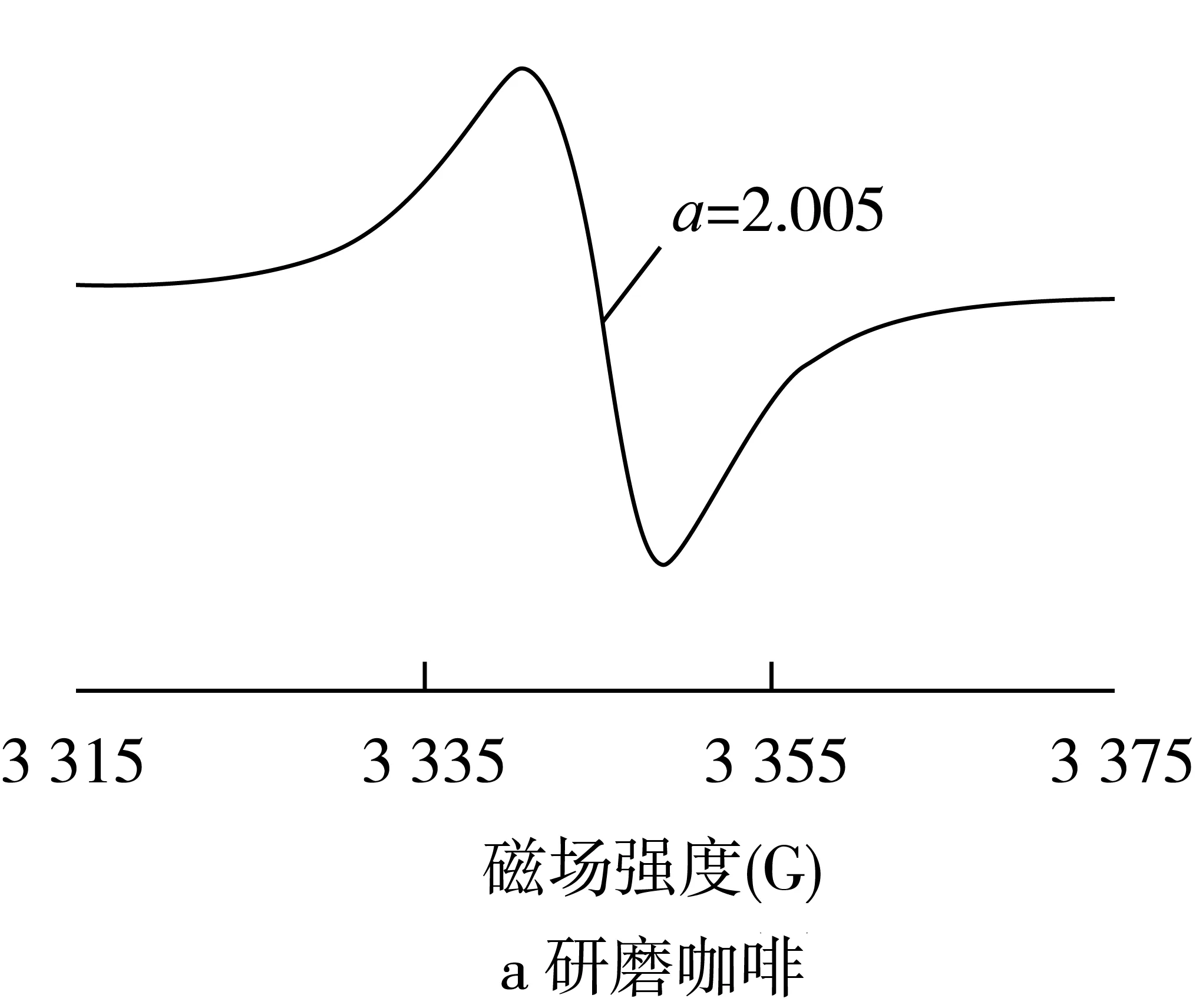

图1 干燥食品中自由基的典型ESR谱图
在干燥食品或含有固体物质,如骨或壳等固体材料的食品中,自由基的保留时间使其可能用ESR检测和定量(剂量)辐照处理,可以形成具有特征ESR谱的稳定自由基常数[9]。干燥食品中稳定自由基的起源是未知的,一些来源已经被提出,包括碳水化合物热处理所产生的反应[10],或多酚的氧化[11]和蛋白质的氧化[4],或美拉德产物的形成[12]。然而,干燥食品中的稳定自由基已被证明是干燥产品氧化状态的良好的标记,且一些研究显示自由基的水平与脂质氧化程度或与外部因素如热、光和储存时间相关,都有可能诱发氧化(见表1)。

表1 干燥食品中自由基的ESR检测
除了干燥食品外,冷冻食品样品中的自由基稳定化可以直接采用ESR检测,用于研究油脂自动氧化中涉及的自由基。Yanez等[26]和Geoffrey等[27]研究了77K下光诱导冷冻甘油三酯中脂质自由基的形成,提出光照和提高温度会使不饱和脂质产生大量的自由基,而饱和脂质在过氧自由基损失出现的情况下没有形成新的自由基。Troup等[28]已在葡萄酒的冷冻样品中检测到从酚类化合物中衍生的自由基,提出葡萄酒中的自由基与酚类物质有关,任何抑制脂质氧化的葡萄酒中的酚类物质在体外将产生自由基。
2 自旋捕获在食品中自由基检测方面的应用
大多数食物都含有水,这些水可以使食品中的成分扩散。因此,大多数食品中的自由基很短暂,稳态浓度太低的不能用ESR技术直接检测到。然而,在这些条件下的自由基间接检测可以通过使用自旋捕获技术进行。通过使用自旋捕获技术,将反应性自由基引入自旋陷阱形成稳定自由基(称为自旋加合物)(图2和图3)[29]。自旋加合物的稳定性允许ESR检测浓度的积累。自旋捕获技术已被用来表征在饮料中形成的自由基,如:咖啡[30]以及在啤酒氧化过程中形成的自由基(图4)[31]。

图2 食物中用于捕获自由基的常见自旋捕集物质
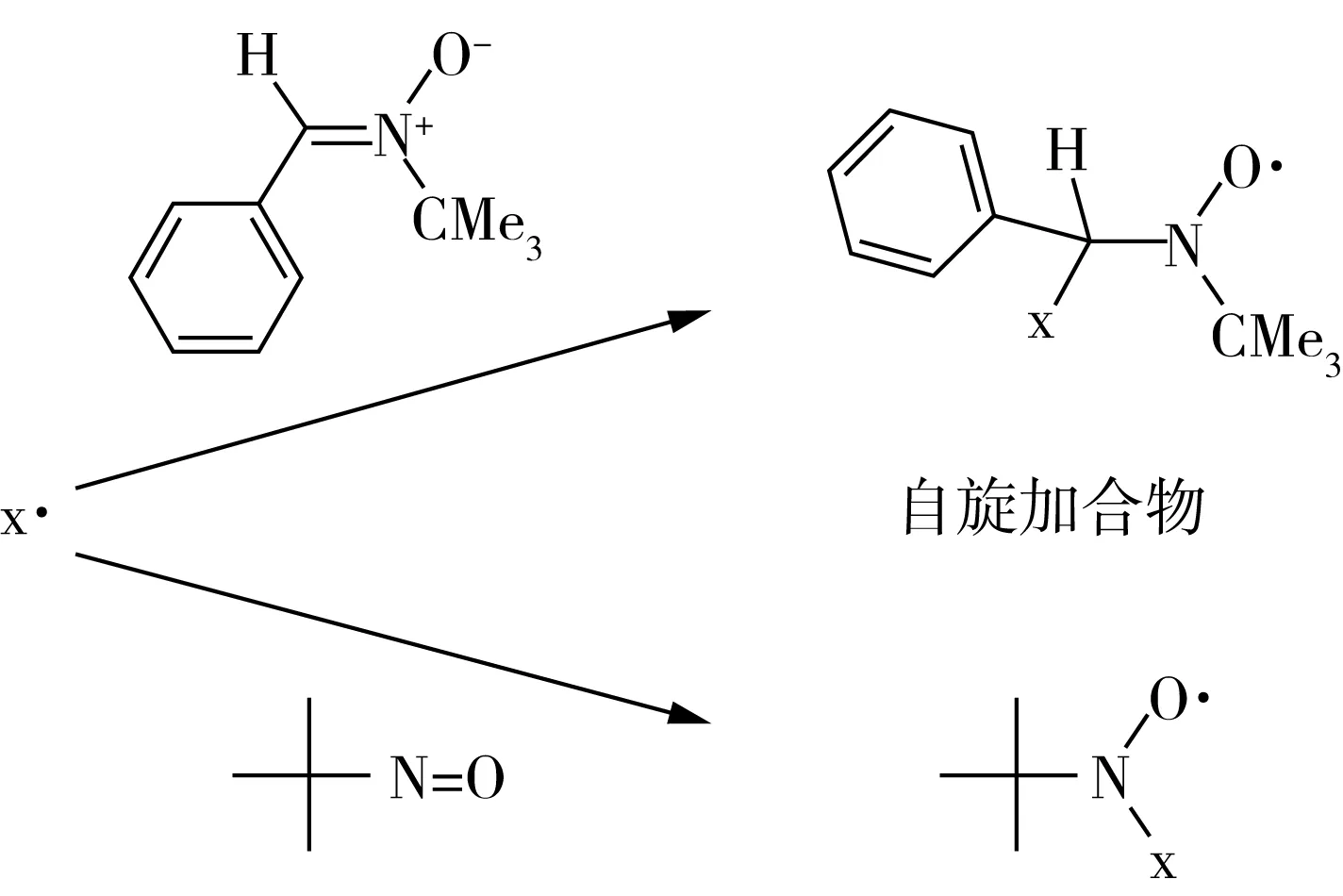
图3 添加自旋引发剂形成的自旋加合物


图4 采用旋转阱DMPO并通过Fenton反应产生自由基
自旋捕集技术也被用于检查自由基在富含鱼油的蛋黄酱的形成趋势,以评价富含鱼油的蛋黄酱中不饱和脂类抗氧化的保护措施[32-33]。将自旋阱PBN混合到蛋黄酱中,并且在通过ESR检测自由基的量之前将样品在37 ℃下温和加热24~36h,自由基的量可以通过与在蛋黄酱中发现的稳定氮氧自由基12-硬脂酸来量化[34]。
3 预测食品氧化稳定性
食品的加速老化经常被用来预测食物的长期稳定性。通常测定氧化水平,是测量初次或二次氧化产物的形成。采用ESR检测技术可以更为直接地研究参与氧化反应的自由基,这使得在强制老化实验中,它能够更直接地确定氧化水平。该方法已被用于酿酒行业,并取得巨大成功,可用于预测啤酒风味稳定性[35-37]。在除去溶解的CO2之后,将自旋陷阱(PBN)添加到啤酒中,然后啤酒用进入大气中的氧气加热(50~60 ℃)。啤酒中抗氧化剂的存在将在最初抑制自由基的形成,导致在实验开始时自旋加合物水平较低。抗氧化剂被其自身行为所消耗,以至于当所有活性抗氧化剂被消耗完时,自由基最终会不受阻碍的形成,导致自旋加合物水平稳步上升,图5为有氧加热过程中啤酒中形成PBN自旋加合物。

图5 在有氧加热过程中啤酒中形成PBN自旋加合物
初始滞后阶段(也被称为诱导期或滞后时间)的长度主要是由抗氧化剂和氧化剂之间的竞争决定的,这也可能是啤酒常规存储条件下氧化稳定性的关键因素。鲜啤酒滞后时间的确定已被证明与贮存稳定性相关,使该方法适合于保质期的早期预测。ESR延迟时间法也被用于检测潜在的抗氧化剂对啤酒氧化稳定性的影响[38]。
ESR滞后时间法已用于脂质体稳定性的预测,原则上也可以使用它来判断脂质是否存在于更复杂的系统[30,39]。Velasco等[40]用ESR方法测定的植物油中脂肪氧化的延迟时间已显示出与传统量化脂质稳定性的方法相关。Raitio等[41]采用ESR技术检测了在50 ℃下储存7d的半固体棕榈油中自由基的变化,并预测提出可以采用ESR技术分析棕榈油在储存过程中发生的劣变。Roman等[42]采用该技术研究了植物油中氢过氧化物降解的动力学过程,发现ESR技术可以识别、量化和衡量可食用植物油的氢过氧化降解反应。
采用自旋捕获检测热处理过程中自由基的形成趋势也被用来评估原料乳[43]、甘蔗酒[44]、加工猪肉[45]和干腌火腿[46]的氧化稳定性。将肉样品在含有旋转陷阱POBN的缓冲液中匀浆,然后加热浆液,再从浆料中取样,过滤并随后通过ESR分析。
4 ESR技术在食物氧化过程中的应用
ESR也被用来检测单线态氧1O2的产生,在自由基不参与的情况下可诱导甘油二酯氧化[47]。单线态氧可氧化2,2,6,6-四甲基-4-哌啶酮为稳定的硝酰自由基,后者可以用ESR检测。该技术已被用于研究单线态氧的生成,这主要是通过色素,如叶绿素和肌红蛋白发生作用产生。ESR和自旋捕获自由基已被用于鉴定核黄素在光线中的特征作用,在啤酒中诱导形成自由基[48],并确定异草酮氧化时的中间体[49],同时异草酮的直接光降解可以用具有时间分辨的ESR(TREPR)研究[50]。
抗氧化剂的存在是影响食品氧化稳定性的一个重要因素。测定食品中抗氧化剂有效性的许多实验是基于测量淬灭稳定自由基的能力,这种方法被称为自旋清除,该方法已经和ESR检测一起用于稳定自由基的检测,如1,1-二苯基-2-苦肼基自由基、DPPH[51]、2,6-二叔丁基-(3,5-二叔丁基-4-氧代-2,5-环己二烯)-对甲苯氧自由基[52]和2,2,6,6-四甲基哌啶-1-氧基自由基、TEMPO[23]。ESR谱证明这些研究是有效果的,因为较低浓度的自由基水平即可研究不具有光学透明的样本。Falch等[53]采用ESR技术分析了轻度氧化的大马哈鱼内脏油和鱼肝油的氧化程度,同时测定了两种鱼油中在存放过程中过氧化值和硫代巴比妥酸值的变化。
ESR的线宽取决于Heisenberg自旋交换生成顺磁性物质的存在。氧是一个非常常见的顺磁性化合物,氧的浓度会影响线的宽度。通过记录稳定自由基的线宽(所谓的自旋探针)可以测量氧气浓度。这种方法已被用来测量封装在玻璃状的碳水化合物/蛋白质基质中的氧的浓度,从而研究在不同温度下氧穿透玻璃状食品组分的能力[54]。
5 展望
在食品科学领域,ESR是一种相对较新的分析方法,已成功检测不同食品中存在的自由基,并用来预测食品的氧化稳定性。同时,自旋陷阱的引入有利于形成稳定的自由基,并提可以提高ESR在食品体系中自由基的检测效果。然而,ESR技术测定成分较高,低成本和便于用户使用型的新一代ESR仪器有利于食品质量控制实验室的引进与应用。此外,在食品体系中用于自由基形成过程成像的场梯度ESR光谱技术有待进一步发展,原因在于氧化过程的空间传播可以在多相的食品体系中进行研究,并且可以用来鉴定促氧化物质的结构以及优化食品中抗氧化成分的效果。
[1]MARIUTTILR,BRAGAGNOLON.Influenceofsaltonlipidoxidationinmeatandseafoodproducts:Areview[J].FoodResearchInternational, 2017, 94:90-100
[2]郑国灿,肖尚友,穆小静, 等. 自由基检测技术进展[J].广州化学, 2006, 3l:9:37-44ZHENGGC,XIAOSY,MUXJ,etal.Advanceindeterminationoffreeradicals[J].GuangzhouChemistry, 2006, 3l:9:37-44
[3]CLARELH,MICHAELJD.DetectionandcharacterisationofradicalsinbiologicalmaterialsusingEPRmethodology[J].BiochimicaetBiophysicaActa, 2014, 2:708-721
[4]ANDERSENML,SKIBSTEDLH.Detectionofearlyeventsinlipidoxidationbyelectronspinresonancespectroscopy[J].EuropeanJournalofLipidScienceandTechnology, 2002, 104:65
[5]ROMANO,MAILLARDMN,PLESSISC,etal.Electronspinresonancespectroscopy:apromisingmethodforstudyinglipidoxidationinfoods[J].LipidTechnology, 2010, 22:87-90
[6]赵保路. 电子自旋共振(ESR)技术在生物和医学中的应用[J].波谱学杂志, 2010, 27:51-67ZHAOBL.Applicationsofelectronspinresonance(ESR)inbiologyandmedicine[J].ChineseJournalofMagneticResonance, 2010, 27:51-67
[7]MOGENSLA,LEIFHS.ESRspectroscopyforthestudyofoxidativeprocessesinfoodandbeverages[M].ModernMagneticResonance, 2008, 1861-1866
[8]BLAKLEYRL,HENRYDD,MORGANWT,etal.Quantitativeelectronparamagneticresonance:theimportanceofmatchingtheQ-factorofstandardsandsamples[J].AppliedSpectroscopy, 2001,55:1375-1381
[9]SAIFUTDINOVRG,LARINALI,VAKUL′SKAYATI,etal.Electronparamagneticresonanceinbiochemistryandmedicine[M].NewYork:KluwerAcademic/PlenumPublishers,2002:6931-6937
[10]GONISJ,HEWITTDG,TROUPG,etal.Thechemicaloriginoffreeradicalsincoffeeandotherbeverages[J].FreeRadicalResearch, 1995, 23(4): 393
[11]GALLEZG,BAUDELETC,DEBUYSTR.Freeradicalsinlicorice-flavoredsweetscanbedetectednoninvasivelyusinglowfrequencyelectronparamagneticresonanceafteroraladministrationtomice[J].JournalofNutrition, 2000, 130:1831-1833
[12]HOFMANT,BORSW,STETTMAIERK.Freeradicalsinfood[M]//MorelloMJ,ShahidiF,HoC-T.Chemistry,NutritionandHealthEffects.AmericanChemicalSociety,Washington:ACSSymposiumSeries807. 2002: 49
[13]SANTANILLAJD,FRITSCHG,MULLER-WARMUTHW.Determinationofcarbendazimandthiophanate-methylresiduesinsomevegetablesandfruitsbyhighpressureliquidchromatography[J].ZeitschriftFurLebensmittel-untersuchungUnd-forschungA-foodResearch, 1981, 172:81-83
[14]SCHAICHKM,REBELLOCA.Extrusionchemistryofwheatflourprotein.I.Freeradicalformation[J].CerealChemistry, 1999, 76:748-755
[15]ZAWADAK,KOZOWSKAM,ZBIKOWSKAA.Oxidativestabilityofthelipidfractionincookies-theEPRstudy[J].Nukleonika, 2015, 60 (3):469-473
[16]NISSENLR,HUYNH-BAT,PETERSENMA,etal.Potentialuseofelectronspinresonancespectroscopyforevaluatingtheoxidativestatusofpotatoflakes[J].FoodChemistry, 2002, 79:387-394
[17]SZOCSF.WalnutfreeradicalsstudiedbyESR[J].JournalofFoodScience, 2002,67:953
[18]YORDANOVND,MladenovaR.EPRstudyoffreeradicalsinbread[J].SpectrochimicaActaPartA-molecularandBiomolecularSpectroscopy, 2004, 60:1395-1400
[19]JENSENPN,DANIELSENB,BERTELSENG,etal.Storagestabilitiesofporkscratchings,peanuts,oatmealandmuesli:ComparisonofESRspectroscopy,headspace-GCandsensoryevaluationfordetectionofoxidationindryfoods[J].FoodChemistry, 2005, 91:25-28
[20]STAPELFELDTH,NIELSENBR,SKIBSTEDLH.Effectofheattreatment,wateractivityandstoragetemperatureontheoxidativestabilityofwholemilkpowder[J].InternationalDairyJournal, 1997, 7:331-339
[21]STAPELFELDTH,NIELSENKN,JENSENSK,etal.Freeradicalformationinfreeze-driedrawmilkinrelationtoitsalpha-tocopherollevel[J].JournalofDairyResearch, 1999, 66:461-466
[22]KRISTENSEND,SKIBSTEDLH.Comparisonofthreemethodsbasedonelectronspinresonancespectrometryforevaluationofoxidativestabilityofprocessedcheese[J].JournalofAgriculturalandFoodChemistry, 1999, 47: 3099-3104
[23]KRISTENSEND,ORLIENV,MORTENSENG,etal.Light-inducedoxidationinslicedHavarticheesepackagedinmodifiedatmosphere[J].InternationalDairyJournal, 2000, 10:95-103
[24]THOMSENMK,KNUDSENJC,RISBOJ,etal.Effectoflactosecrystallisationontheoxidativestabilityofinfantformula[J].Milchwis-senschaft, 2003, 58:406-409
[25]NISSENLR,MANSSONL,BERTELSENG,etal.Protectionofdehydratedchickenmeatbynaturalantioxidantsasevaluatedbyelectronspinresonancespectrometry[J].JournalofAgriculturalandFoodChemistry, 2000, 48:5548-5556
[26]YANEZJ,SEVILLACL,BECKERD,etal.Low-temperatureautoxidationinunsaturatedlipids:anelectronspinresonancestudy[J].JournalofPhysicalChemistry, 1987, 91:487-491
[27]GEOFFREYM,LAMBELETP,RICHERTP.Roleofhydroxylradicalsandsingletoxygenintheformationofprimaryradicalsinunsaturatedlipids:asolidstateelectronparamagneticresonancestudy[J].JournalofAgriculturalandFoodChemistry, 2000, 48:974
[28]TroupGJ,HuttonDR,HewittDG,etal.Freeradicalsinredwine,butnotinwhite?[J].FreeRadicalResearch, 1994, 20:63-68
[29]ROSENGM,BRITIGANBE,HALPERNHJ,etal.FreeRadicals.BiologyandDetectionbySpinTrapping[M].NewYork:OxfordUniversityPress, 1999
[30]PASCUALEC,GOODMANBA,YERETZIANC.Characterizationoffreeradicalsinsolublecoffeebyelectronparamagneticresonancespectroscopy[J].JournalofAgriculturalandFoodChemistry, 2002, 50:6114-6122
[31]ANDERSENML,SKIBSTEDLH.Electronspinresonancespintrappingidentificationofradicalsformedduringaerobicforcedagingofbeer[J].JournalofAgriculturalandFoodChemistry, 1998, 46: 1272-1275
[32]THOMSENMK,JACOBSENC,SKIBSTEDLH.Mechanismofinitiationofoxidationinmayonnaiseenrichedwithfishoilasstudiedbyelectronspinresonancespectroscopy[J].EuropeanFoodResearchandTechnology, 2000, 211:381-386
[33]JACOBSENC,HARTVIGSENK,THOMSENMK,etal.Lipidoxidationinfishoilenrichedmayonnaise:calciumdisodiumethylenediaminetetraacetate,butnotgallicacid,stronglyinhibitedoxidativedeterioration[J].JournalofAgriculturalandFoodChemistry, 2001, 49:1009-1019[34]THOMSENMK,VEDSTESENH,SKIBSTEDLH.Quantificationofradicalformationinoil-in-waterfoodemulsionsbyelectronspinresonancespectroscopy[J].JournalofFoodLipids, 1999, 6:149-158
[35]UCHIDAM,ONOM.Improvementforoxidativeflavorstabilityofbeers-RoleofOH-radicalinbeeroxidation[J].JournaloftheAmericanSocietyofBrewingChemists, 1996, 54:198-204
[36]UCHIDAM,SUGAS,ONOM.Improvementforoxidativeflavorstabilityofbeer-rapidpredictionmethodforbeerflavorstabilityofelectronspinresonancespectroscopy[J].JournaloftheAmericanSocietyofBrewingChemists, 1996, 54: 205-211
[37]FRANZO,BACKW.Experiencesinmeasuringfreeradicalsusingelectrospinresonancespectrometryinthebrewery[J].MonatsschriftFuBrauwissenschaft, 2002, 55:156-162
[38]ANDERSENML,OUTTRUPH,SKIBSTEDLH.PotentialantioxidantsinbeerassessedbyESRspintrapping[J].JournalofAgriculturalandFoodChemistry,2000, 48:3106-3111
[39]ANDERSENML,VELASCOJ,SKIBSTEDLH.AnalysisofLipidOxidation[M]//Kamal-EldinA,PokornyJ.Champaign:AOCSPress, 2005, 127
[40]VELASCOJ,ANDERSENML,SKIBSTEDLH.Evaluationofoxidativestabilityofvegetableoilsbymonitoringthetendencytoradicalformation.AcomparisonofelectronspinresonancespectroscopywiththeRancimatmethodanddifferentialscanningcalorimetry[J].FoodChemistry, 2004, 85:623-632
[41]RAITIOR,ORLIENV,SKIBSTEDLH.Electronspinresonancespectroscopyforevaluationofearlyoxidativeeventsinsemisolidpalmoil[J].EuropeanJournalofLipidScienceandTechnology, 2011, 113:208-213
[42]ROMANO,COURTOISF,MAILLARDMN,etal.Kineticstudyofhydroperoxidedegradationinedibleoilsusingelectronspinresonancespectroscopy[J].JournaloftheAmericanOilChemistsSociety, 2012, 89:1409-1417
[43]KRISTENSEND,ANDERSENML,SKIBSTEDLH.Predictionofoxidativestabilityofrawmilkusingspintrappingelectronspinresonancespectroscopy[J].Milchwissenschaft. 2002, 57:255-258
[44]BETTINSM,ISIQUEWD,FRANCODW,etal.Phenolsandmetalsinsugar-canespirits.Quantitativeanalysisandeffectonradicalformationandradicalscavenging[J].EuropeanFoodResearchandTechnology, 2002, 215:169-175
[45]CARLSENCU,ANDERSENML,SKIBSTEDLH.Oxidativestabilityofprocessedpork.AssaybasedonESR-detectionofradicals[J].EuropeanFoodResearchandTechnology, 2001, 213:170-173
[46]ANDR′ESAI,MOLLERJKS,ADAMSENCE,etal.Highpressuretreatmentofdry-curedIberianham.Effectonradicalformation,lipidoxidationandcolour[J].EuropeanFoodResearchandTechnology, 2004, 219:205-210
[47]WHANGK,PENGIC.Electronparamagneticresonancestudiesoftheeffectivenessofmyoglobinanditsderivativesasphotosensitizersinsingletoxygengeneration[J].JournalofFoodScience,1988, 53:1863-1865
[48]LAANEC,DEROOG,VANDENBANE,etal.Theroleofriboflavininbeerflavourinstability:EPRstudiesandtheapplicationofflavinbindingproteins[J].JournaloftheInstituteofBrewing, 1999, 105: 392
[49]HUVAEREK,ANDERSENML,OLSENK,etal.Radicaloid-typeoxidativedecompositionofBeerbitteringagentsrevealed[J].Chemistry-aEuropeanJournal, 2003,9:4693-4699
[50]BURNSCS,HEYERICKA,DEKEUKELEIRED,etal.Mechanismforthelightstruckflavorinbeerrevealedbytime-resolvedelectronparamagneticresonance[J].Chemistry-aEuropeanJournal, 2001, 7:4554-4561
[51]CHENC,TANGHR,SUTCLIFFELH,etal.Greenteapolyphenolsreactwith1,1-diphenyl-2-picrylhydrazylfreeradicalsinthebilayerofliposomes:directevidencefromelectronspinresonancestudies[J].JournalofAgriculturalandFoodChemistry, 2000,48:5710-5714
[52]QUILESJL,RAM′IREZ-TORTOSAMC,G′OMEZJA,etal.RoleofvitaminEandphenoliccompoundsintheantioxidantcapacity,measuredbyESR,ofvirginolive,oliveandsunfloweroilsafterfrying[J].FoodChemistry, 2002, 76:461-468
[53]FALCHE,VELASCOJ,AURSANDM,etal.DetectionofradicaldevelopmentbyESRspectroscopytechniquesforassessmentofoxidativesusceptibilityoffishoils[J].EuropeanFoodResearchandTechnology, 2005, 221:667-674
[54]ANDERSENAB,RISBOJ,ANDERSENML,etal.Oxygenpermeationthroughanoil-encapsulatingglassyfoodmatrixstudiedbyESRlinebroadeningusinganitroxylspinprobe[J].FoodChemistry, 2000, 70:499-508.

