玫及乳膏促进大鼠Ⅲ期压疮溃疡愈合的实验研究*
李善华 熊万宁 朱爱萍 李 莉
(1.湖北省十堰市太和医院,湖北医药学院附属医院,湖北 十堰 442000;2.湖北医药学院基础医学院,湖北 十堰 442000)
压疮(PU)又名压力性溃疡,具有难愈合性的临床特点,一旦发生则经久不愈,Ⅲ期以上PU常伴发感染,PU溃疡面皮肤组织破损及坏死,患者最终因全身器官功能衰竭而死亡,已成为截瘫患者的直接死亡原因之一[1]。目前对PU的研究比较深入,其中皮下组织缺血-再灌注损伤是其主要病理基础,认为皮肤损伤程度与缺血-再灌注损伤时间呈正相关[2]。分子生物学研究表明,在压疮的愈合过程中金属蛋白酶-2(MMP-2)、纤维结合蛋白(FN)、转化生长因子-β1(TGF-β1)及血管内皮生长因子(VEGF)等均发挥着作用重要作用。MMP在PU的形成过程中是导致胶原纤维降解的始动因素[3]。VEGF是最强的促血管形成的始动因子,在受损组织中具有很强的诱导和促进血管内皮细胞分裂增生、促进微小血管新生的能力[4]。而TGF-β1具有促进间质细胞增殖和细胞外基质的合成功能[5]。FN是广泛存在于细胞表面、基膜、相邻细胞间及结缔组织中,其对维持表皮细胞完整性及防御功能具有重要作用,可促进创伤修复[6]。笔者采用自制玫及乳膏外敷治疗PU的临床疗效显著,但关于其治疗机制还无相关研究。为探索其治疗机制,本实验建立大鼠缺血-再灌注Ⅲ期PU模型并在PU部位涂敷玫及乳膏,研究其对PU形成过程中MMP-2、FN、TGF-β1及VEGF等相关因素的影响。现报告如下。
1 材料与方法
1.1 实验动物 SPF级SD大鼠120只,雄性,体质量160~170g,大鼠由湖北医药学院实验大鼠中心提供,生产许可证:SCXK(鄂)2017-0008,设施许可证号:SYXK(鄂)2017-0031。
1.2 药品与试剂 玫及乳膏(十堰市太和医院药剂科自制); 大鼠 MMP-2、FN、TGF-β1 及 VEG ELISA 试剂盒(上海双赢生物科技有限公司)。
1.3 造模及分组 大鼠造模前室温分笼适应性喂养1周,造模后自由饮水及进食,自然光照,动物房温度22~24℃,恒湿60%~70%。实验前采用随机数字表编号后,随机取40只设为空白对照组,另80只大鼠造模。术前禁食12 h,不禁水,腹腔注射10%水合氯醛(3 mL/kg),约5 min后大鼠麻醉好。备皮:用电动剔须刀剔去左侧臀部鼠毛,消毒。手术造模:在臀部切开长约2 cm皮肤,注意应深至肌肉,用玻璃分针钝性分离臀大肌,然后将直径16 mm、厚2 mm的磁片植入到臀大肌内,缝合肌肉组织-筋膜-皮肤,消毒。待24 h后,于植入磁片的皮肤处放置磁铁,利用磁铁引力加压造成局部缺血,加压2 h后取下外源磁铁恢复加压皮肤和肌肉组织血流,间隔30 min重复以上步骤,每日3次。术后所有大鼠均单笼正常喂养以防咬伤。成模标准:4 d后,当受压皮肤变黑、变硬,用针刺不出血时,即可判断为Ⅲ期PU[7]。本PU模型构建简单,成模率为100%。成模后将造模的80只大鼠随机分为模型组及实验组。空白对照组40只备皮后不再做任何处理作为对照。模型组及实验组均每日清创处理创面,清创时用0.9%氯化钠注射液浸泡冲洗PU创面,剪或切除局部坏死结痂组织,清理到新鲜组织后再用3%双氧水彻底冲洗消毒,然后用0.9%氯化钠注射液彻底冲洗创面和周围皮肤以除去消毒液,用无菌棉拭干。实验组上药:将玫及乳膏均匀涂在PU表面,厚度以1 mm为宜,然后用纱布覆盖。模型组清创处理同实验组,清创消毒后用0.9%氯化钠注射液纱布覆盖创面。空白对照组用0.9%氯化钠注射液冲洗浸泡与模型组及实验组相同部位,也用0.9%氯化钠注射液纱布覆盖。以上处理每日1次,治疗21 d。如创面愈合可停止治疗。
1.4 标本采集与检测 1)统计模型组及实验组PU显效时间、愈合速度并计算PU愈合率。创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。PU愈合速度=创面最终愈合时间/创面的最大直径。2)组织检测指标。在第1、3、7、14日时,每组随机选取10只大鼠,处死后取PU肉芽组织制成匀浆,1000 r/min离心 10 min,取上清液,作为 MMP-2、FN、TGF-β1 及VEGF的待测样品,采用固相夹心法酶联免疫吸附实验检测 VEGF及 FN 的含量。 MMP-2、FN、TGF-β1等检测时用相应的ELISA试剂盒,严格按实验步骤操作读取相应值并换算出相应浓度即可。
1.5 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,采用 t检验及 χ2检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠 MMP-2、FN、TGF-β1及 VEGF含量比较 见表1。在治疗3、7、14 d时,模型组MMP-2升高,FN、TGF-β1及VEGF均降低,且在7 d时 MMP-2含量升高达峰值,在第14日时FN、TGF-β1及VEGF含量降低达低峰,与空白对照组同期比较,差异有统计学意义(P<0.05)。实验组在第7日时MMP-2含量降低达低峰,在第14日时FN、TGF-β1及VEGF含量最高,实验组与模型组在第7日和14日时MMP-2、FN、TGF-β1及VEGF含量的差异有统计学意义(P<0.05)。
表 1 各组大鼠 MMP-2、FN、TGF-β1 及 VEGF 含量比较(±s)
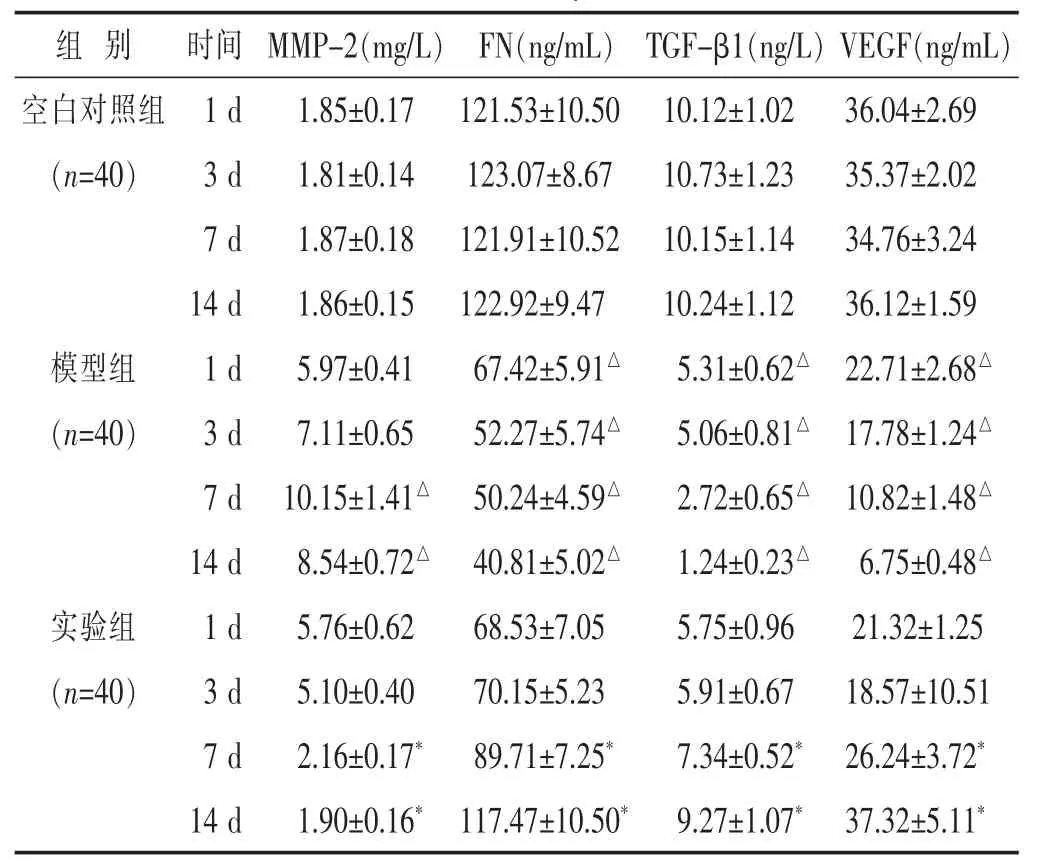
表 1 各组大鼠 MMP-2、FN、TGF-β1 及 VEGF 含量比较(±s)
与模型组同期比较,*P<0.05;与空白对照组同期比较,△P<0.05。
组 别 时间空白对照组 1 d(n=40) 3 d 7 d MMP-2(mg/L) FN(ng/mL) TGF-β1(ng/L)VEGF(ng/mL)1.85±0.17 121.53±10.50 10.12±1.02 36.04±2.69 1.81±0.14 123.07±8.67 10.73±1.23 35.37±2.02 1.87±0.18 121.91±10.52 10.15±1.14 34.76±3.24 14 d 1.86±0.15 122.92±9.47 10.24±1.12 36.12±1.59模型组 1 d 5.97±0.41 67.42±5.91△ 5.31±0.62△ 22.71±2.68△(n=40) 3 d 7.11±0.65 52.27±5.74△ 5.06±0.81△ 17.78±1.24△7 d 10.15±1.41△ 50.24±4.59△ 2.72±0.65△ 10.82±1.48△14 d 8.54±0.72△ 40.81±5.02△ 1.24±0.23△ 6.75±0.48△实验组 1 d 5.76±0.62 68.53±7.05 5.75±0.96 21.32±1.25(n=40) 3 d 5.10±0.40 70.15±5.23 5.91±0.67 18.57±10.51 7 d 2.16±0.17* 89.71±7.25* 7.34±0.52* 26.24±3.72*14 d 1.90±0.16* 117.47±10.50* 9.27±1.07* 37.32±5.11*
2.2 各组组大鼠PU治疗效果比较 见表2。模型组大鼠PU显效和愈合时间延长、愈合率低、愈合速度缓慢。与模型组比,实验组大鼠PU显效和愈合时间较模型组明显缩短、愈合速度较模型组明显增快、创面愈合率明显高于模型组(P<0.05)。
表2 两组大鼠PU显效、愈合时间及愈合速度、愈合率比较(±s)

表2 两组大鼠PU显效、愈合时间及愈合速度、愈合率比较(±s)
与模型组比较,△P<0.05。
组 别 愈合速度(mm/d)创面愈合率(%)模型组 0.09±0.04 35.48±4.17实验组 0.31±0.08△ 87.54±1.57△n 40 40愈合时间(d) 显效时间(d)12.73±2.91 9.25±1.54 9.36±2.53△ 6.98±1.26△
3 讨 论
FN主要由纤维母细胞和血管上皮细胞产生,是一种能维持表皮细胞完整性及防御功能的胶原蛋白。FN广泛存在于基膜与相邻细胞间、细胞表面及结缔组织中,其与胶原纤维、纤维蛋白原结合后形成基层胶原纤维-纤维蛋白复合物,这种复合物可促进压疮创缘上皮细胞增殖并提高防御功能,因此,FN在创面修复愈合过程中起重要作用[8]。TGF-β1促进胶原蛋白合成,并可诱导成纤维细胞增殖,在创面高浓度的TGF-β1会促进胶原蛋白沉积及表皮纤维化的形成,因此,在组织损伤修复过程中,TGF-β1短暂的增加有利于损伤组织的修复。当组织损伤时TGF-β1被激活而释放出来发挥生物学效应,通过抑制蛋白酶和基质酶的活性,促进胞外基质沉积,促进前胶原蛋白I及纤维素结合素合成,从而增加膜受体、细胞与基质间的相互作用,驱使炎性因子向损伤部位移动,进而诱导新生肉芽组织生成,加速组织的修复[9]。MMP-2 属明胶酶,是 MMP家族中重要组成成员,MMP-2在细胞基质降解中发挥重要作用,大量存在MMP-2会降解纤维蛋白及细胞基质,加重破损及炎症组织上炎性细胞浸润浸润,造成压疮愈合减缓[10]。
正常表皮组织上仅有少量MMP-2表达,而TGF-β1、FN和VEGF相对较多,这在空白对照组中检测结果得以证实,而在PU形成后,MMP-2会大量分泌,这可能是炎症刺激造成的,MMP-2表达增多又会进一步加剧炎症反应,造成PU表皮形成溃疡,模型组在治疗3、7、14 d 时,MMP-2 升高,FN、TGF-β1 及 VEGF 均降低,且在7 d时MMP-2含量升高达峰值,在第14日时FN、TGF-β1及VEGF含量降低达高峰,与空白对照组同期比较差异显著,提示在PU的病理进程中,MMP-2、FN、TGF-β1及VEGF等均参与其中,提示PU本身会促进MMP-2分泌,抑制FN、TGF-β1及VEGF分泌,并且形成这种恶性循环,这应是PU形成后经久不愈的病理基础。
在本实验中,实验组PU溃疡皮肤经涂敷玫及乳膏治疗,在第7日时MMP-2含量降低达低峰值,在第14日时FN、TGF-β1及VEGF含量最高且达高峰值,显效和愈合时间均较模型组缩短,愈合速度和愈合率均较模型组提高,提示玫及乳膏治疗大鼠Ⅲ期压疮效果显著。实验用玫及乳膏主要配方中有中药丹参、当归、黄连、白及、黄芪,油性物质有乳化硅油、霍霍巴油、甘油及辅料十二烷基硫酸钠、氮酮、碳酸二辛酯、羟苯乙酯等,具有消肿排脓、养血排毒、生肌敛疮、祛腐生肌等功效,临床用于治疗PU[11]。实验组在使用玫及乳膏后,可能首先抑制MMP-2分泌,使PU溃疡面纤维蛋白增多,抑制创面纤连蛋白及细胞基质的降解,这可减轻其对创面完整性的破坏,有利于创面愈合。实验组在第14日时FN、TGF-β1及VEGF含量最高且达峰值,提示玫及乳膏吸收后还能促进FN、TGF-β1及VEGF合成及分泌。VEGF及TGF-β1能促进血管内皮及成纤维细胞生长,FN可促进PU创缘上皮细胞增殖,在其共同作用下加速PU局部创面微血管及肉芽组织新生,加速PU修复[12-14]。另外,玫及乳膏中的辅料如油性物质乳化硅油、霍霍巴油、甘油及辅料十二烷基硫酸钠、氮酮、碳酸二辛酯、羟苯乙酯等也具有保湿作用,促使表皮坏死组织软化、溶解,还可吸收创面渗液、促进肉芽组织生长的作用,符合PU“湿性愈合”的理论[15]。
综上所述,玫及乳膏可能通过抑制MMP-2合成来降低创面细胞基质及纤连蛋白的降解,增加FN、TGF-β1及VEGF的表达,进而促进间质细胞的增殖和细胞外基质的合成,促进PU溃疡面血管内皮及肉芽组织新生、改善PU溃疡面微循环、提高创面愈合率和愈合速度,从而加速压疮溃疡面组织修复。
[1]李小萍.基础护理学[M].北京:人民卫生出版社,2008:111-112.
[2]兰园淞,高文,廖海涛,等.超氧化物歧化酶、丙二醛和内皮素在大鼠压疮模型损伤中的表达及作用[J].护理学报,2017,24(9):1-6.
[3]Martins VL,Caley M,O’Toole EA,et al.Matrix metal lproteinases and epidermal wound repairf[J].Cell Tissue Res,2013,351(2):255-268.
[4]肖洪玲,龙子江,施慧,等.压疮灵对大鼠压疮模型局部SOD、MDA、VEGF 和 EGF 表达的影响[J].中药药理与临床,2016,10(1):137-140.
[5]Song RH,Kecharyan HK,Fortunato JE,et al.Increased flow and shear stress enhan-ce in vivo transforming growth factorbetal after experimental arterial injury[J].Arteriose-her Thromb Vasc Biol,2000,20(4):923-930.
[6]崔飞飞,潘莹莹,代彦丽,等.内质网应激相关蛋白及其介导的细胞凋亡在大鼠难免性压疮形成中的作用 [J].中华烧伤杂志,2013,22(5):448-453.
[7]RussellR R,Alan CS,Jon EM,et al.Anovel murinemodel of cyclical cutaneousischem iareperfuson injury[J].JSurg Res,2004,116:172-180.
[8]王俊杰,王洋,沈伟烨,等.“瑰及”乳膏联合重组牛碱性成纤维细胞生长因子防治常见物理性皮肤病的应用研究[J].中国药物与临床,2015,15(5):662-663.
[9]王国辉,崔云甫.TGF-β1在胆管损伤修复过程中的作用[J].中国现代普通外科进展,2010,13(5):376-379.
[10]Rodrtguez D,Morrison CJ,Overal1 CM,et al.Matrix meta 11 oproteinases:what do they not do New substrates and biological roles identified by murine models and proteomies [J].Biochim B iophys Acta,2010,1803(1):39-54.
[11]马俐,滕敬华,程红霞,等.瑰及乳膏联合TDP预防及治疗Ⅰ~Ⅱ期压疮的疗效[J].现代中西医结合杂志,2014,22(30):3411-3412.
[12]Davies AL,Hayes KC,Dekaban GA,et al.Clinical correlates of elevated selxlm concentrations of cytokines and autoantibodies in patients with spinal cord injury [J].Acrh Phys Med Rehabil,2007,88(11):l384-1393.
[13]马俐,滕敬华,程红霞,等.瑰及乳膏治疗压疮的疗效观察[J].检验医学与临床,2014,12(1):70-71.
[14]黄芳,杨晶金,王雪玲,等.VEGF和bFGF在大鼠PU模型中的表达及其意义[J].中国病理生理杂志,2012,28(8):1504-1506.
[15]陈琳,宁宁,陈慧,等.皮肤创伤湿性愈合治疗的临床效果观察[J].华西医学,2015,30(10):1810-1813.

