虎杖转录因子PcMYB1基因的克隆及原核表达
柳忠玉,雷 健,李晓筱,刘 婵,覃建兵,许 锋
(1.长江大学生命科学学院,湖北荆州434025;2.长江大学园艺园林学院,湖北荆州434025)
苯丙烷类物质在植物中普遍存在,这类次生代谢产物以羟基芳香环为共同特征,包括总黄酮、黄酮醇、香豆素、木质素、花青素、单宁以及白藜芦醇等。近年来,通过对拟南芥、玉米、金鱼草和矮牵牛等植物的研究,发现了一系列髓细胞组织增生病毒癌基因同源物(MYB)转录因子作为调节蛋白广泛参与植物苯丙烷类次生代谢的调控[1]。MYB也参与调控药用植物药效成分合成,丹参SmMYB39通过调控苯丙烷类代谢途径关键酶基因的表达,进而影响迷迭香酸的合成[2]。水母雪莲中bHLH和WD40两种转录因子形成二元复合体后,和MYB转录因子共同调控类黄酮合成途径中结构基因的表达[3]。苦荞种子萌发过程中子叶中黄酮的积累受FtMyb2与FtMyb3的调控[4]。在紫外线、伤害和病原菌等胁迫条件下,葡萄VvMYB14和VvMYB15调控白藜芦醇合酶基因的表达,进而影响白藜芦醇的合成[5-6]。
虎杖(Polygonum cuspidatum Sieb.et Zucc.)是蓼科多年生草本植物,根或根茎入药,富含白藜芦醇、类黄酮等药效成分。其中白藜芦醇具有显著抗肿瘤、抗衰老、保护心血管系统等生物学功能[7]。虎杖富含的白藜芦醇、类黄酮等都经由苯丙烷类代谢途径而来。目前,对虎杖苯丙烷类代谢的研究多集中在结构基因上,例如查尔酮合酶基因PcCHS[8]、聚酮合成酶基因PcPKS[9-10]等。前期已经对虎杖苯丙烷代谢途径中的结构基因白藜芦醇合酶基因PcRS进行了功能鉴定[11-12]。而有关MYB转录因子对虎杖苯丙烷类代谢的调控作用知之甚少。鉴于此,从虎杖叶片中克隆苯丙烷类代谢相关的MYB转录因子基因,对其进行生物信息学分析,构建MYB基因的原核表达载体并诱导表达,为研究MYB对虎杖苯丙烷类代谢的调控奠定基础。
1 材料和方法
1.1 材料
虎杖植株由广州中医药大学中药资源科学与工程研究中心提供。引物由上海生工生物工程技术服务有限公司合成。限制性内切酶、Taq DNA聚合酶、pMD18-T载体购自TaRaKa公司。总RNA提取试剂盒、cDNA第1链合成试剂盒和凝胶回收试剂盒购自Tiangen公司。SMARTerTMRACE cDNA Amplification Kit购自Clontech公司。
1.2 方法
1.2.1 虎杖叶片总RNA的提取及反转录 以野生虎杖叶片为材料,用Trizol法提取总RNA,用cDNA第1链合成试剂盒将总RNA反转录成cDNA备用,严格按照试剂盒说明书进行操作。
1.2.2 MYB基因保守区域片段的获得 对已经公布的苯丙烷类代谢相关的R2R3-MYB转录因子的核酸序列和氨基酸序列进行分析,在保守区域设计简并引物MYBf和MYBr(表1)。以虎杖叶片cDNA为模板进行RT-PCR,PCR反应条件为:94℃预变性2 min;94℃变性30 s,57℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测。将PCR产物进行回收并连接至pMD18-T载体上,转化大肠杆菌DH5α进行克隆,挑取单菌落进行菌液PCR检测,将阳性菌落送至上海生工生物公司进行测序。

表1 PcMYB1基因引物序列
1.2.3 cDNA末端扩增 3'RACE 和 5'RACE第1链的合成按照Clontech公司试剂盒使用说明进行。根据测序结果设计3'RACE和5'RACE引物(引物序列见表1),进行PCR扩增。回收扩增产物并连接至pMD18-T载体,转化大肠杆菌DH5α,筛选阳性克隆并测序。
1.2.4 PcMYB1全长cDNA拼接及生物信息学分析将获得的MYB保守区域片段和两端序列进行拼接,获得PcMYB1基因的cDNA全长序列。将PcMYB1序列在NCBI数据库中用BLAST工具进行同源分析;利用ORF(Open reading frame)finder软件寻找开放阅读框;利用Protparam软件分析编码蛋白的氨基酸序列组成、分子质量、等电点等理化性质;采用SWISS-MODELSOPMA进行蛋白质二级结构分析。利用软件DNAMAN进行多重序列比对;利用软件ClustalX 2.1和MEGA 5构建系统进化树。用作同源性和进化树分析的序列均来源于GenBank,具体情况列于表2。
1.2.5 PcMYB1基因原核表达载体的构建 根据原核表达载体pET28a和PcMYB1基因cDNA序列信息,设计1对特异引物ORFf和ORFr扩增该基因ORF。PCR扩增条件为:94℃预变性2 min;94℃变性 30 s、59℃退火 30 s、72℃延伸1 min,30个循环;72℃延伸10 min。反应结束后,将PCR产物经1%琼脂糖凝胶电泳鉴定并回收。用BamHⅠ和HindⅢ分别酶切 PCR回收产物和原核表达载体pET28a,用T4 DNA连接酶连接回收纯化的目的片段和切开的载体,并转化大肠杆菌DH5α,经BamHⅠ和HindⅢ双酶切以及测序鉴定后获得的阳性克隆即为重组原核表达载体,并命名为 pET28a-Pc-MYB1。

表2 多重序列比较和进化分析所用MYB蛋白
1.2.6 重组菌 pET28a-PcMYB1/BL21(DE3)诱导表达 将测序正确的重组质粒pET28a-PcMYB1转化至表达菌株E.coli BL21(DE3),得到重组菌pET28a-PcMYB1/BL21(DE3)。挑取单菌落接种于含卡那霉素(50 μg/mL)的LB培养基内,37℃振荡过夜培养。次日以1%量接种于含有相应抗生素的LB培养基,37℃培养至OD600约为 0.5时,吸出1 mL菌液作对照,其余加入IPTG(终浓度为 0.5 mmol/L),诱导3 h后,收集1 mL菌液,将收集的菌液于4℃、12 000 r/min离心5 min,弃上清,向沉淀中加入200 μL PBS缓冲液,充分混匀后加入50 μL 5×SDS上样缓冲液,100℃煮沸10 min,4℃冷却。取15 μL样品上样,12%SDS-PAGE电泳检测。电泳结束后,考马斯亮蓝染色,最后成像分析。
2 结果与分析
2.1 虎杖PcMYB1基因cDNA全长的获得及序列分析
提取虎杖叶片总RNA用于RT-PCR,利用简并引物MYBf和MYBr,以cDNA为模板扩增MYB基因保守区域,挑选阳性克隆测序得到1个长336 bp的保守区域片段(图1-A)。设计特异引物3'GSP1和3'GSP2,参照试剂盒说明进行3'RACE,扩增得到1个长1 056 bp的带有多聚A尾巴的片段(图1-B)。设计特异引物5'GSP1和5'GSP2,参照试剂盒说明进行5'RACE,扩增得到1个长398 bp的片段(图1-C)。将获得的两端序列与保守区域片段序列进行拼接得到1段长1 152 bp的cDNA序列,命名该基因为 PcMYB1(GenBank登录号为KY495789)。
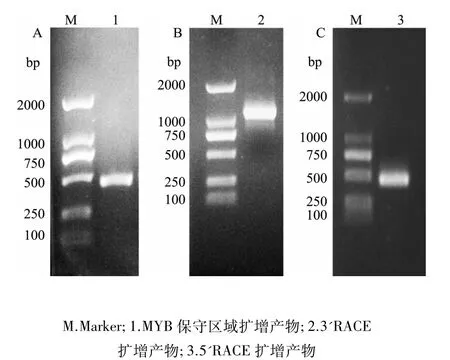
图1 PcMYB1基因的PCR扩增结果
序列分析表明,PcMYB1基因的5'端有长度为190 bp的非编码区,3'端有长度为149 bp的非编码区,开放阅读框ORF由813个核苷酸组成,编码1个含有270个氨基酸的蛋白质,起始密码子为ATG,终止密码子为TGA(图2)。利用ExPASy软件的Protparam预测PcMYB1编码蛋白的理化性质,推测该蛋白质分子式为C1325H2095N395O403S14,总原子数为4 232,分子质量为 30.455 ku,理论等电点(pI)为8.6。采用 SWISS-MODELSOPMA 进行PcMYB1编码蛋白的二级结构分析,PcMYB1编码蛋白的二级结构中α-螺旋占24.07%、延伸链占13.70%、β 转角占 6.67%、无规则卷曲占 55.56%。
2.2 虎杖PcMYB1蛋白的同源性分析及进化树构建
为研究PcMYB1蛋白与其他MYB蛋白的进化关系,选取拟南芥次生代谢调控相关的MYB亚家族(Sg3、Sg4、Sg5、Sg6、Sg7)蛋白以及来源于其他植物的典型Sg4亚家族成员,构建进化树。结果显示,PcMYB1和葡萄的VvMYB4a、桉树的EgMYB1、矮牵牛的 PhMYB4、玉米的 ZmMYB31、柳枝稷的PvMYB4a、拟南芥的AtMYB4和AtMYB32等转录因子聚类到Sg4亚家族(图3),说明PcMYB1蛋白是Sg4亚家族MYB蛋白。利用BLAST进行同源性分析,结果表明,虎杖 PcMYB1与矮牵牛 PhMYB4(ADX33331)、葡萄 VvMYB4a(ABL61515)、桉树EgMYB1(CAE09058)、拟南芥 AtMYB4(AAC83582)、玉米 ZmMYB31(NP_001105949)、柳枝稷 PvMYB4a(AEM17348)、拟南芥 AtMYB32(NP_195225)有着较高的同源性,分别为67%、64%、63%、59%、58%、58%、56%。

图2 PcMYB1基因的核苷酸序列和推测的氨基酸序列
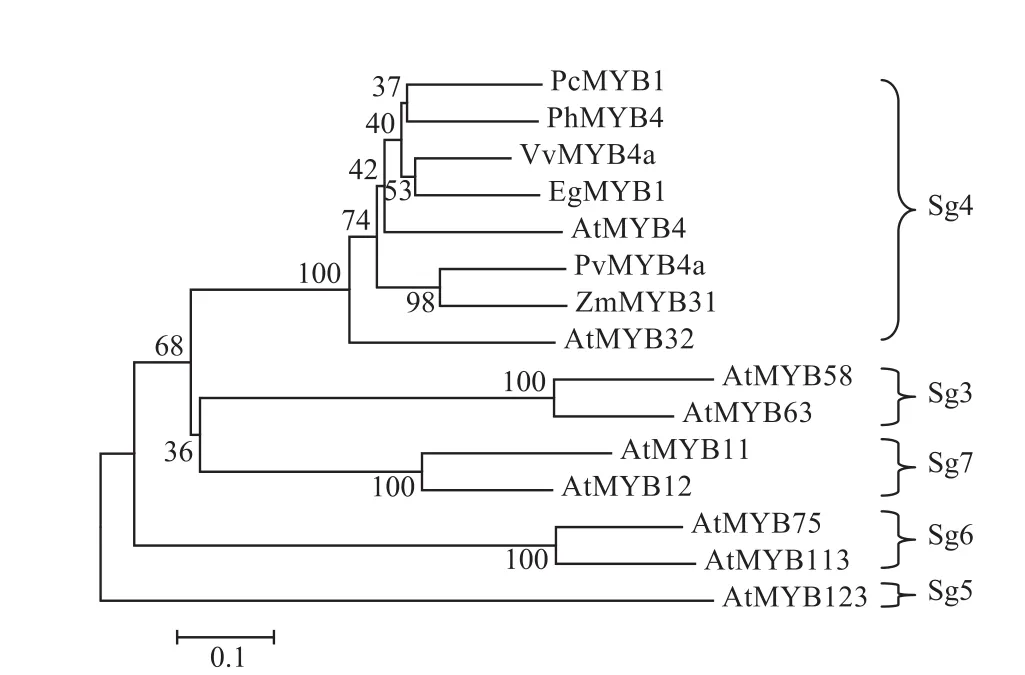
图3 PcMYB1与其他物种MYB氨基酸序列的系统进化树分析
利用DNAMAN软件进行多重序列比对发现,虎杖PcMYB1蛋白与其他MYB转录因子的保守区域主要集中在N端,虎杖PcMYB1蛋白在N端具有2个典型的MYB DNA结合域,即R2、R3结构域,为典型的R2R3-MYB转录因子(图4)。结果表明,PcMYB1蛋白符合R2R3-MYB类转录因子的特征。在PcMYB1蛋白的C端区域具有4个典型的Sg4亚家族的保守基序(图4):C1基序LLsrGIDPX[T/S]HRX[I/L],C2基序pdLNL[D/E]LXI[G/S],C3 基序CX1-2CX7-12CX1-2C,C4 基序 FLGLX4-7L[D/G][F/Y][R/S]XLEMK,其中 C2基序 pdLNL[D/E]LXI[G/S]为典型的抑制结构域。
2.3 原核表达载体pET28a-PcMYB1的构建
将PcMYB1基因的ORF区域(813 bp)构建到载体 pET28a中,获得原核表达载体 pET28a-PcMYB1。对原核表达载体pET28a-PcMYB1进行菌液PCR鉴定,获得1条800 bp左右特异性片段(图5-A)。将原核表达载体pET28a-PcMYB1用BamHⅠ和HindⅢ酶切,切出大小约800 bp的片段,该片段为PcMYB1基因的ORF片段,如图5-B箭头所示。同时测序结果表明,连入表达载体pET28a中的PcMYB1基因片段与目的序列一致,未出现碱基突变和移码现象。将pET28a-PcMYB1质粒转化大肠杆菌感受态BL21(DE3)后,得到重组菌pET28a-PcMYB1/BL21(DE3)。
2.4 重组菌 pET28a-PcMYB1/BL21(DE3)的诱导表达
PcMYB1基因的ORF由270个氨基酸组成,理论蛋白分子质量为30.455 ku,融合His-Tag标签后理论分子质量为31.28 ku。由12%SDS-PAGE电泳结果可知(图6),与未诱导的重组菌pET28a-Pc-MYB1/BL21(DE3)相比,IPTG诱导的重组菌在31 ku左右处出现特异条带,特异条带的大小与理论值相符。结果表明,重组菌 pET28a-PcMYB1/BL21(DE3)已成功表达目的蛋白PcMYB1(如图6箭头所示)。
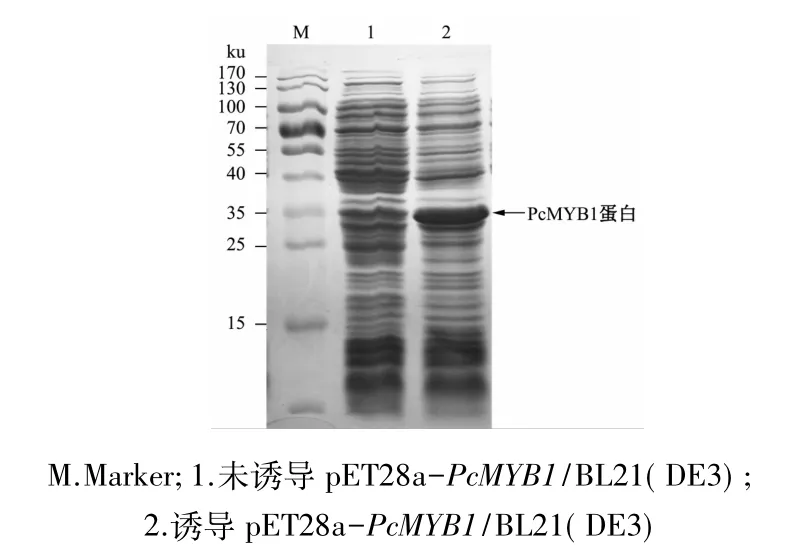
图6 pET28a-PcMYB1/BL21(DE3)诱导产物的SDS-PAGE电泳分析
3 结论与讨论
植物MYB转录因子结构域的N端区域都是高度保守的,该结构域由1~3个串联的且不完全重复的R结构(R1、R2、R3)组成,而且绝大多数植物中的MYB类转录因子是含2个MYB结构域的R2R3-MYB蛋白[13-14]。对于基因组大、尚未完成基因组测序的物种,采用同源克隆的方法研究重要功能基因是一种可行的方法。本研究基于同源克隆的策略,从虎杖叶片成功克隆1个R2R3-MYB同源基因,命名为PcMYB1,以便研究PcMYB1基因的功能及其对虎杖苯丙烷代谢的调控作用。
根据C端功能基序的不同,MYB转录因子被分成了 28个亚家族[1,15]。进化树分析发现,虎杖PcMYB1蛋白和 Sg4亚家族的 AtMYB4、AtMYB32、VvMYB4a、EgMYB1、PhMYB4、ZmMYB31、PvMYB4a等聚为一类,说明PcMYB1编码蛋白属于Sg4亚家族。来自Sg4亚家族的AtMYB4是拟南芥中发现的第1个R2R3类负调控因子,该因子通过靶向抑制类黄酮物质芥子酸酯合成关键基因C4H来负调节植物对UV-B的耐受性[16]。AtMYB4蛋白的 C末端有1个抑制结构域 C2 基序 pdLNL[D/E]LXI[G/S],AtMYB4蛋白可能通过直接与靶基因结合而抑制靶基因的转录,或同时作为其他激活因子的竞争者来抑制靶基因的表达。C2基序 pdLNL[D/E]LXI[G/S]也存在于Sg4亚家族的其他负调控因子(AtMYB32、VvMYB4a、EgMYB1、PhMYB4、ZmMYB31、PvMYB4a等 ) 中。 其 中 AtMYB32[17]、EgMYB1[18-19]、Zm-MYB31[20]、PvMYB4a[21]被鉴定为在木质素生物合成中起转录抑制作用。矮牵牛PhMYB4通过负调控查尔酮合酶基因PhCHS的表达,进而影响类黄酮的合成[22]。葡萄VvMYB4a也被证实在其介导的相关植物生长发育过程中起负调节作用[23]。Xu等[24]在裸子植物银杏中也发现类似于AtMYB4的转录抑制子GbMYBF2,其在拟南芥中的过表达能显著抑制花青素及黄酮类物质的生成。由此可见,众多研究已表明,含有抑制结构域C2基序pdLNL[D/E]LXI[G/S]的MYB转录因子在苯丙烷类(木质素、黄酮、花青素等)合成中起转录抑制作用。本研究得到的虎杖PcMYB1蛋白同样具有抑制结构域C2基序 pdLNL[D/E]LXI[G/S],因此,推测PcMYB1蛋白是一个负调控因子,但其表达特性与调控模式,还需要进一步转化模式植物加以验证。
MYB转录因子可以与多种顺式作用元件结合,调控下游基因的表达。目前,多采用体外凝胶迁移(EMSA)来鉴定蛋白质与元件的作用情况[25]。本研究已经构建含有PcMYB1基因的重组质粒并且在大肠杆菌中成功表达目标蛋白。后续将纯化该蛋白,用于EMSA鉴定PcMYB1蛋白与元件的作用情况,有利于进一步研究虎杖转录因子PcMYB1蛋白的分子生物学功能。目前,对虎杖苯丙烷类代谢中MYB转录因子的功能知之甚少,本研究的开展为虎杖苯丙烷类代谢的深入理解奠定基础。
本研究从虎杖叶片中成功克隆了1个R2R3-MYB类转录因子PcMYB1基因,PcMYB1基因含有长为813 bp的开放读码框,编码270个氨基酸残基。虎杖PcMYB1属于Sg4亚家族,序列的C端存在1个抑制结构域 C2基序 pdLNL[D/E]LXI[G/S]。虎杖PcMYB1与已知的矮牵牛PhMYB4序列相似性最高。构建了PcMYB1的原核表达载体pET28a-Pc-MYB1,并在大肠杆菌表达菌株BL21中成功表达。
[1] Liu J,Osbourn A,Ma P.MYB transcription factors as reg-ulators of phenylpropanoid metabolism in plants[J].Mol Plant,2015,8(5):689-708.
[2] Li C,Lu S.Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks in Salvia miltiorrhiza[J].BMC Genomics,2014,15(4):277-289.
[3] 王亚杰,李厚华,付婉艺,等.水母雪莲红色细胞系类黄酮含量和相关基因表达[J].生物工程学报,2014,30(8):1225-1234.
[4] 赵海霞,吴小峰,吴琦,等.苦荞芽期黄酮合成关键酶和MYB转录因子基因的表达分析[J].农业生物技术学报,2012,20(2):121-128.
[6] Fang L,Hou Y,Wang L,et al.Myb14,a direct activator of STS,is associated with resveratrol content variation in berry skin in two grape cultivars[J].Plant Cell Rep,2014,33(10):1629-1640.
[7] Cho S,Namkoong K,Shin M,et al.Cardiovascular protective effects and clinical applications of resveratrol[J].J Med Food,2017,20(4):323-334.
[8] Shen Y,Li X,Chai T,et al.Outer-sphere residues influence the catalytic activity of a chalcone synthase from Polygonum cuspidatum[J].FEBS Open Bio,2016,6(6):610-618.
[9] Ma L Q,Guo Y W,Gao D Y,et al.Identification of a Polygonum cuspidatum three-intron gene encoding a typeⅢpolyketide synthase producing both naringenin and phydroxybenzalacetone[J].Planta,2009,229(5):1077-1086.
[10] Ma L Q,Pang X B,Shen H Y,et al.A novel type Ⅲpolyketide synthase encoded by a three-intron gene from Polygonum cuspidatum[J].Planta,2009,229(3):457-469.
[11] Liu Z Y,Zhuang C X,Sheng S J,et al.Overexpression of a resveratrol synthase gene(PcRS)from Polygonum cuspidatum in transgenic Arabidopsis causes the accumulation of trans-piceid with antifungal activity[J].Plant Cell Rep,2011,30(11):2027-2036.
[12] 柳忠玉,赵树进.转PcRS基因拟南芥的抗炭疽病研究[J].生物技术通报,2014,32(10):107-112.
[13] BaldoniE,GengaA,CominelliE.PlantMYB transcription tactors:Their role in drought response mechanisms[J].IntJMolSci,2015,16(7):15811-15851.
[14] Pattanaik S,Patra B,Singh S K,et al.An overview of the gene regulatory network controlling trichome development in the model plant,Arabidopsis[J].Front Plant Sci,2014,5(6):259-266.
[15] Shelton D,Stranne M,Mikkelsen L,et al.Transcription factors of Lotus:Regulation of isoflavonoid biosynthesis requirescoordinated changesin transcription factor activity[J].Plant Physiol,2012,159(2):531-547.
[16] Jin H,Cominelli E,Bailey P,et al.Transcriptional repression by AtMYB4 controls production of UV-protecting sunscreens in Arabidopsis[J].The Embo Journal,2000,19(22):6150-6161.
[17] Preston J,Wheeler J,Heazlewood J,et al.AtMYB32 is required for normal pollen development in Arabidopsis thaliana[J].Plant J,2004,40(6):979-995.
[18] Legay S,Lacombe E,Goicoechea M,et al.Molecular characterization of EgMYB1,a putative transcriptional repressor of the lignin biosynthetic pathway[J].Plant Sci,2007,173(5):542-549.
[19] Legay S,Sivadon P,Blervacq A S,et al.EgMYB1,an R2R3 MYB transcription factor from eucalyptus negatively regulates secondary cell wall formation in Arabidopsis and poplar[J].New Phytol,2010,188(3):774-786.
[20] Fornale S,Shi X H,Chai C L,et al.ZmMYB31 directly represses maize lignin genes and redirects the phenylpropanoid metabolic flux[J].Plant J,2010,64(4):633-644.
[21] Shen H,He X,Poovaiah C R,et al.Functional characterization of the switchgrass(Panicum virgatum)R2R3-MYB transcription factor PvMYB4 for improvement of lignocellulosic feedstocks[J].New Phytol,2012,193(1):121-136.
[22] Colquhoun T A,Kim J Y,Wedde A E,et al.PhMYB4 fine-tunes the floral volatile signature of Petunia×hybrida through PhC4H[J].J Exp Bot,2011,62(3):1133-1143.
[23] Cavallini E,Matus J T,Finezzo L,et al.The phenylpropanoid pathway is controlled at different branches by a set of R2R3-MYB C2 repressors in grapevine[J].Plant Physiol,2015,167(4):1448-1470.
[24] Xu F,Ning Y,Zhang W,et al.An R2R3-MYB transcription factorasa negative regulatorofthe flavonoid biosynthesis pathway in Ginkgo biloba[J].Functional Integrative Genomics,2014,14(1):177-189.
[25] Vuzman D,Levy Y.Intrinsically disordered regions as affinity tunersin protein-DNA interactions[J].Mol Biosyst,2012,8(1):47-57.

