西葫芦胚囊再生植株快速繁殖及倍性鉴定
宋金亮,朱 磊,贾聖风,武向斌,张凯歌,孙守如
(河南农业大学 园艺学院,河南郑州450002)
西葫芦(Cucurbita pepo L.),别名美洲南瓜,为葫芦科南瓜属1年生蔓生草本植物,具有较高的营养价值和保健功能,且产量高、耐储运。西葫芦作为我国普遍栽培的一种瓜类蔬菜,种植面积在逐年增加,保护地栽培面积仅次于黄瓜,但其育种研究相对于其他葫芦科瓜类较为滞后,新品种更新较慢。常规育种在一定程度上限制了杂交一代的选育速度,而离体雌核培养产生的单倍体通过自然或人工加倍可快速获得双单倍体纯系,以便配置杂交组合,进而加快育种进程[1-2]。近年来,关于西葫芦未受精胚珠或未授粉子房离体培养的报道较多,离体雌核培养技术也取得了一定的进展[3-6]。尽管多数研究经胚状体或愈伤组织途径获得了胚囊植株,但再生植株诱导率低,倍性鉴定体系不完善的问题依然存在[7]。利用茎尖与腋芽离体培养可以对稀缺材料进行长期保存与快速繁殖,同时避免优良性状的分离与丢失[8]。茎尖快繁技术在马铃薯[9]、山药[10]、草莓[11]等作物的育种中应用广泛。开展西葫芦离体雌核再生植株快繁技术的研究对保持植株优良性状、胚囊植株倍性育种及进行后代遗传分析都有重要意义[12]。因此,以西葫芦胚囊植株茎尖为外植体,系统研究了不同种类及其不同质量浓度的植物生长调节剂组合对再生胚囊植株茎尖增殖及再生腋芽生根的影响,比较了茎尖、根尖以及卷须3种部位的组织利用染色体计数法进行倍性鉴定的差异,并对西葫芦气孔密度及保卫细胞叶绿体数与倍性的关系进行探索,旨在建立一种高效可行的西葫芦胚囊植株茎尖快速繁殖方法,并为西葫芦倍性鉴定的研究提供理论依据。
1 材料和方法
1.1 材料与培养条件
以西葫芦品种ZY10号为试材,该品种生长力旺盛,产量高,且具有较强的低温弱光耐受性[13]。8月初穴盘育苗,待幼苗长到三叶一心(苗龄15 d左右)定植于河南农业大学毛庄科教园区温室内。于花期即从第三雌花开始采样,开花前1 d 18:00左右采摘未授粉子房,以 MS+0.06 mg/L TDZ+0.5 mg/L 6-BA为培养基进行胚状体诱导,然后将诱导胚状体转移到基础MS培养基中培养并获得再生胚囊植株。试验均以MS培养基为基础培养基,根据试验要求添加植物生长调节剂,琼脂7 g/L、蔗糖30 g/L,pH值为5.8,培养温度为25℃,光照强度为2 500~3 000 lx,光照周期为 14 h/10 h。
1.2 试验方法
1.2.1 增殖培养 将再生胚囊植株茎尖接种到增殖培养基上。增殖培养基以MS培养基为基础,设置添加不同质量浓度的 6-BA(0.25、0.50、1.00 mg/L)和NAA(0.50 mg/L),筛选出茎尖增殖的最适培养基。每处理接种16个外植体,重复3次,接种30 d后统计芽苗增殖情况。增殖倍数=增殖芽总数/接种外植体数,增殖率=增殖的外植体数/接种外植体数×100%。
1.2.2 生根培养 当腋芽长到2~3 cm时,由基部切断后转入生根培养基中。生根培养基以MS培养基为基础,设置添加不同质量浓度的 NAA(0.1、0.25、0.50 mg/L)和 IBA(0.1、0.5 mg/L),筛选出最适生根培养基。每处理接种10个再生腋芽,重复3次,10 d后开始记录生根情况,接种20 d后统计生根率。生根率=生根外植体数/接种外植体数×100%。
1.2.3 倍性鉴定方法
1.2.3.1 染色体计数法 以西葫芦茎尖(植株生长点)、根尖及卷须为材料,参考王舰等[14]的方法并稍作改进。具体步骤如下:9:00左右,分别取茎尖、根尖、卷须1~2 cm,放入0.1%秋水仙素水溶液预处理3 h,用改良的卡诺氏固定液固定24 h,将固定后的材料经95%乙醇和85%乙醇各浸泡30 min,用蒸馏水漂洗3~4次,每次2 min,用60℃ 1 mol/L HCl溶液解离10 min,解离后用蒸馏水冲洗3 min并用滤纸吸干,用改良苯酚品红染色液染色20 min,切取分生区部分,用镊子将材料捣碎,滴1滴45%的冰醋酸,盖上盖玻片,用橡皮轻轻敲击使根尖分散,在400倍显微镜下进行染色体数目的观察并计数。
1.2.3.2 气孔保卫细胞叶绿体计数法 参照张菊平等[15]的方法并稍作改进。具体步骤如下:用刀片轻轻在叶下表皮的叶脉上划一个裂口,用镊子从裂缝处撕取下表皮置于载玻片上,并将其展平,滴2滴1%碘-碘化钾(用蒸馏水稀释后效果更好),染色3 min,在100倍显微镜下,以视野内的面积(1.77 mm2)进行观察比较,每张叶片随机观察统计30个视野内的气孔数及叶绿体数,拍照。
1.3 数据处理
采用Excel 2007进行数据整理,运用SPSS 16.0对所得数据进行t检验和χ2适合性检测。
2 结果与分析
2.1 不同植物生长调节剂组合对西葫芦茎尖增殖的影响
将西葫芦胚囊植株茎尖接种到增殖培养基上,试验结果显示(表1、图1),培养14 d后可见萌发的腋芽,28 d后形成丛生不定芽。在基础MS培养基上,50%的苗芽能够诱导形成腋芽,芽苗增殖倍数为1.50。当添加0.50 mg/L的NAA时,茎尖不能得到有效的增殖,增殖倍数为0,芽苗基部形成大的愈伤块,植株生长势弱,其中有4株死亡。培养基中添加不同质量浓度的6-BA对腋芽的增殖率影响显著,当6-BA质量浓度为0.50 mg/L 时,75.0%的芽苗能增殖出腋芽,最多增殖出3个,平均每个芽苗可生成2.37个,其次是6-BA 为 0.25 mg/L 时,增值倍数为 1.88,当 6-BA 质量浓度为1.00 mg/L 时,增殖倍数较低,仅为 1.63,但高于基础MS培养基处理。结合增殖倍数及生长势,筛选出西葫芦胚囊植株茎尖增殖的最适培养基为MS+0.50 mg/L 6-BA。
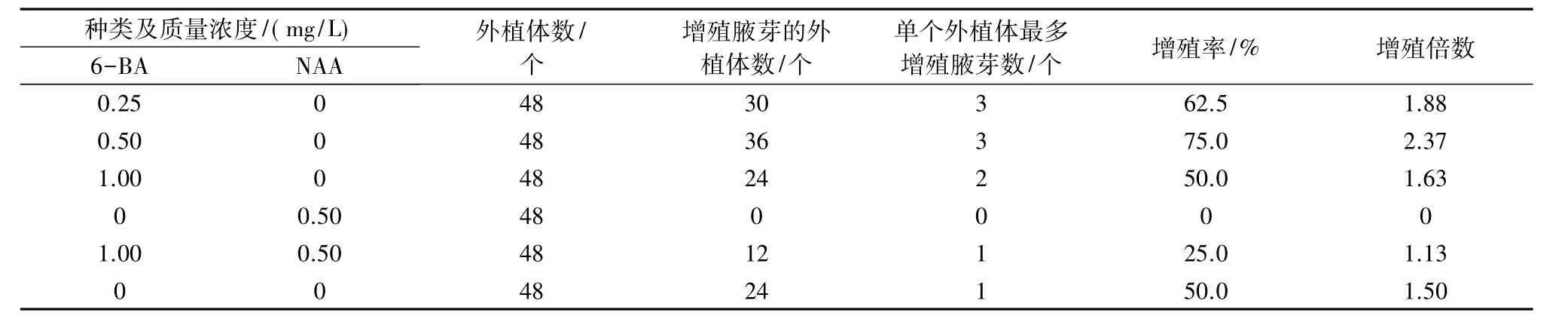
表1 不同植物生长调节剂质量浓度组合对西葫芦胚囊植株茎尖增殖的影响
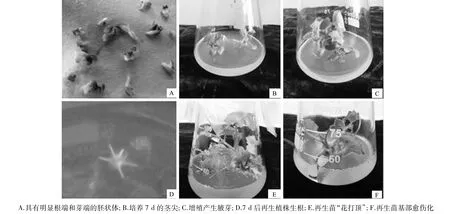
图1 西葫芦再生植株扩繁
2.2 不同植物生长调节剂质量浓度对西葫芦增殖腋芽生根的影响
将诱导增殖出的健壮不定腋芽接种到生根培养基上,结果表明(表2、图1),不同种类及质量浓度植物生长调节剂均能诱导西葫芦腋芽生根,使用NAA和IBA处理影响差异显著。培养基中添加0.50 mg/L的IBA时,基部愈伤化严重,生根率最低,仅为13.3%。在本试验中,NAA的诱导效果普遍较IBA好,其中以0.10 mg/L NAA处理的生根率最高,达 83.3%,其次为 0.25 mg/L NAA,生根率为50.0%。提高NAA质量浓度,生根率逐渐下降,生根变粗且根毛减少,基部愈伤增多,继代培养后移栽存活率降低,与前人在西瓜上报道的结果一致[16-17]。因此,MS+0.10 mg/L NAA 为西葫芦再生腋芽最适宜的生根培养基。

表2 不同植物生长调节剂对西葫芦增殖腋芽生根的影响
2.3 西葫芦不同组织进行染色体鉴定的差异
由图2、表3可知,在400倍显微镜下3种组织材料均可观察到染色体。用茎尖作为鉴定材料时,细胞密度大,但体积小,细胞内染色体重叠,严重影响倍性鉴定。根尖作为鉴定材料时,细胞密度大,体积也较大,大部分细胞重叠,细胞内染色体稍有重叠,染色体较清晰,基本可进行倍性鉴定。而卷须作为鉴定材料时,细胞大,分散,基本无重叠,细胞内染色体清晰。由此可知,西葫芦卷须可作为根尖染色体计数的替代材料。
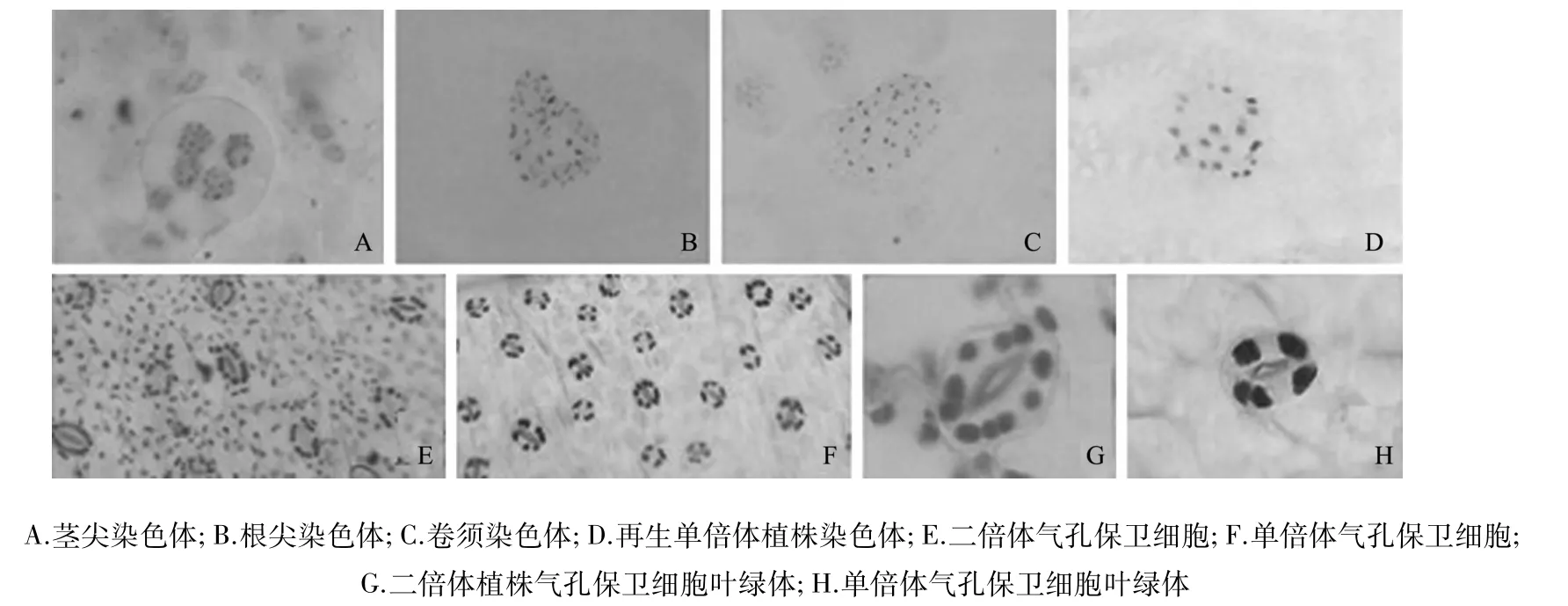
图2 西葫芦再生植株倍性鉴定

表3 西葫芦不同组织对染色体鉴定的影响
2.4 西葫芦气孔数及保卫细胞叶绿体数与倍性的相关性
对不同倍性西葫芦叶片气孔密度及保卫细胞叶绿体数进行比较可知(图2、图3),气孔数随倍性的增加而减少,叶绿体数随倍性的增加而增加。单倍体气孔数平均值为112个,而二倍体的气孔数平均值为55个,差异极显著(P<0.01)。单倍体和二倍体的叶绿体数平均分别为4.79个和8.79个,差异显著(P<0.05)。试验结果表明,二倍体与单倍体叶绿体数平均值的比值约为1.84∶1,基本接近于染色体数理论值之比2∶1;而二倍体与单倍体的气孔数比值约为1∶2.22,单倍体的气孔数约为二倍体的2倍。单、二倍体西葫芦的气孔数和叶绿体数均呈显著差异,因此可作为倍性鉴定的有效依据。
2.5 不同倍性西葫芦气孔保卫细胞叶绿体数分布频率
由不同倍性西葫芦气孔保卫细胞叶绿体数分段结果(表4)可知,单倍体和二倍体西葫芦的叶绿体数变异系数均较大,分别达到21.2%和15.8%。单倍体气孔保卫细胞叶绿体数为3~8个,叶绿体数为4个的最多,占42.68%,4~5个的占68.29%,且叶绿体数≤6个的占95.73%;二倍体为6~13个,叶绿体数为8个的最多,占 34.75%,9~12 个的占51.83%。因此,以叶绿体数为7个作为分界指标来判定倍性,叶绿体数小于7个为单倍体,大于或等于7个为二倍体,单、二倍体判定的准确率分别达95.73%和94.51%。

图3 西葫芦气孔数及保卫细胞叶绿体数与倍性的关系
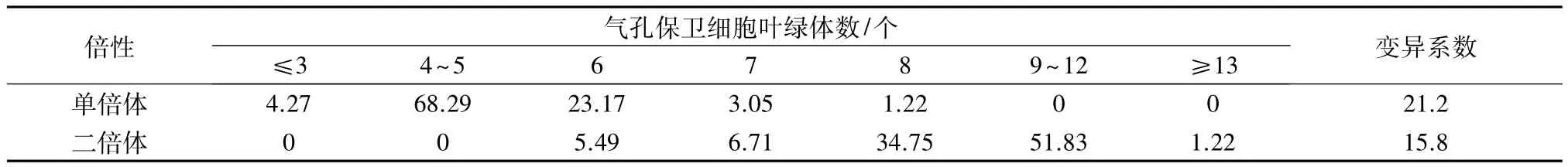
表4 西葫芦不同倍性植株气孔保卫细胞叶绿体数的分段频率 %
3 结论与讨论
研究表明,细胞分裂素有利于芽的增殖,其中低质量浓度6-BA的增殖效果优于KT和ZT[18]。王家珍等[19]发现,高质量浓度6-BA使外植体叶片卷曲甚至畸形,而低质量浓度的6-BA能促进外植体生长,并且叶片生长正常。宗娟等[20]的研究中,当6-BA质量浓度升高到1.20 mg/L时,新稍叶片卷曲畸形,且出现玻璃化现象。在本试验中,MS+0.50 mg/L 6-BA对西葫芦芽苗的腋芽诱导增殖率最高,达75.0%,当6-BA 质量浓度升高到1.00 mg/L 时,不利于腋芽的分化,分化的不定芽簇生,多畸形,不能用于扩繁操作,与前人研究结果相符。另外,本试验在不添加植物生长调节剂的基础MS培养基上有50.0%的茎尖增殖出腋芽,增殖倍数为 1.50,王建书等[8]研究认为,西葫芦茎尖在基础MS培养基上虽能进一步生根,但发育缓慢,不能促进基部腋芽的发生,这可能是由于外植体的获取途径不同造成的,本试验所选用的茎尖来自受植物生长调节剂影响的再生胚囊植株,而王建书则直接从实生苗上截取茎尖,前期培养没受到植物生长调节剂的影响。
宗娟等[20]认为,NAA具有较好的根诱导效应。赵晓菲[21]也指出,培养基中NAA 质量浓度为0.05 mg/L或0.10 mg/L时胚状体不定根发生率显著高于不添加NAA的培养基,而质量浓度超过0.10 mg/L时平均生根时间明显延长。在本试验中发现,NAA质量浓度为 0.10 mg/L 时,生根率最高,达83.3%,在其他处理的培养基中诱导生根率均较低。降低无机盐质量浓度配合一定的植物生长调节剂常常能解决再生苗生根难的问题[22]。例如,樱桃在MS培养基上不能生根,而在1/2MS培养基上可形成根[23]。刘独臣等[16]在对西瓜茎尖离体再生体系的构建过程中发现,添加1/2MS+0.10 mg/L NAA的培养基诱导生根率达100%。因此,在以后的试验中,将对不同质量浓度无机盐对腋芽的生根效果进行比较。
染色体倍性化在遗传育种、作物品种改良及优良性状利用上发挥着越来越重要的作用,倍性鉴定是倍性育种及其应用的重要环节。在众多鉴定方法中,染色体制片法是细胞倍性鉴定最直接可靠的方法。因其计数准确,不需要复杂的仪器,也是目前应用最多的鉴定方法。常规染色体制片一般采用茎尖、根尖、卷须、愈伤组织等材料[24]。郭启高等[25]在西瓜组织培养早期,利用不定芽叶尖染色体计数法检出植株倍性。王舰等[14]研究了马铃薯匍匐茎茎尖、块茎茎尖和试管苗根尖不同组织的差异,发现块茎的茎尖和匍匐茎的茎尖作为染色体数目鉴定材料效果都比较好。陈劲枫等[26]指出,对于卷须类种质资源,尤其在种子缺乏、材料极其珍贵的情况下,卷须是理想的染色体研究材料。本试验通过对西葫芦茎尖、根尖和卷须作为鉴定材料的效果进行对比,发现根尖和卷须均可区分不同倍性材料,卷须与根尖相比,取卷须对珍贵的单倍体材料无损伤,可以作为西葫芦根尖染色体倍性鉴定的替代材料。
虽然染色体计数法准确性高,但此方法耗时而且需要熟练的细胞学操作技术[27],而西葫芦染色体小,染色体数目多,细胞密度大,在制片过程中细胞和染色体均易造成重叠,大批量的鉴定十分困难。叶片气孔保卫细胞鉴定法,因其操作简单、经济实惠和适合大容量样本的倍性鉴定等特点,在葫芦科作物倍性鉴定中受到广泛重视和应用[28-29]。如王康等[30]研究发现,四倍体和二倍体相比在气孔大小、密度和叶绿体数目方面存在显著差异,可在早期利用气孔特征快速鉴定、排除二倍体植株。闵子扬等[29]认为,南瓜单倍体再生植株的保卫细胞平均叶绿体数目为4.28个,二倍体植株平均叶绿体数为8.37个。施先锋等[31]提出,西瓜二倍体气孔保卫细胞叶绿体数为8~14个,四倍体气孔保卫细胞叶绿体数为15~21个,即二倍体的叶绿体数<15个,四倍体的叶绿体数≥15个,初步将叶绿体数15个作为鉴定西瓜二倍体和四倍体的分界指标。本研究结果表明,气孔保卫细胞叶绿体数为7个可作为西葫芦鉴定单二倍体的界限,叶绿体数<7个为单倍体,准确率达95.73%,叶绿体数≥7个为二倍体,准确率达94.51%。本结论可能受品种及材料来源的影响,对于其他品种来源的材料是否适用还需要进一步探究。
试验过程中发现,胚囊再生植株虽然可以实现茎尖扩繁,但培养一段时间的茎尖普遍存在“花打顶”,这种现象严重影响了植株的生长,以后将在培养基中添加GA对“花打顶”现象进行抑制,进一步完善胚囊植株茎尖培养快繁技术。
[1] 王玉书,王欢,高美玲,等.羽衣甘蓝小孢子再生植株的倍性鉴定及加倍[J].河南农业科学,2015,44(7):107-110.
[2] 孙守如,章鹏,胡建斌,等.南瓜未受精胚珠的离体培养及植株再生[J].植物学报,2013,48(1):79-86.
[3] 谢冰,王秀峰,樊治成.西葫芦离体雌核发育胚状体成苗影响因子分析[J].西北农业学报,2006,15(5):182-186.
[4] Shalaby T A.Factors affecting haploid induction through in vitro gynogenesis in summer squash(Cucurbita pepo L.)[J].Scientia Horticulturae,2007,115(1):1-6.
[5] 刘栓桃,赵智中,孙小镭,等.西葫芦未受精胚珠离体诱导植株再生的关键因素[J].华北农学报,2008,23(2):96-100.
[6] 唐桃霞,程永安,张恩慧,等.外源添加物对西葫芦胚状体诱导效果研究[J].西北农业学报,2015,24(6):84-89.
[7] 程慧.西葫芦离体雌核培养及植株再生影响因子研究[D].杨凌:西北农林科技大学,2013.
[8] 王建书,孙松松,刘浩,等.西葫芦茎尖离体培养和快速繁殖技术[J].北方园艺,2015(22):96-98.
[9] 邹万君,刘卫民,李华,等.脱毒马铃薯原原种茎尖扦插快繁技术[J].云南农业科技,2016(3):6-8.
[10] 王耀琴,刘建平,南怀林,等.山药种苗3种快繁技术比较研究[J].中国农学通报,2016,32(16):34-39.
[11] 张春芬,潘天任,邓舒,等.草莓茎尖快速繁殖体系的研究[J].山西农业科学,2016,44(3):291-293.
[12] 贾文庆,刘宇,唐米米.观赏南瓜的组织培养和快速繁殖[J].江苏农业科学,2007(1):91-93.
[13] 宋金亮,朱磊,王震,等.低温弱光胁迫对西葫芦幼苗生长指标的影响[J].北方园艺,2017(1):13-17.
[14] 王舰,杨永智,蒲秀琴.鉴定马铃薯染色体数目的方法研究[J].黑龙江农业科学,2009(1):1-2.
[15] 张菊平,巩振辉,刘珂珂,等.辣椒染色体倍性水平的快速检测[J].西北农林科技大学学报(自然科学版),2007,35(8):121-124.
[16] 刘独臣,房超,刘小俊,等.小西瓜茎尖离体再生体系的建立[J].西南农业学报,2008,21(5):1373-1377.
[17] 张志忠,吴菁华,吕柳新.西瓜高频再生系统的研究[J].中国农学通报,2004,20(2):151-153.
[18] 张虹,洪霓,王国平.梨树茎尖培养及其在病毒脱除中的应用[J].华中农业大学学报,2004,23(3):370-374.
[19] 王家珍,蔡忠民.南果梨的茎尖培养[J].北方果树,2004(2):9-10.
[20] 宗娟,朱立武,贾兵.黄冠梨茎尖离体培养再生体系建立初探[J].广东农业科学,2010,37(2):51-53.
[21] 赵晓菲.西葫芦离体雌核培养诱导胚囊再生植株技术研究[D].杨凌:西北农林科技大学,2014.
[22] 陶炼,潘翠萍,谢红江,等.三倍体枇杷茎尖培养与植株再生[J].热带作物学报,2014,35(11):2249-2254.
[23] 张志勤,肖娅萍,王喆之.马哈利樱桃茎尖培养与快速繁殖[J].植物生理学报,2004,40(1):70.
[24] 陶抵辉,李小红,王利群,等.植物染色体倍性鉴定方法研究进展[J].安阳工学院学报,2008,13(6):453-458.
[25] 郭启高,宋明,杨天秀,等.西瓜试管苗中四倍体鉴定方法研究[J].西南大学学报(自然科学版),2000,22(3):261-263.
[26] 陈劲枫,钱春桃.利用几种园艺作物卷须制片鉴定染色体数目的研究[J].园艺学报,2002,29(4):378-380.
[27] Metwally E I,Moustafa S A,El-Sawy B I,et al.Production of haploid plants from in vitro culture of unpollinated ovules of Cucurbita pepo[J].Plant Cell,Tissue and Organ Culture(PCTOC),1998,52(3):117-121.
[28] 郭永强,王建设,张慧玲,等.西葫芦胚囊再生植株倍性鉴定方法研究[J].华北农学报,2004,19(3):80-83.
[29] 闵子扬,刘泽发,杨红波,等.南瓜胚囊再生植株倍性鉴定方法的比较[J].湖南农业大学学报(自然科学版),2016,42(2):162-165.
[30] 王康,何林池,魏小云,等.利用二甲戊乐灵创制薄皮甜瓜同源四倍体[J].西北农业学报,2015,24(4):114-119.
[31] 施先锋,彭金光,汪李平.用西瓜叶片气孔保卫细胞叶绿体数鉴定西瓜染色体倍性[J].湖南农业大学学报(自然科学版),2009,35(6):640-642.

