郑州地区汉族人群的CYP2C9/VKORC1基因多态性与华法林个体化用药研究
刘科兰
(郑州大学第二附属医院药学部,河南 郑州 450014)
华法林是目前临床上的一线口服抗凝血药,主要用于预防和治疗血栓栓塞性疾病,但其狭窄的抗凝治疗窗口及给药剂量不当所致的并发症是临床合理用药的巨大障碍。由于个体差异和种族差异很大,不同的患者若要达到相同的治疗效果,华法林的剂量可相差10倍以上[1]。随着遗传学与药物基因组学的发展,近年来研究发现遗传因素是造成华法林给药剂量个体差异的主要原因之一[2];华法林在肝脏的代谢酶CYP2C9及其作用靶点VKORC1的基因多态性是造成不同患者华法林给药剂量差异的重要原因之一[3]。本研究通过检测郑州地区汉族人群的CYP2C9/VKORC1基因多态性,分析不同基因型与华法林给药剂量的关系。
1 材料与方法
1.1 仪器与试剂
DNA提取及聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒、BR526-24型全自动杂交仪和BE-2.0型生物芯片识别仪(上海Baio公司);ABI9902型PCR仪(美国AB公司)。
1.2 研究对象
研究对象为2014—2015年郑州大学第二附属医院心内科、心外科及老年科的167例使用华法林(未联用胺碘酮)患者的外周静脉血样标本。所有患者均来自郑州市及其周边地区;均为汉族,彼此之间无血缘关系;男性患者94例,女性患者73例;年龄19~92岁;平均身高(165.94±7.46) cm;平均体质量(65.31±12.66) kg。
1.3 方法
1.3.1 提取DNA:取患者外周血1 ml(乙二胺四乙酸抗凝),采用DNA提取试剂盒,进行DNA的提取。
1.3.2 定性PCR:采用PCR扩增试剂盒。反应体系25 μl。PCR反应条件,50 ℃预变性5 min;94 ℃变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,35个循环;再在72 ℃下延伸5 min,结束扩增产物备用。
1.3.3 确定基因分型:同时检测CYP2C9 *1、*2、*3位点和VKORC1-1 639位点基因型,确定每例患者的基因分型。
1.3.4 给药剂量计算:采用国际华法林药物基因组联合会(international warfarin pharmaeogenetics consortium,IWPC)算法,根据患者的身高、体质量、年龄及检测出的基因型计算每例患者华法林的给药剂量。
1.3.5 统计学分析:采用SAS 8.0统计学软件处理数据,利用χ2检验和方差分析对各组进行比较;进行哈迪-温伯格定律的吻合度测验,检验各等位基因频率是否符合遗传学规律[4]。
1.3.6 CYP2C9、VKORC1基因多态性及其他指标与华法林剂量的关系:对167例患者的CYP2C9、VKORC1基因型分别进行检测,根据患者基因型和IWPC模型确定患者华法林最初给药剂量,并根据国际标准化比值(INR)监测结果调整华法林至稳定给药剂量,分析不同的基因型与华法林用药量的关系。
2 结果
2.1 基因分型分布
167例患者中,VKORC1-1639 AA基因型者138例(占82.63%),VKORC1-1639 AG基因型者27例(占16.17%),VKORC1-1639 GG基因型者2例(占1.20%);CYP2C9 *1/*1基因型者153例(占91.62%),CYP2C9*1/*3基因型者14例(占8.38%),CYP2C9*1/*2基因型者0例;所有患者中共有10例同时出现VKORC1 AA和CYP2C9*1/*3基因变异(χ2=2.054,P>0.05),符合哈迪-温伯格定律。各种基因型生物芯片识别图见图1。
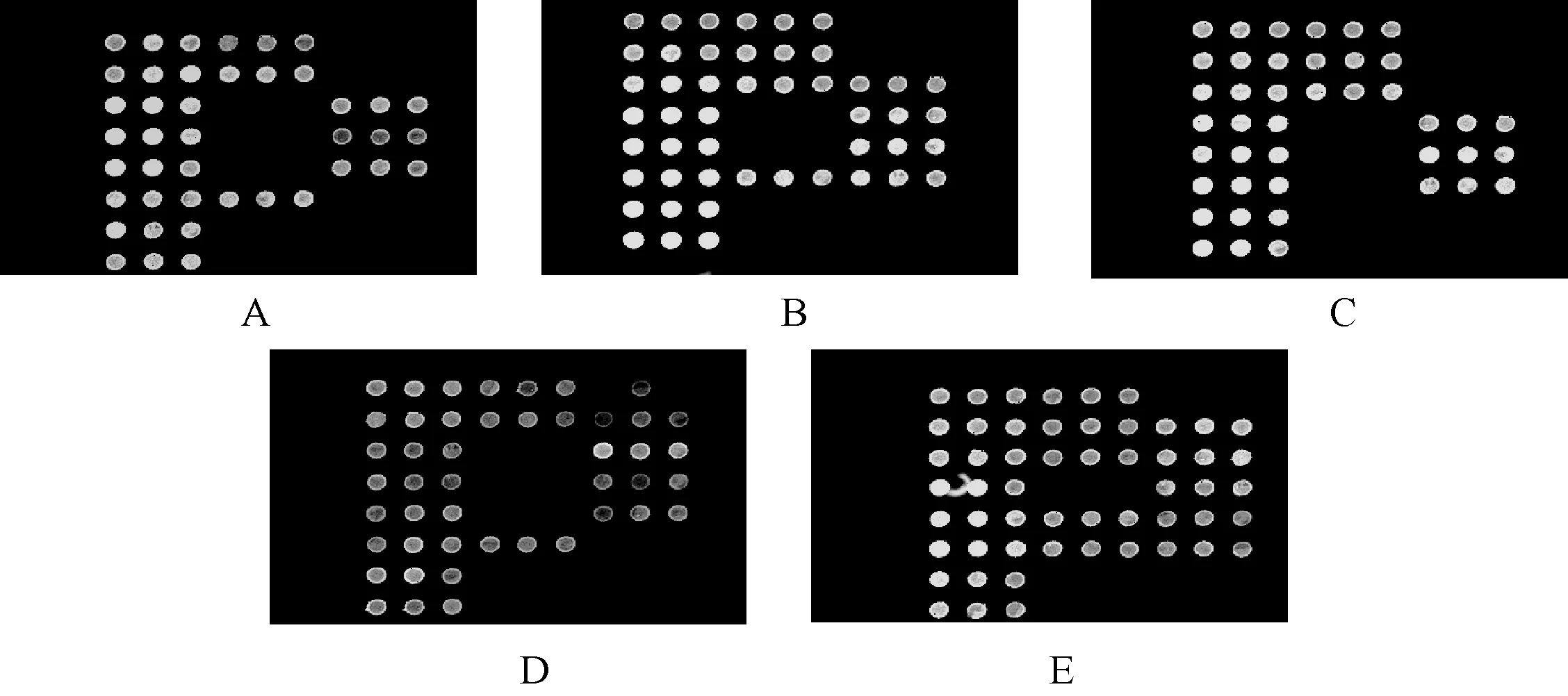
A.(CYP2C9*1/*1)/(VKORC1-1639 AA);B.(CYP2C9*1/*1)/(VKORC1-1639 GA); C.(CYP2C9*1/*1)/(VKORC1-1639 GG);D.(CYP2C9*1/*3)/(VKORC1-1639 AA);E.(CYP2C9*1/*3)/(VKORC1-1639 GA)图1 各种基因型生物芯片识别示意图Fig 1 Schematic diagram of genotype biochip identification
2.2 CYP2C9、VKORC1基因多态性及其他指标与华法林剂量的关系
167例患者中,女性患者的华法林平均剂量为3.04 mg/d,男性患者为3.39 mg/d,两者的差异无统计学意义(P>0.05)。VKORC1-1639 GG基因型[(5.61±0.69)mg/d]、VKORC1-1639 AG基因型[(4.01±1.05)mg/d]患者的华法林稳定给药剂量明显高于VKORC1-1639 AA基因型[(2.98±0.58)mg/d],差异均有统计学意义(P<0.000 5);CYP2C9*1/*1基因型患者的华法林稳定给药剂量[(3.34±0.86)mg/d]明显高于CYP2C9*1/*3基因型[(2.02±0.45)mg/d],差异有统计学意义(P<0.001),见表1。其中,基因型为CYP2C9*1/*1和VKORC1-1639 AA的患者128例,华法林平均稳定给药剂量为(3.24±0.69)mg/d;基因型为CYP2C9*1/*1和VKORC1-1639 AG的患者21例,华法林平均稳定该药剂量为(4.45±0.73)mg/d;基因型为CYP2C9*1/*1和VKORC1-1639 GG的患者2例,华法林平均稳定给药剂量为(5.86±0.51)mg/d;基因型为CYP2C9*1/*3和VKORC1-1639 AA的患者10例,华法林平均稳定给药剂量为(1.90±0.45)mg/d;基因型为CYP2C9*1/*3和VKORC1-1639 AG的患者4例,华法林平均稳定该药剂量为(2.29±0.26)mg/d,见表2。

表1 167例患者的CYP2C9/VKORC1基因多态性分布Tab l Distribution of gene polymorphism in CYP2C9/VKORC1 from 167 patients

表2 基因多态性对华法林抗凝作用的影响Tab 2 Influence of gene polymorphism on the anticoagulant effect of warfarin
注:等位基因频率在性别间的差异无统计学意义(P>0.05)
Note:there was no statistical significance in allele frequency between the genders(P>0.05)
3 讨论
目前,临床上仍主要依靠INR的监测值调整患者的华法林用量,这种方法不但增加了患者的治疗费用、检验次数,还延长了药物达到稳态浓度的时间,并可能增加栓塞及出血的风险。随着药物基因组学的发展,药物代谢酶的基因多态性研究在临床上的指导意义越来越大,基因导向个体化治疗已被用于临床,对指导临床的个体化用药极为重要。
近年来研究发现,CYP2C9/VKORC1的基因多态性是导致不同患者华法林给药剂量差异的重要原因[5-6]。华法林60%~70%的抗凝作用由S-华法林承担,而参与S-华法林代谢的酶主要为CYP2C9,可见CYP2C9基因多态性可显著影响华法林的代谢[7]。另有研究结果显示,CYP2C9突变型(*2、*3)的基因多态性对华法林代谢的影响约占10%,可使酶的活性降低,携带此基因的患者服用华法林后达到稳态浓度需要的时间较长,与野生型*1/*1相比,华法林的给药剂量相对较低,且在使用初期有较高的出血危险性[8]。另外,在VKORC1编码区和非编码区存在大量的多态性基因位点,这些多态性基因位点会影响相关酶的活性,使华法林的给药剂量存在显著的个体差异。文献曾报道,对华法林剂量有影响的位点主要是启动子区1 639位置G>A。
本研究探讨了郑州地区167例患者中CYP2C9/VKORC1这2种基因的多态性与华法林剂量的关系,以及不同基因型对华法林剂量个体差异的影响程度。结果显示,患者服用华法林的剂量从1.71 mg/d到6.14 mg/d,个体差异很大,与陈晖等[7]的报道基本一致。携带CYP2C9*1/*1基因型的患者153 例,CYP2C9*1/*3基因型的患者14例,未发现CYP2C9*1/*2基因型的患者。CYP2C9*1/*1基因型患者的稳定给药剂量[(3.34±0.86)mg/d]明显高于CYP2C9*1/*3基因型[(2.02±0.45)mg/d],差异有统计学意义(P<0.001)。携带CYP2C9突变型患者(*1/*3)发生INR过高和严重出血事件的风险显著高于野生型患者(*1/*1),稳定给药剂量较野生型患者低。另外,携带VKORC1-1639 AA基因型的患者138例(占82.63%),VKORC1-1639 AG基因型27例(占16.17%),VKORC1-1639 GG基因型2例(占1.20%),与其他研究结果基本一致[9-10]。VKORC1-1639 AA是纯合子突变基因型,与野生
基因型相比,携带纯合子突变基因型的患者需要的华法林剂量更低一些。VKORC1-1639 GG基因型[(5.61±0.69) mg/d]、VKORC1-1639 AG基因型[(4.01±1.05) mg/d]患者的稳定给药剂量明显高于VKORC1-1639 AA基因型[(2.98±0.58) mg/d],差异均有统计学意义(P<0.000 5),与文献报道一致[11-12]。同时发现,基因多态性在性别上的差异无统计学意义。
本次研究仅检测了患者CYP2C9、VKORC1基因型,由结果可见,华法林最初给药剂量明显高于稳定给药剂量。原因是华法林的抗凝效果除了与CYP2C9、VKORC1基因型密切相关外,还受到CYP2A6、CYP4F2、γ-谷氨酰基羧化酶、载脂蛋白E及多药耐药基因等的调控[13]。另外,药物相互作用、生理病理状态及药物等非遗传因素对华法林抗凝治疗亦存在显著影响[14]。
由本研究结果可见,CYP2C9及VKORC1基因多态性在郑州地区人群中的分布比较普遍,这对于临床实践将具有很重要的指导意义。Zhu等[15]研究结果显示,CYP2C9/VKORC1基因多态性加上性别、年龄及体质量等因素对华法林的影响可以解释约50.4%~64.1%的个体用药差异,其中VKORC1基因的影响约占25%[7]。可见,目前CYP2C9/VKORC1基因多态性仍是影响华法林剂量个体差异的重要因素。因此,建议郑州地区的广大医务工作者在对患者进行治疗时,要重视患者的CYP2C9/VKORC1基因分型,尤其是携带CYP2C9突变型的患者(*1/*2、*1/*3);另外,可以在允许的条件下,建议患者进行CYP2C9/VKORC1基因分型的检测,参考检测结果指导临床合理使用华法林,最终实现个体化用药。
[1]Ansell J,Hirsh J,Hylek E,et al.Pharmacology and management of the vitamin Kant agonists:American College of Chest Physicians Evi-dence-Based Clinical Practice Guidelines(8th Edition)[J].Chest,2008,133(6 Suppl):160S-198S.
[2]苗静琨,陈启雄,吴小玫,等.石菖蒲α-细辛醚对Lithium-Pilocarpine抗癫痫模型GABA系统的调控作用[J].中国药理学通报,2011,27(8):1067-1071.
[3]娄莹,刘红,韩璐璐,等.CYP2C9和VKORC1基因多态性对肺栓塞患者华法林初始抗凝疗效的影响[J].中国临床药理学杂志,2012,28(4):256-259.
[4]都丽萍,梅丹,刘昌伟,等.CYP2C9和VKORC1基因多态性对华法林剂量和抗凝效果的影响[J].中国药学杂志,2010,45(21):1628-1633.
[5]Almeida L,Falcão A,Vaz-da-Silva M,et al.Effect of nebicapone on the pharmacokinetics and pharmacodynamics of warfar in healthy subjects[J].Eur Clin Pharmacol,2008,64(10):961-966.
[6]张延博,葛卫红,印晓星.120例华法林钠抗凝治疗患者CYP2C9基因多态性的研究[J].医学研究生学报,2013,26(1):45-48.
[7]陈晖,马蕾.CYP2C9和VKORC1基因多态性与华法林个体化用药的临床研究[J].中国实用医药,2015,10(12):3-5.
[8]贺宝霞,石磊,赵树进,等.CYP2C9和VKORC1基因多态性与华法林个体化用药研究进展[J].广东医学,2008,29(4):684-686.
[9]顾强,陈柏成,郝嘉,等.重庆地区人工机械瓣膜置换术后患者VKORC1-1639 A/G遗传多态性与华法林剂量调整的研究[J].第三军医大学学报,2009,31(23):2370-2373.
[10] Yang L,Ge W,Yu F,et al.Impact of VKORC1 gene polymorphism on inter-individual and interethnic warfarin dosage requirement syst-ematic review and meta analysis[J].Thromb Res,2010,125(4):e159-e166.
[11] Wang D,Chen H,Momary KM,et al.Regulatory polymorphism in vitamin K epoxide reductase complex subunit 1(VKORC1)affects gene expression and warfarin dose requirement[J].Blood,2008,112(4):1013-1021.
[12] Sconce EA,Khan TI,Wynne HA,et al.The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements:proposal for a new dosing regimen[J].Blood,2005,106(7):2329-2333.
[13] 何志强,韩勇,彭雯,等.基因检测指导华法林个体化用药案例分析[J].中国医院药学杂志,2013,33(14):1188-1189.
[14] 刘俊,徐航,葛卫红,等.华法林基于药物基因组学个体化给药方案的评价[J].中国医院药学杂志,2013,33(22):1857-1862.
[15] Zhu Y,Shennan M,Reynolds KK,et al.Eslimation of warfarin main-tenance dose based on VKORC1(-1639 G>A)and CYP2C9 genolypes[J].Clin Chem,2007,53(7):1199-1205.

