高效液相色谱法测定淫羊藿药材及饮片中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的含量Δ
王世杰,高云佳,周书繁,韩志岭,张文涛,李为理,姜 勇
(1.辽宁上药好护士药业(集团)有限公司研发部,辽宁 本溪 117000; 2.北京大学中医药现代研究中心,北京 100191)
淫羊藿为小檗科植物淫羊藿EpimediumbrevicornumMaxim.、箭叶淫羊藿EpimediumsagittatumMaxim.、柔毛淫羊藿EpimediumpubescensMaxim.或朝鲜淫羊藿EpimediumkoreanumNakai的干燥叶,具有补肾阳、强筋骨和祛风湿的作用,临床上被用于肾阳虚衰、阳痿遗精、筋骨痿软、风湿痹痛和麻木拘挛等症[1]。关于淫羊藿的质量控制,一般是测定淫羊藿苷或总黄酮的含量,以其含量的高低作为判断药材及饮片优劣的标准。这种方法有很大的局限性,不足以全面反映药材及饮片的质量。现代研究结果表明,中药是一个复杂体系,其药理作用是多种成分共同作用的结果,采用多指标成分定量对其质量控制是十分必要的。通过文献调研[2-7],发现淫羊藿的主要药效成分为淫羊藿苷、淫羊藿次苷Ⅰ、朝藿定A、朝藿定B和朝藿定C等黄酮苷类化合物。以往对淫羊藿黄酮类成分的分析方法很多,但仍然存在着不同程度的局限性,如色谱条件不理想、分离度不好、色谱峰的保留时间过长及基线不稳等。为了建立淫羊藿药材及饮片有效的质量控制方法,本研究收集了不同产地的淫羊藿药材及饮片样品,以朝藿定A、朝藿定B、朝藿定C和淫羊藿苷等4种主要黄酮苷类成分为指标,建立多指标成分的含量测定方法,旨在为今后淫羊藿药材含量测定方法的选择和药材的质量控制与评价提供参考。
1 材料
1.1 仪器
Sartorius BSA124 s型电子天平(北京赛多利斯天平有限公司);Agilent 1100型高效液相色谱仪、VWD G1 314 A型紫外检测器[安捷伦科技(中国)有限公司];KQ 250型超声波清洗器(昆山市超声仪器有限公司);N-1100型旋转蒸发仪(日本EYELA)。
1.2 药品与试剂
17批淫羊藿药材分别产自甘肃省(批号:150915—150919、150504、150511、150601—150603、150605—150607)、吉林省(批号:150705)、辽宁省(批号:150808、150810)和陕西省(批号:150815),12批淫羊藿市售饮片分别产自甘肃省(批号:160513、160522、160524、160601、160621)、四川省(批号:160519、160611)、吉林省(批号:160425、160509、160515)、黑龙江省(批号:160613)和辽宁省(批号:160611),均由辽宁上药好护士药业(集团)有限公司提供,经北京大学药学院屠鹏飞教授鉴定为淫羊藿EpimediumbrevicornumMaxim.。对照品:淫羊藿苷(批号:110737-200415)、朝藿定C(批号:111780-201503)购自中国食品药品检定研究院;朝藿定A(批号:MUST-14060312)、朝藿定B(批号:MUST-14062312)购自成都曼思特生物科技有限公司。乙醇、磷酸、甲酸及冰醋酸试剂均为分析纯(北京化工厂);乙腈(天津市彪仕奇科技发展有限公司)、甲醇(天津市赛孚世纪科技发展有限公司)为色谱纯,水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱为Agilent ZORBAX SB-C18柱(4.6 mm×250 mm,5 μm),流动相为乙腈-0.01%磷酸水(V∶V=24 ∶76),流速1.0 ml/min,柱温30 ℃,检测波长270 nm,进样量10 μl。
2.2 对照品溶液的制备
取朝藿定A、朝藿定B、朝藿定C和淫羊藿苷对照品适量,精密称定,加甲醇制成每1 ml含朝藿定A 0.034 mg、朝藿定B 0.079 mg、朝藿定C 0.14 mg和淫羊藿苷0.217 mg的混合对照品溶液。
2.3 供试品溶液的制备
取淫羊藿药材粉末(过三号筛,50目)约0.2 g,置于具塞锥形瓶中,加入50%乙醇20 ml,称定质量,超声1 h,放冷,再称定质量,用50%乙醇补充减失的质量,摇匀,滤过,取续滤液,即得。
2.4 测定结果
在上述色谱条件下进样测定,结果见图1。

A.对照品溶液;B.供试品溶液;1.朝藿定A;2.朝藿定B; 3.朝藿定C;4.淫羊藿苷A.reference solution;B.sample solution;1.epimedin A; 2.epimedin B;3.epimedin C;4.icariin图1 对照品溶液和供试品溶液的高相液相色谱图Fig 1 HPLC chromatograms of the references and samples
2.5 线性关系考察
分别精密吸取各对照品溶液2、4、8、10、12和16 μl进样,测定各对照品的峰面积,再分别以各对照品的峰面积为纵坐标(Y)、进样量(g)为横坐标(X),制作标准曲线。结果表明,在线性范围内,各成分线性关系良好,见表1。

表1 朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的回归方程Tab 1 Results of the regression equations for epimedins A, B and C and icariin
2.6 精密度试验
精密吸取同一供试品溶液(产地:甘肃省,批号:150511),连续进样6次,进样量10 μl,测定各色谱峰的峰面积,计算其RSD。结果显示,朝藿定A、朝藿定B、朝藿定C和淫羊藿苷峰面积的RSD分别为0.30%、0.08%、1.37%和0.25%,表明本研究所用仪器精密度良好。
2.7 重复性试验
取同一批号的淫羊藿药材粉末(产地:甘肃省,批号:150511),按供试品溶液制备方法,平行配制6份,分别测定朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的峰面积,计算相应含量。结果显示,样品中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷平均含量分别为0.20%、1.27%、0.29%和0.60%,其RSD分别为0.63%、0.73%、2.23%和0.82%,表明该方法的重复性良好。
2.8 稳定性试验
精密吸取同一供试品溶液(产地:甘肃省,批号:150511),分别于 0、2、4、8、12和24 h测定各色谱峰的峰面积,计算其RSD。结果显示,朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的RSD分别为1.08%、0.27%、1.73%和0.71%,表明该供试品溶液在24 h内的稳定性良好。
2.9 加样回收率试验
取已知含量的淫羊藿药材粉末(产地:甘肃省,批号:150511,淫羊藿苷、朝藿定A、朝藿定B和朝藿定C的含量分别为0.60%、0.20%、1.27%和0.29%),精密称取0.1 g,置于具塞锥形瓶中,按1 ∶1浓度分别精密吸取含朝藿定A 0.2 mg、朝藿定B 1.27 mg、朝藿定C 0.29 mg和淫羊藿苷0.6 mg的各对照品溶液加入各药粉中,按供试品溶液的制备方法,制成6份同浓度的供试品溶液。按上述色谱条件检测,计算其回收率,结果表明,该方法的准确性良好,见表2。
2.10 检测限和定量限的测定
精密量取已知浓度的对照品溶液适量,置于10 ml容量瓶中,以乙腈-水(V∶V=24 ∶76)定容至刻度。取该溶液进样10 μl测定,记录色谱图。以信噪比为3 ∶1时的色谱峰对应的进样量作为最低检测限,以信噪比为10 ∶1时的色谱峰对应的进样量作为最低定量限,结果见表3。

表3 待测成分最低检测限和定量限(μg)Tab 3 The LOD and LOQ of the analytes(μg)
2.11 样品的测定
取17批淫羊藿药材和12批淫羊藿市售饮片的样品,按供试品溶液制备方法制备,依法测定样品中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的含量,结果见表4。
3 讨论
3.1 流动相的考察
通过文献调研[8-10]并结合试验发现,在流动相中加入一定量的酸,可改善黄酮苷类化合物的峰型,减少拖尾现象。本实验考察了不同浓度的甲酸、乙酸、磷酸和三氟乙酸对各色谱峰的影响,结果发现加入磷酸后,色谱图基线平稳,各色谱峰分离良好且峰型无拖尾。本研究选用等度洗脱,方法更简便、省时。
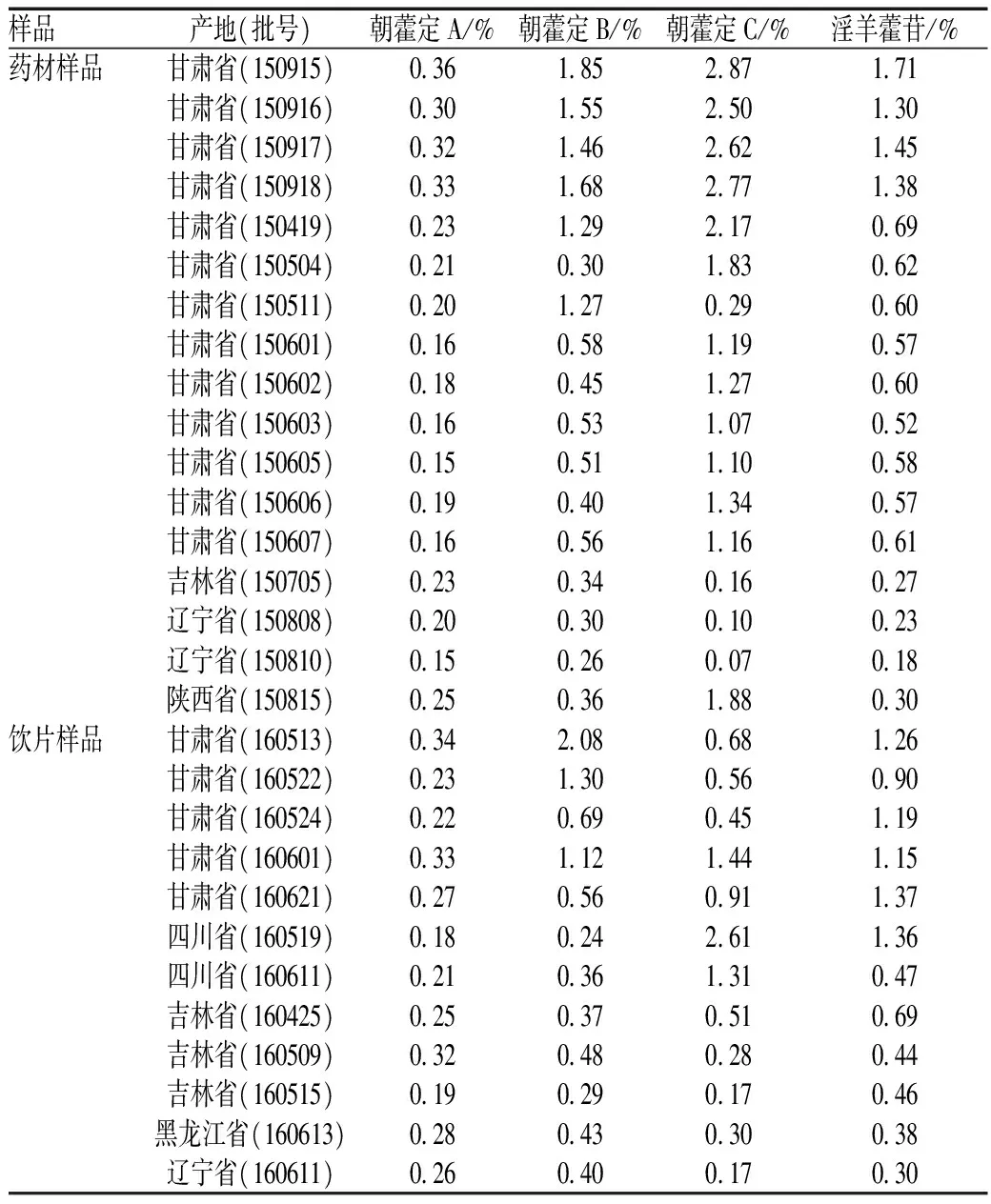
表4 朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的含量测定结果(n=2)Tab 4 Results of the content determination of epimedins A, B and C and icariin(n=2)
3.2 检测波长的选择
采用紫外分光光度法,分别对朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的对照品溶液进行全波长扫描,发现上述4个化合物在270 nm处均有最大吸收,结合《中华人民共和国药典:一部》(2015版)中淫羊藿药材含量测定的检测波长,最终选择270 nm为本研究检测波长。
3.3 产地对药材及饮片质量的影响
《中华人民共和国药典:一部》(2015版)规定,淫羊藿药材中淫羊藿苷的含量不得低于0.5%,其在饮片中的含量不得低于0.4%。本实验的检测结果显示,不同产地的药材及饮片中淫羊藿苷等成分的含量差异较大,可能与不同地区的土壤、气候和环境等因素有关。东北三省的淫羊藿药材中上述4种成分的含量均较低,仅少数样品符合《中华人民共和国药典:一部》(2015版)的要求;而甘肃省的淫羊藿药材中淫羊藿苷的含量普遍很高,且朝藿定B、朝藿定C的含量也普遍高于其他地区的药材,说明该地区的药材具有较好的品质。因此,在采购药材时应充分考虑地域差异的影响。
《中华人民共和国药典:一部》(2015版)中采用紫外分光光度法方法测定淫羊藿药材的总黄酮含量,单一指标性成分未能实现对药材的全面监测,紫外方法虽实现了对总黄酮的测定,但准确性不够好。朝藿定A、朝藿定B、朝藿定C和淫羊藿苷为淫羊藿中的主要活性成分,具有补肾阳、强筋骨和祛风湿的药理作用[1]。本研究建立了同时测定上述4种主要活性成分含量的高效液相色谱-紫外检测方法,为淫羊藿药材及市售饮片的质量控制提供了更加便捷、高效和准确的方法,为进一步提升淫羊藿的质量标准提供了有意义的参考。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:327-328.
[2]孟宁,孔凯,李师翁.淫羊藿属植物化学成分及药理活性研究进展[J].西北植物学报,2010,30(5):1063-1073.
[3]李晓龙,刘虹宇,曹佩雪,等.HPLC同时测定21种淫羊藿中朝藿定C和淫羊藿苷的含量[J].药物分析杂志,2011,31(5):931-934.
[4]陈婷,许亮,杨燕云,等.HPLC法测定朝鲜淫羊藿及市售淫羊藿中淫羊藿苷等四种成分研究[J].中华中医药学刊,2014,32(7):1621-1623.
[5]雷永涛,梁妍,郝小燕,等.不同产地淫羊藿中4种活性成分含量的高效液相色谱法测定[J].时珍国医国药,2013,24(6):1404-1405.
[6]袁佳,钱冬女,滕俊.HPLC法测定不同产地淫羊藿饮片中淫羊藿苷的含量[J].海峡药学,2014,26(5):56-57.
[7]郭丽娜,马莹慧,赵伟,等.淫羊藿属植物中化学成分分析研究进展[J].中国新药杂志,2013,22(8):919-922,936.
[8]余晓晖,侯嘉,赵磊,等.甘肃不同产地淫羊藿中总黄酮和淫羊藿苷含量测定[J].甘肃中医学院学报,2014,31(1):13-16.
[9]马清娟,王晶,韩凌,等.HPLC法同时测定淫羊藿药材中8种黄酮类成分的含量[J].沈阳药科大学学报,2014,31(12):970-978.
[10] 黄弥娜,周燕妮,柳强,等.HPLC法测定不同产地淫羊藿中7种主要黄酮类成分的含量[J].第二军医大学学报,2015,36(12):1352-1355.

