湿热地区不同贮藏温度对热鲜牛肉品质变化的影响
黄彩燕,韩玲,余群力,瞿明仁,杨食堂,李海鹏,张松山,谢鹏,孙宝忠
(1.中国农业科学院北京畜牧兽医研究所,北京 100193)(2.甘肃农业大学食品科学与工程学院,甘肃兰州730070)(3.江西农业大学江西省动物营养重点实验室,江西南昌 330045)(4.高安裕丰农牧有限公司,江西高安330800)
热鲜肉是指处于生鲜状态、尚未失去宰前体温的肉,通常为凌晨宰杀,清早上市,不经过任何预冷处理,由于其加工操作简单,不经过任何降温处理,是我国传统畜禽肉品的主要生产销售方式[1~3]。与冷鲜肉和冷冻肉相比,可降低能耗、提高经济效益;热鲜牛肉营养丰富、外观新鲜、采购方便,且符合消费者的习惯,长期占据我国鲜肉市场。湿热地区是以“高温、高湿、多雨”为主要气候特征,我国南方炎热地区的气候大都属于湿热气候类型。由于热鲜牛肉自身温度较高、含有丰富的营养物质以及较高的水分含量等特点,为微生物生长繁殖和各类酶反应发生提供良好环境[4]。因此,使热鲜牛肉在湿热地区环境条件下贮藏和销售过程中更易于受到微生物的污染,导致其腐败和品质劣变。金鑫等研究了不同贮藏温度下热鲜猪肉的品质变化,表明25、20、15、10 ℃和4 ℃的热鲜肉一级鲜消费时段分别在12、18、36、48 h和96 h内[3]。李升升等研究热鲜牦牛肉贮藏期间品质变化,牦牛肉的质量损失随时间的延长而增加,损失率与环境温度呈正相关[5]。目前,国内外关于热鲜牛肉的相关研究报道较少,主要针对是冷鲜肉和冷冻肉的研究,仅有不同贮藏温度热鲜猪肉品质变化的研究。而关于湿热地区不同贮藏温度对热鲜牛肉品质变化影响的研究尚未报道,因此,对湿热地区不同贮藏温度热鲜牛肉品质进行研究十分必要。本文以锦江黄牛为研究对象,探究湿热地区不同贮藏温度下热鲜牛肉品质变化规律,旨在为湿热地区消费者食用和热鲜牛肉行业的发展提供参考。
1 材料与方法
1.1 实验材料
热鲜牛肉,购买于高安市裕丰农牧有限公司,选择发育正常、健康无病20月龄左右锦江黄牛6头,宰前禁食24 h,禁水12 h,按照伊斯兰屠宰方式屠宰,胴体修整后取左右两侧背最长肌作为实验原料。
1.2 处理方法
每头取约300 g肉样现场立即测定0 h相关指标,取约200 g左右冷冻于-80 ℃超低温冰箱测定其他指标。其余带回实验室(运输温度8±1 ℃,时间20 min)剔除皮、脂肪、筋膜和结缔组织,修整成约 5 cm×5 cm×10 cm 的条块,置于塑料托盘。按贮藏时间长短分成4份,分别贮藏在温度为5、15、25、35 ℃(温度参照湿热地区四个季节的平均温度)和湿度为80%恒温生化培养箱内,适时取出按照以下试验方法测定其相关指标。
1.3 仪器与设备
BS200S-WEI型分析天平,北京赛多利斯天平有限公司;PHS-3C型数显酸度计,上海宇隆仪器有限公司;SW-CJ-1FD型超净工作台:苏州泰安空气技术有限公司;HPX-160BSH-Ⅲ型恒温恒湿培养箱,上海新苗医疗器械制造有限公司;TGL-16MB型高速冷冻离心机,长沙湘仪有限公司;UV-6100型紫外可见分光光度计,上海元析仪器有限公司;TE2-64恒温培养箱,上海智城分析仪器制造有限公司;手提式压力蒸汽灭菌器,上海博讯实业有限公司。
1.4 测定指标与方法
1.4.1 pH测定
取恒温恒湿培养箱中贮藏的背最长肌肉样,采用便携式pH计测定肉样pH值,探头插入深度为2 cm,每个样品连续测定3次,结果取平均值。
1.4.2 感官指标测定
感官评价方法参照许立兴[6],略作修改。感官评定小组由 9名专业人员组成,对贮藏过程中热鲜牛肉的感官品质进行评价。感官评定标准如表1所示。

表1 热鲜牛肉感官评分标准Table 1 Sensory evaluation criteria of hot fresh beef
1.4.3 菌落总数的测定
用Petrifilm菌落总数测试片。前处理方法参照GB 4789.2-2016《食品微生物学检验 菌落总数测定》。取培养箱中贮藏的背最长肌肉样,称取25.000 g绞碎肉样,放入盛有225 mL生理盐水的无菌三角瓶内,振荡1~2 min,制成1:10的样品匀液,按Petrifilm菌落总数测试片操作方法,制备10倍系列稀释样品匀液,每递增稀释一次,换用1次1 mL无菌枪头。
1.4.4 肌糖元含量测定
参照南京建成生物工程研究所生产的肌糖元试剂盒方法。肉样经生理盐水漂洗后用滤纸吸干,称取85 mg肉样,加入试管中,按照质量体积比1:3加入试剂盒中提供的浓碱255 μL,沸水浴20 min进行水解,流水冷却后加入1.36 mL蒸馏水,制成5%的糖元检测液。
1.4.5 MFI测定
参照Li[7]方法,将肉样充分剪碎,除去结缔组织及脂肪,称取4.000 g肉样,加40 mL预冷(4 ℃)的MFI缓冲液(100 mmol/L KCl,11.2 mmol/L K2HPO4,8.8 mmol/L KH2PO4,1 mmol/L EGTA,1 mmol/L MgCl2,1 mmol/L NaN3)高速匀浆3次,每次20 s,间隔1 min;匀浆后冷冻离心(1000 r/min,15 min,2 ℃),弃上清,将沉淀用40 mL预冷后的MFI缓冲液悬浮,再离心(1000 r/min,15 min,2 ℃),弃上清,加10 mL预冷后的MFI缓冲液将沉淀充分悬浮,用150目的滤布过滤悬浮,除去结缔组织,再加10 mL MFI缓冲液洗离心管后进行过滤,用双缩脲法测定过滤后悬浮液的蛋白浓度,然后用MFI缓冲液稀释悬浮液蛋白浓度至0.5 mg/mL,在540 nm处测吸光度,将所得结果乘200得到MFI值。
1.5 数据处理
采用Microsoft Office Excel 2007及SPSS 19.0对数据进行统计分析,采用邓肯氏总重比较法(Duncan’s multiple-rang test)进行差异显著性分析,显著水平为0.05。结果采用均值±标准差的形式,使用 Microsoft Excel 2007绘图。
2 结果与分析
2.1 不同贮藏温度对热鲜牛肉pH的影响

图1 贮藏过程中pH的变化Fig.1 Changes in pH during the storage process
如图1所示,随着贮藏时间延长,不同贮藏温度处理组贮藏期间牛肉的pH呈先降低后升高趋势。不同贮藏温度处理组在贮藏6 h、12 h、120 h、pH的差异显著(图 1,p<0.05),且贮藏温度越高,pH降低速率越快。随着贮藏延长,不同贮藏处理组间pH差异性逐渐消失,宰后48 h和72 h差异不显著(p>0.05)。这与张婷[8]和金鑫等[3]研究结果一致。
贮藏前期,不同贮藏温度热鲜牛肉pH值降低,主要是由于牛宰后血液循环停止,氧气供应中断,肌肉中糖原在无氧状态下发生酵解产生乳酸、三磷酸腺苷以及磷酸肌酸分解产生磷酸,使得肌肉pH值降低,一直降低到糖原酵解酶的活性钝化,pH值不再下降,从而达到极限 pH[9,10]。在贮藏后期,pH值呈逐渐上升趋势,这可能是由于随牛肉贮藏时间的延长,热鲜肉表面的微生物生长繁殖活动加快,加速了牛肉中蛋白质的分解作用,肉腐败时肉中蛋白质在细菌和酶作用下被分解为氨和胺类等碱性小分子物质使pH值增高[8,11]。
2.2 感官评价

表2 贮藏过程中热鲜牛肉感官指标的变化Table 2 Changes in sensory indexes of hot fresh beef during storage
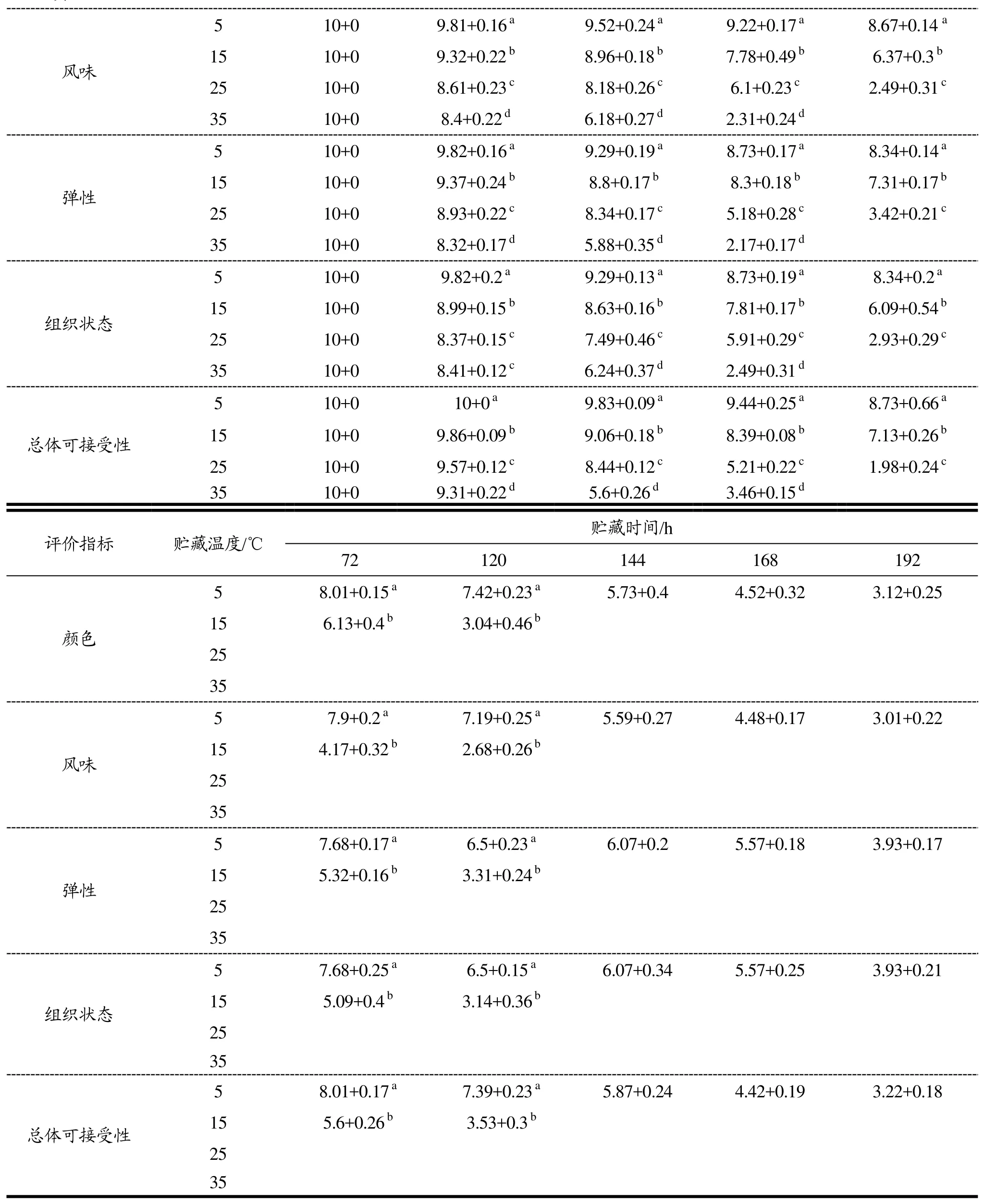
注:数据以“平均值±标准差”表示;同列相同字母表示差异不显著(p>0.05),不同字母则表示差异显著(p<0.05)。
从表2可以看出,随着贮藏时间的延长,4个不同贮藏温度处理组感官评分逐渐降低。在颜色、风味、黏度、弹性和总体可接受性方面,4个处理组间均差异显著(p<0.05)。5、15、25、35 ℃处理组分别在144 h、72 h、24 h和12 h时,四组样品色泽暗红,弹性一般,表面出水且没有牛肉特有的风味,在感官上开始变差;在192 h、120 h、48 h和24 h时,四组样品色泽暗淡,表面粘稠,结构松散,弹性变差且伴有异味,在感官上已经不能接受。这说明湿热地区贮藏温度对热鲜牛肉的食用品质具有一定影响。
2.3 不同贮藏温度对热鲜牛肉菌落总数的影响

图2 贮藏过程中菌落总数的变化Fig.2 Changes in the total number of colonies during the storage process
牛肉作为一种商业重要性和广泛食用的肌肉食物,由于它是蛋白质和其他必需营养素的良好来源。因此,它为腐败菌和病原微生物的生长提供了良好的基质[12]。如图2所示,随着贮藏时间的延长,4个不同贮藏温度处理组贮藏期间菌落总数均呈显著上升趋势,且贮藏温度越高,菌落总数上升趋势越快。
除了5 ℃和15 ℃贮藏处理组在贮藏6 h和12 h差异不显著(p>0.05),其余4个不同贮藏温度处理组间在贮藏期间均差异显著(p<0.05)。35 ℃、25 ℃、15 ℃和5 ℃贮藏处理组分别在贮藏时间为24 h、48 h、120 h和192 h菌落总数分别达到7.34 lg(CFU/g)、6.82 lg(CFU/g)、7.23 lg(CFU/g)和 8.08 lg(CFU/g)。此时,4个不同贮藏温度处理组热鲜牛肉均处于腐败变质状态。说明湿热地区贮藏温度越高,微生物生长繁殖速度越快,热鲜牛肉越易于腐败变质。
2.4 不同贮藏温度对热鲜牛肉肌糖元含量的影响
肌糖元是指动物屠宰后肌肉组织供氧不足时,糖酵解代谢作用将肌肉组织中储备的葡萄糖多聚物-肌糖元转化为主要代谢底物乳酸,诱使乳酸在肌肉组织中的累积,而累积的乳酸能够引起屠宰后早期肌肉组织pH的迅速下降[13~15]。从图3中可以看出,不同贮藏温度处理组肌糖元含量随着贮藏时间延长呈逐渐下降趋势。宰后 6h5℃、15℃和 25℃3 个不同处理组间差异不显著(p>0.05),与35℃处理组差异显著(p<0.05)。在 12h5℃和 15℃、15℃和 25℃处理组间差异不显著(p>0.05),24h、48h、72h 和 120h不同贮藏处理组间差异显著(p<0.05),且高温贮藏处理组肌糖元含量显著低于低温处理组(p<0.05),这与薛山对伊拉兔宰后肌糖元变化研究结果相一致[13]。

图3 贮藏过程中肌糖元含量的变化Fig.3 Changes in muscle glycogen content during the storage process
2.5 不同贮藏温度对热鲜牛肉MFI的影响

图4 贮藏过程中MFI的变化Fig.4 Changes in MFI during the storage process
肌原纤维小片化指数(MFI)是肌原纤维平均长度的衡量,MFI值越大,表明肌原纤维内部结构的完整性破坏程度越大。MFI的增加是由于宰后贮藏过程中I带肌原纤维的断裂,促进了肌纤维的小片化[16]。如图4所示,随着贮藏时间的延长,不同贮藏温度处理组宰后贮藏期间MFI的变化呈上升趋势。4个不同贮藏温度处理组间肌原纤维小片化指数的变化差异显著(p<0.05),且贮藏温度越高,MFI上升趋势越快。这说明贮藏温度越高,肌原纤维蛋白降解程度越快。
3 结论
湿热地区不同贮藏温度对热鲜牛肉的pH值、感官指标、菌落总数、肌糖元含量以及MFI具有一定影响。贮藏温度越高,热鲜肉肉品品质变化越快;感官评分越低;微生物生长繁殖越快;肌原纤维内部结构的完整性破坏程度越大;导致牛肉品质劣变速度越快。因此,在湿热地区热鲜牛肉不宜在夏季等较高环境温度中销售,不仅货架期短,同时还会对鲜肉品质产生一定影响。
[1]翁丽华.热鲜肉贮藏过程菌相分析及肠杆菌科生长预测模型建立[D].南京:南京农业大学,2012 WENG Li-hua. Study on bacterial phase analysis and growth prediction model of Enterobacteriaceae in fresh meat storage process [D]. Nanjing: Nanjing Agricultural University, 2012
[2]金鑫.热鲜猪肉食用品质及其特定腐败菌预测模型的研究[D].南京:南京农业大学,2012 JIN Xin. Study on the edible quality of hot pork and its specific sparse bacteria prediction model [D]. Nanjing:Nanjing Agricultural University, 2012
[3]金鑫,禹迎迎,徐幸莲,等.不同温度贮藏热鲜猪肉品质变化比较[J].食品科学,2012,16:261-265 JIN Xin, YU Ying-ying, XU Xin-lian, et al. Comparison of quality changes of hot fresh pork stored at different temperatures [J]. Food Science, 2012, 16: 261-265
[4]朱巧旋.壳聚糖复合生物保鲜剂对冷却肉保鲜品质影响研究[D].厦门:集美大学,2012 ZHU Qiao-xuan. Study on the effect of chitosan compound biological preservative on the preservation quality of chilled meat [D]. Xiamen: Jimei University, 2012
[5]李升升,靳义超,谢鹏.热鲜牦牛肉贮存期间品质变化研究[J].食品工业,2015,9:76-78 LI Sheng-sheng, LE Yi-chao, XIE Peng. Study on quality change of fresh yak meat during storage [J]. Food Industry,2015, 9: 76-78
[6]许立兴,薛晓东,仵轩轩,等.微冻及冰温结合气调包装对羊肉的保鲜效果[J].食品科学,2017,38(3):232-238 XU Li-xing, XUE Xiao-dong, WU Xuan-xuan, et al.Comparative effects of superchilling and ice-temperature combined with modified atmosphere packaging on mutton quality during storage [J]. Food Science, 2017, 38(3):232-238
[7]Li K, Zhang Y, Mao Y, et al. Effect of very fast chilling and aging time on ultra-structure and meat quality characteristics of Chinese Yellow cattle M. Longissimus lumborum [J]. Meat Science, 2012, 92(4): 795-804
[8]张婷.不同贮藏温度下牛肉新鲜度及品质变化研究[D].西安:陕西师范大学,2016 ZHANG Ting. Changes of beef freshness and quality under different storage temperature [D]. Xi’an: Shaanxi Normal University, 2016
[9]Ferguson D M, Daly B L, Gardner G E, et al. Effect of glycogen concentration and form on the response to electrical stimulation and rate of post-mortem glycolysis in ovine muscle [J]. Meat Science, 2008, 78(3): 202-210
[10]Bendall J R. Relations between muscle pH and important biochemical parameters during the postmortem changes in mammalian muscles [J]. Meat Science, 1979, 3(2): 143
[11]王志琴,孙磊,姚刚,等.不同保存温度下牛肉新鲜度变化规律的研究[J].新疆农业科学,2011,48(6):1120-1124 WANG Zhi-qin, SUN Lei, YAO Gang, et al. The changes of beef freshness at different storage temperatures [J]. Xinjiang Agricultural Sciences, 2011, 48(6): 1120-1124
[12]Schirmer B C, Langsrud S. Evaluation of natural antimicrobials on typical meat spoilage bacteria in vitro and in vacuum-packed pork meat [J]. Journal of Food Science,2010, 75(2): M98-M102
[13]薛山,贺稚非,李洪军.伊拉兔宰后肌糖原变化及其与兔肉品质的相关性[J].中国农业科学,2014,47(4):815-822 XUE Shan, HE Zhi-fei, LI Hong-jun. Variation of muscle glycogen of ira rabbit after slaughter and its correlation with changes of rabbit meat quality [J]. Chinese Agricultural Science, 2014, 47(4): 815-822
[14]Ryu Y C, Kim B C. The relationship between muscle fiber characteristics, postmortem metabolic rate, and meat quality of pig longissimus dorsi muscle [J]. Meat Science, 2005,71(2): 351-357
[15]Pösö A R, Puolanne E. Carbohydrate metabolism in meat animals [J]. Meat Science, 2005, 70(3): 423-434
[16]Hopkins D L, Martin L, Gilmour A R. The impact of homogenizer type and speed on the determination of myofibrillar fragmentation [J]. Meat Science, 2004, 67(4):705

