聚乙二醇干扰素α-2a与普通干扰素α-2b联合利巴韦林治疗慢性丙型肝炎患者疗效比较和影响疗效的预测因素分析
段军民,李素森,刘丽珍,雷鹏,于天威,唐瑞娟
慢性丙型肝炎是由丙型肝炎病毒(hepatitis C virus,HCV)感染而引起的慢性肝脏疾病,已成为全球性传染性疾病之一[1-3]。全球HCV感染率约为3%,中国HCV感染率为3.2%[4]。据统计,约有60%~80%HCV感染者持续存在病毒血症[5,6],进而引起慢性肝炎和肝硬化,甚至肝癌[7,8]。目前,重组α-干扰素被公认为治疗慢性丙型肝炎的有效药物,其能够起到调节免疫和抗病毒的双重功效[9,10]。丁岗强等[11]研究表明,对于基线血清HCV RNA水平>400000 IU/ml的基因Ⅰ型慢性丙型肝炎初治患者,接受聚乙二醇干扰素α-2a联合利巴韦林的治疗,若在2周时获得快速病毒学应答,其治疗36周与治疗48周疗程的持续病毒学应答率(SVR)相当。本研究观察了聚乙二醇干扰素-α-2a(pegylated interferonα,PEG-IFN-α)与普通干扰素-α-2b(IFN-α-2b)联合利巴韦林治疗慢性丙型肝炎患者的疗效,并对影响抗病毒疗效的预测因素进行了分析,期待能够为临床合理用药提供参考依据。
1 资料与方法
1.1 一般资料 2010年5月~2014年8月我院收治的慢性丙型肝炎患者116例,男性69例,女性47例;年龄20~60岁之间,平均年龄为(41.95±11.35)岁。所有患者均符合2004年中华医学会发布的《丙型肝炎防治指南》[12]。纳入标准:①血清HCV RNA>1×103IU/mL;②未接受过任何抗病毒治疗;③无应用干扰素禁忌证;④入组前6个月内未使用过影响免疫功能的药物。排除标准:①合并其他肝炎病毒感染或HIV感染者;②合并心、肺、肾等其他重要脏器病变者;③合并精神疾病者;④失代偿期肝硬化者;⑤妊娠或哺乳期妇女。随机将患者分为研究组和对照组,每组58例。两组患者在男女性别比例、平均年龄、血清HCV RNA载量方面比较,差异均未呈现出统计学意义(P>0.05),具有组间可比性。1.2治疗方法 给予对照组患者IFN-α-2b(安福隆,天津华立达生物工程有限公司,国药准字S20000019)5 MU肌肉注射,1次/隔日;给予研究组患者PEG-IFN-α(派罗欣,上海罗氏制药有限公司,国药准字 J20070055)180 μg皮下注射,1 次/w。给予两组患者利巴韦林(威乐星,上海禾丰制药有限公司,国药准字h10920093)1.5 mg·kg-1d-1,分3次口服。两组患者治疗时间为24~48 w。
1.3 检测方法 采用实时荧光定量PCR法检测血清HCV RNA定量(上海宏石医疗科技有限公司)。1.4评价指标[13]病毒学应答主要包括快速病毒学应答(rapid virological response,RVR):治疗 4 w时血清HCV RNA阴性或低于最低检测下限;早期病毒学应答(early virological response,EVR):治疗 12 w时血清HCV RNA阴性;治疗结束时病毒学应答(end treatment virological response,ETVR):治疗结束时血清HCV RNA阴性;SVR:治疗结束至少随访24 w,血清HCV RNA 阴性。
1.5 统计学处理 应用SPSS 18.0软件对本次临床研究数据行统计学处理,计数资料采用x2检验,计量资料以(±s)表示,采用 t检验,以 P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组血清HCV RNA转阴率的比较 与对照组患者比,研究组患者在治疗12 w、24 w、48 w以及停药后12 w和24 w血清HCV RNA转阴率均明显提高,差异均具有统计学意义(P<0.05,表1)。
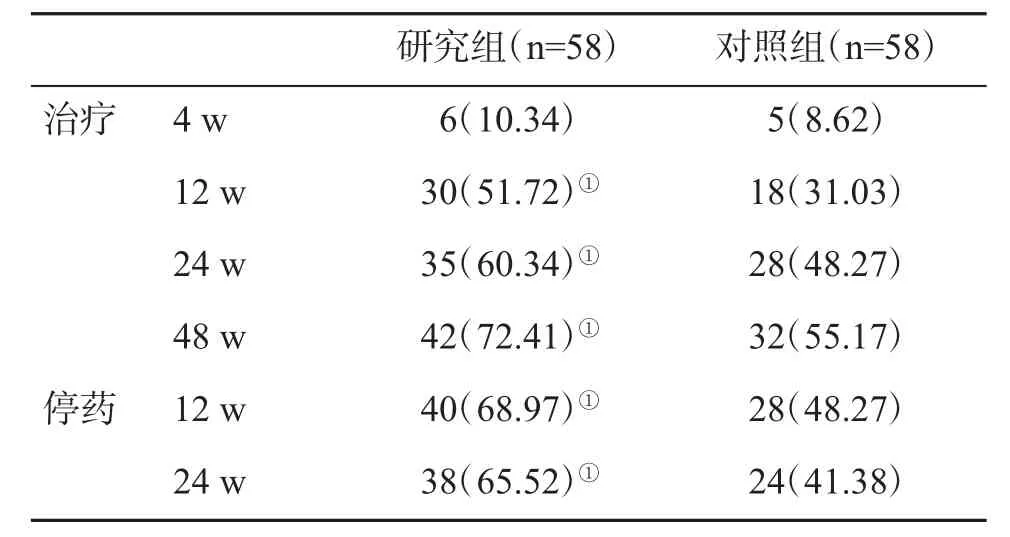
表1 两组血清HCV RNA转阴率(%)比较
2.2 两组患者病毒学应答情况的比较 与对照组患者比,研究组患者RVR、EVR、ETVR和SVR均明显提高,差异均具有统计学意义(P<0.05,表2)。
2.3 两组患者不同时间血清HCV RNA水平的比较与对照组患者比,研究组患者治疗4 w、12 w、24 w和48 w血清HCV RNA水平均明显降低,差异均具有统计学意义(P<0.05,表3)。

表2 两组病毒学应答率(%)比较
表3 两组血清 HCV RNA水平(lg IU/ml,±s)的比较
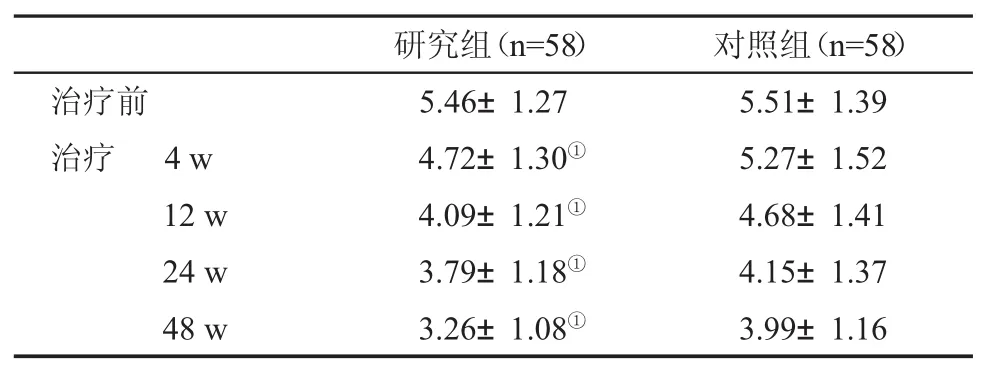
表3 两组血清 HCV RNA水平(lg IU/ml,±s)的比较
与对照组比,①P<0.05
?
2.4 两组患者不良反应发生情况的比较 两组患者在治疗过程中,均出现发热、失眠、肌肉酸痛、乏力以及白细胞下降等不良反应,但均未停药,患者均耐受治疗,且两组间比较,各不良反应发生率无显著性相差(P>0.05,表4)。
2.5 两组患者影响SVR的因素分析 无论在研究组或对照组,年龄轻、体质量正常和血清HCV RNA水平低的患者,获得SVR的机会大(P>0.05,表5)。

表4 两组不良反应发生率(%)比较
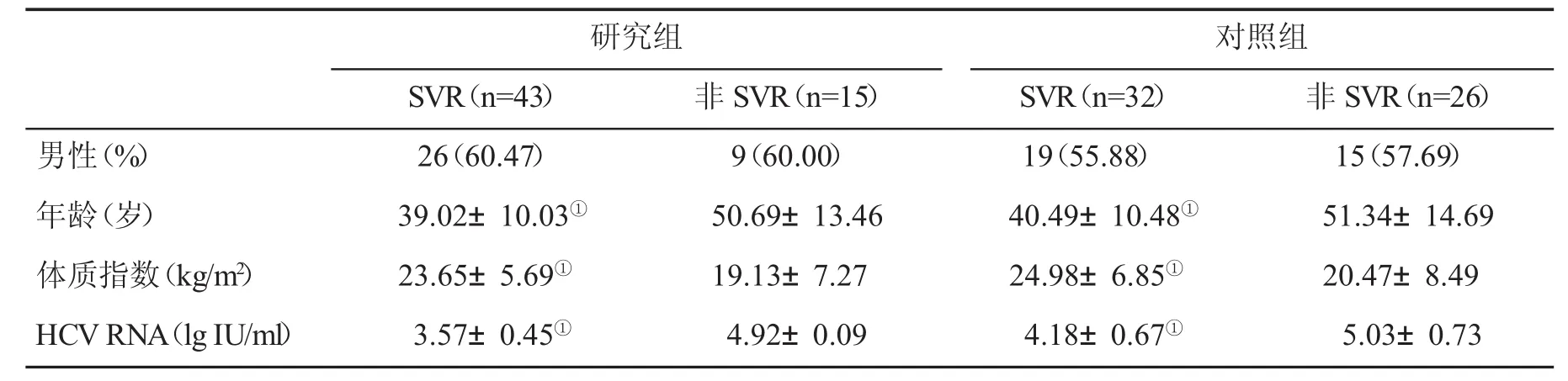
表5 两组患者影响SVR的因素分析
3 讨论
丙型肝炎作为经血液途径传播的临床病症之一,也属于全球流行性疾病[14]。据相关文献研究显示,大部分丙型肝炎患者会呈现出疾病慢性化,还有少数患者在后期呈现出进行性肝脏慢性炎症坏死及纤维化,甚至最终导致肝硬化或肝癌的发生,严重影响了患者的身体健康和生命安全,已成为公共卫生的重大问题[15,16]。
干扰素作为一种机体对各种病毒等因素的刺激而产生的,具有多种功能的蛋白或糖蛋白物质,以其较好的抗肿瘤、抗病毒、抗纤维化以及提高机体免疫力的效果,在临床上得到了较为广泛的应用[17]。在丙型肝炎患者的治疗过程中,干扰素能够与肝细胞膜相接触,并在细胞内产生一种特殊的蛋白,同时在某些情况下增强T淋巴细胞的活力,进而有助于对肝细胞内丙型肝炎病毒的清除。然而,干扰素在治疗的过程中需要保持较为稳定的血药浓度,才能够起到较好的抑制病毒的作用。IFN-α-2b的半衰期较短,血药浓度维持时间也较短,在用药后24 h血药浓度便会降至较低水平[18]。PEG-IFN-α通过干扰素α-2a与聚乙二醇的共价结合,不但增加了分子量,还形成了一定的分支结构,从而延长了半量吸收时间,使得其在机体内不易被清除,进而增强了药物在肝脏内的抗病毒作用,从而更好地发挥了治疗效应[19]。另外,利巴韦林在丙型肝炎患者的治疗中也起到了十分重要的协同作用,从IFN-α-2b单用治疗到IFN-α-2b联合利巴韦林治疗,再到聚乙二醇干扰素联合利巴韦林治疗,使得丙型肝炎患者的治疗效果得到了显著的提高[20]。
本研究结果表明,与对照组患者比,研究组患者在治疗12周、24周、48周以及停药后12周和24周血清HCV RNA转阴率均明显提高,差异均具有统计学意义(P<0.05)。与对照组患者比,研究组患者RVR、EVR、ETVR和SVR均明显提高,差异均具有统计学意义(P<0.05)。与对照组患者比,研究组患者治疗4周、12周、24周和48周HCV RNA水平均明显降低,差异均具有统计学意义(P<0.05)。两组患者在治疗过程中,均出现发热、失眠、肌肉酸痛、乏力以及白细胞下降等不良反应,但均未停药,患者均可耐受,且两组间比较,各不良反应发生率不存在显著差异(P>0.05)。与非SVR患者比,研究组SVR患者治疗前血清HCV RNA呈相对低水平。综上所述,PEG-IFN-α联合利巴韦林能够有效提高丙型肝炎治疗的有效性和安全性,其疗效与患者的性别、年龄以及病毒载量呈现出一定的相关性。
[1]Westerhout I,Treur M,Mehnert A,et al.A cost utility analysis of simeprevir used with peginterferon+ribavirin in the management of genotype 1 hepatitis C virus infection,from the perspective of the UK National Health Service.J Med Econ,2015,18(10):838-849.
[2]刘佩浩,饶慧瑛.慢性 HBV/HCV感染人群伴随的免疫相关表现. 临床肝胆病杂志,2016,32(10):1870-1873.
[3]邓舒妮,张学思,李新玥,等.慢性丙型肝炎病毒感染患者发生2型糖尿病的流行病学调查.中华医院感染学杂志,2016,26(6):1279-1280,1283.
[4]戴颖,孙杨安.聚乙二醇干扰素与普通干扰素治疗慢性丙型肝炎的临床观察. 江西医药,2015,50(2):103-106.
[5]茅雯辉,陈文,魏来.聚乙二醇干扰素α-2a与普通干扰素联合利巴韦林治疗慢性丙型肝炎的经济学评价.中国药物经济学,2012,23(1):6-14.
[6]侯惠玉,邓志华.直接作用抗病毒药物治疗丙型肝炎病毒感染相关肝脏疾病的疗效分析.国际消化病杂志,2016,36(6):329-332.
[7]Jo YM,Lee SW,Han SY,et al.Retreatment with peginterferon and ribavirin in chronic hepatitis C.World J Gastroenterol,2015,21(6):1994-1999.
[8]曾庆磊,付艳玲,吕君,等.慢性丙型肝炎持续病毒学应答后发生肝癌患者的临床特征分析. 肝脏,2015,20(10):772-775.
[9]余佳平.聚乙二醇干扰素与普通干扰素治疗慢性丙型肝炎的疗效比较及其影响因素分析. 肝脏,2015,20(1):86-88.
[10]刘斌,王志琳,王强,等.聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎病毒感染的临床效果研究.中华医院感染学杂志,2016,26(24):5575-5577.
[11]丁岗强,康谊,尚佳,等.聚乙二醇干扰素联合利巴韦林治疗获极快速病毒学应答的初治基因1型慢性丙型肝炎患者疗效观察. 实用肝脏病杂志,2014,17(5):507-510.
[12]中华医学会肝病学分会和感染病学分会.《丙型肝炎防治指南》2015 年更新版. 实用肝脏病杂志,2016,19(4):ⅠⅩ-ⅩⅩⅤⅠ.
[13]Lin J,Wang W,Xu Y,et al.Patterns of longitudinal change in hepatitis C virus neutralization titers correlate with the outcome ofpeginterferon and ribavirin combination therapy.J Med Virol,2015,87(5):821-828.
[14]王永素,张林,马强,等.聚乙二醇干扰素联合利巴韦林治疗不同年龄慢性丙型肝炎患者疗效比较.实用肝脏病杂志,2015,18(3):294-295.
[15]Soza A,Labbé P,Arrese M,et al.Mycobacterium abscessus pulmonary infection during hepatitis C treatment with telaprevir,peginterferon and ribavirin.Ann Hepatol,2015,14 (1):132-136.
[16]殷文伟,童师雯.慢性丙型肝炎病毒感染者外周血滤泡辅助T淋巴细胞的变化研究.上海交通大学学报(医学版),2016,36(6):825-829.
[17]陶晨,叶伟,赵伟.聚乙二醇干扰素对普通干扰素治疗失败慢性乙型肝炎患者的疗效. 江苏医药,2012,38(23):2864-2866.
[18]刘贵章,赵登蕴,李声方,等.普通干扰素与聚乙二醇干扰素联合利巴韦林治疗慢性丙型肝炎疗效观察.实用肝脏病杂志,2013,16(3):263-264.
[19]Janocha-Litwin J,Pazgan-Simon M,Simon K.DRESS syndrome as a complication of treatment of hepatitis C virus-associated post-inflammatory liver cirrhosis with peginterferon α2a and ribavirin.Postepy Dermatol Alergol,2014,31(6):401-404.
[20]梁超.聚乙二醇干扰素α-2a与普通干扰素α-2a联合利巴韦林治疗慢性丙型肝炎50例疗效观察.中国实用医药,2012,7(9):186-187.

