不同核苷(酸)类似物治疗慢性乙型肝炎患者对eGFR的影响
徐勇,冯继红,李荣宽,聂振汪,杨小舟
最近,一些前瞻性研究表明,替比夫定(telbivudine,LDT)治疗患者估算的肾小球滤过率(eGFR)有所改善[1-4]。我们在入选的无糖尿病和高血压的CHB患者观察了核苷(酸)类似物(NAs)治疗后24个月eGFR的变化,现报道如下。
1 资料与方法
1.1 病例来源 本研究使用的数据来自大连医科大学附属第二医院感染病科回顾性队列研究,这项研究方案获得该院医学伦理委员会批准,所有患者签署了知情同意书。2013年3月~2017年3月接受TDF、LDT或ETV治疗的所有CHB患者,符合2010年我国《慢性乙型肝炎防治指南》的诊断标准[5],纳入患者至少已接受24个月NAs治疗,排除急性乙型肝炎、器官移植、糖尿病、肝衰竭、肝硬化、高血压、任何恶性肿瘤、丙型肝炎病毒或HIV重叠感染、脓毒症或胃肠出血患者。
1.2 治疗方案 在连续468例患者中,其中57例患者治疗不超过2年,68例患者合并有高血压,76例患者合并糖尿病,58例患者缺乏sCr数据,39例患者合并有肝硬化,6例患者eGFR<30 ml·min-1·1.73 m-2),在剩下的164例CHB患者中,接受TDF(葛兰素史克公司)治疗40例,接受LDT(北京若华公司)治疗56例,接受ETV(中美上海施贵宝制药)治疗68例。
1.3 检测 使用MODULP800全自动生化分析仪(德国罗氏公司)测定血生化指标,分析基线时、12个月、24个月肝功能、肾功能、肌酸激酶和血磷水平;采用荧光定量PCR法检测血清 HBV DNA(试剂盒由上海科华生物工程有限公司提供)。应用慢性肾脏病流行病学合作研究(chronic kidney disease epidemiology collaboration,CKD-EPI) 协作组发布的计算公式[19]计算eGFR=141×[sCr/k]α×0.993年龄×1.018(女性)×1.159(非裔美国人),其中女性k为0.7,α为-0.329;男性k为0.9,α为 -0.411。以 eGFR<90 ml·min-1·1.73 m-2作为肾功能损伤的标准。
1.4 统计分析 应用SPSS 19.0版软件行统计分析。将血清HBV DNA水平行对数转换,计量资料以±s表示,采用配对t检验,计数资料以%表示,采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组患者基线特征 三组在已知可能影响肾功能的因素,比如性别、年龄、血清HBV DNA水平和预先存在的肾功能状态(包括肌酐和eGFR水平)方面匹配(P>0.05,表1),具有可比性。
表1 三组患者基线资料(%,±s)比较
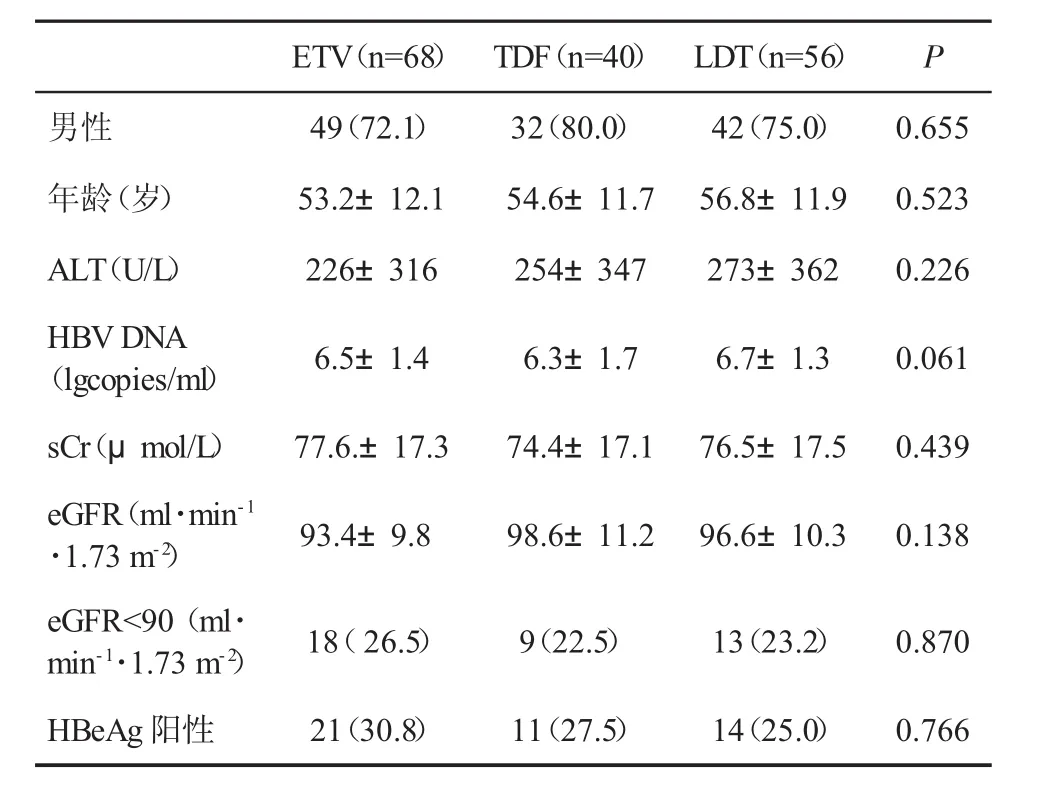
表1 三组患者基线资料(%,±s)比较
ETV(n=68) TDF(n=40) LDT(n=56) P男性 49(72.1) 32(80.0) 42(75.0) 0.655年龄(岁) 53.2±12.1 54.6±11.7 56.8±11.9 0.523 ALT(U/L) 226±316 254±347 273±362 0.226 HBVDNA(lgcopies/ml) 6.5±1.4 6.3±1.7 6.7±1.3 0.061 sCr(μmol/L)77.6.±17.374.4±17.176.5±17.50.439 eGFR(ml·min-1·1.73 m-2) 93.4±9.8 98.6±11.2 96.6±10.3 0.138 eGFR<90(ml·min-1·1.73 m-2) 18(26.5) 9(22.5) 13(23.2) 0.870 HBeAg阳性 21(30.8) 11(27.5) 14(25.0) 0.766
2.2 三组eGFR变化比较 在治疗24 m,ETV和TDF治疗患者sCr较基线无明显变化(P=0.068,P=0.058),eGFR 较基线下降(P=0.041、P=0.016),而 LDT组sCr较基线下降(P=0.022),eGFR较基线显着增加(P=0.002,表2、表3、图1、图2)。在基线,三组患者无 eGFR<50 ml·min-1·1.73 m-2者,但在ETV治疗的第13 m和TDF治疗的18 m时,分别有 1 例患者发生 eGFR<50ml·min-1·1.73 m-2,药物剂量被迫自1次/d口服,递减至隔日1次。
表2 三组sCr和eGFR(±s)变化比较
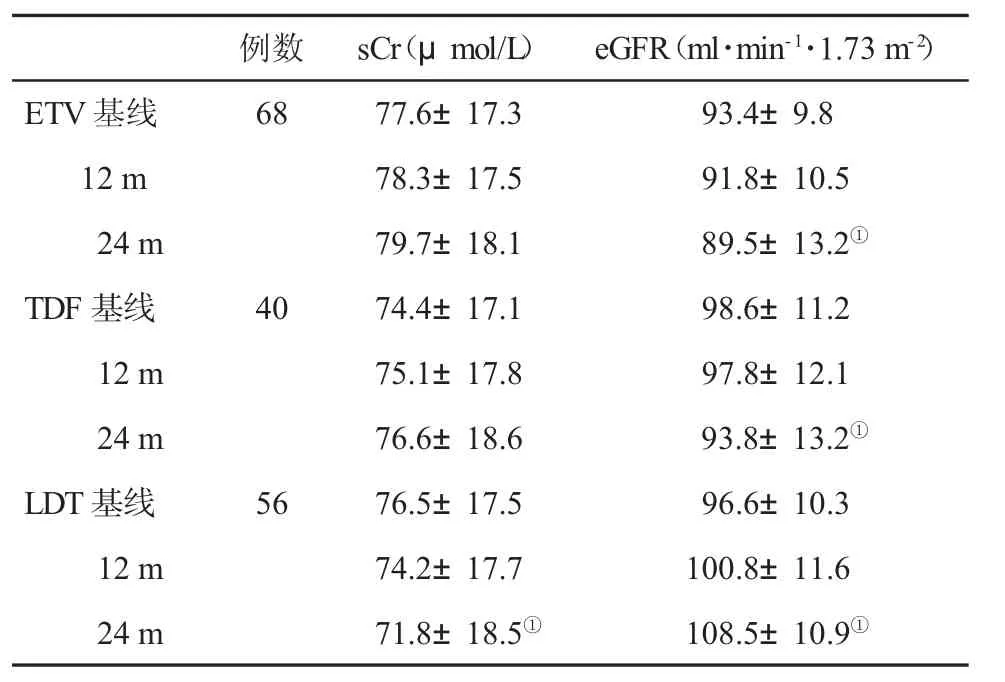
表2 三组sCr和eGFR(±s)变化比较
与基线组比,①P<0.05
?
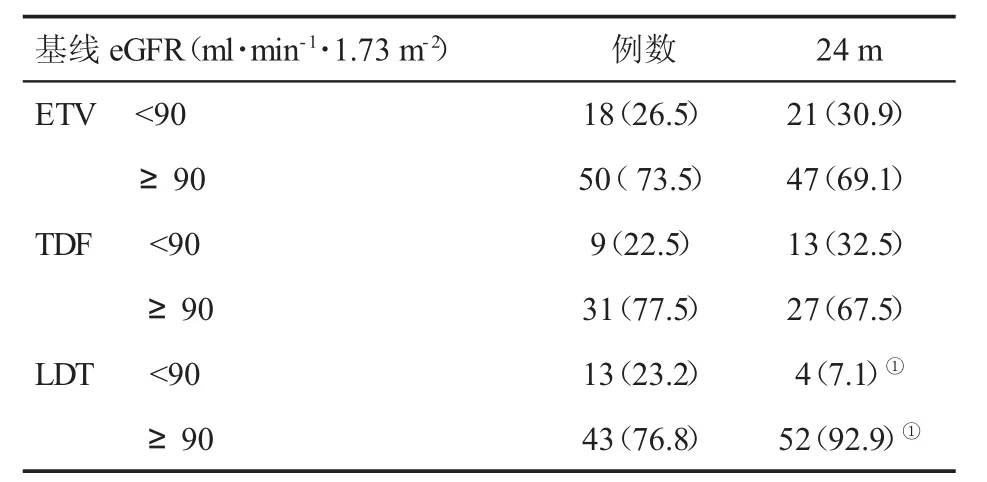
表3 三组eGFR变化(%)

图1 三组血清sCr水平变化

图2 三组eGFR水平变化
3 讨论
由于NAs可能发生的不良反应,包括肌病、肾病、周围神经病、乳酸性酸中毒和骨矿物质密度降低等,其中与核苷酸治疗相关的肾毒性受到最多的关注[6-8]。一些患者由于出现上述的副作用很难继续使用这些必需的药物。TDF是最有效的NAs之一。然而,其潜在的肾毒性仍然受到质疑。实际上,TDF的肾脏不良事件大多报告发生在艾滋病患者[9-12]。已有报道,应用TDF治疗患者2年后出现 eGFR下降[13-18],长期应用TDF对近端肾小管的潜在影响仍然需要考虑,Fanconi综合征是近端肾小管的一种罕见疾病。迄今为止,有几例与应用TDF相关的Fanconi综合征的报道[19-22]。CHB和CKD之间有密切的关系,来自德国的137例CHB患者的现实队列研究数据表明,在开始抗病毒治疗之前33.3%CHB患者存在2期CKD[23]。类似地,对290例亚洲CHB患者的队列研究发现,35%~45%患者在治疗前有 2 期 CKD[24],本研究有 24.5%(40/164))患者在抗病毒治疗之前出现肾功能损伤(eGFR<90 ml·min-1·1.73 m-2)。
Tsai et al[18]进行一项141例小样本纵队研究,应用TDF、LDT、ETV初治CHB患者治疗2年,发现LDT和ETV组患者eGFR均显著增加(73.5±10.8 ml·min-1·1.73 m-2对 83.9 ±21.4 ml·min-1·1.73 m-2,P=0.003、75.6±9.5 ml·min-1·1.73 m-2对 79.3±14.2 ml·min-1·1.73 m-2,P=0.012),而 TDF 组患者eGFR 明显降低(78.3±11.6 ml·min-1·1.73 m-2对73.0 ±13.1 ml·min-1·1.73 m-2,P=0.012)。本研究结果显示,在治疗24个月,ETV组和TDF组 eGFR较基线下降(P=0.041、P=0.016),LDT组 eGFR 较基线上升(P=0.002)。有许多回顾性长期队列研究显示,ETV治疗后eGFR没有改善,但也未报道有致命的肾毒性发生,说明其安全性和耐受性较好[5,16,17]。然而,很多研究并未排除糖尿病和高血压患者,他们可能携带了肾功能恶化的危险因素。最近一项来自土耳其的大型队列研究[16]显示,在核苷(酸)类治疗 2年的 895例(302例 LAM、27例 LDT、282例ETV、273例TDF和11例ADV)患者,ETV治疗者eGFR 无明显改变(96.2±22.5 ml·min-1·1.73 m-2对95.9±23.9 ml·min-1·1.73 m-2,P=0.535),而 TDF 治疗者出现 eGFR 降低(100.72±25.19 ml·min-1·1.73 m-2对 96.72±25.67 ml·min-1·1.73 m-2,P=0.001)。然而,在ETV和TDF治疗的CHB患者中分别有8.9%和4.8%合并糖尿病,10.3%和5.9%合并有高血压。在无失代偿期肝硬化的CHB患者中,19.9%ETV治疗者和8.9%TDF治疗者eGFR自60~90 ml·min-1·1.73 m-2转变为 >90 ml·min-1·1.73 m-2。Lee et al[25]对694例CHB患者进行队列研究,使用线性混合模型分析从基线到第6、12和18个月eGFR的变化。与基线时eGFR相比,LDT组在第18个月时eGFR增加了7.6%。然而,ETV组在第18个月时eGFR降低了4.1%。在LDT治疗的伴有糖尿病、高血压、肝硬化或 eGFR <90 ml·min-1·1.73 m-2的患者中,eGFR显示稳定的改善,而在ETV治疗的具有相同亚组的患者中eGFR却降低。在LDT治疗期间,eGFR逐渐增加,特别是在基线时存在轻度异常的eGFR患者,以及伴有糖尿病、高血压和肝硬化患者,而在ETV治疗患者,eGFR也降低。在本研究中,三组在治疗前均显示稳定的eGFR水平,我们确定CHB伴有肾功能损伤患者,无糖尿病和高血压病史,无化疗药物治疗史,以排除影响肾功能的混杂因素。本研究在ETV和TDF治疗组,分别有16.7%(3/18)和 44.4%(4/9)基线肾功能正常患者在治疗过程中进展成 eGFR<90 ml·min-1·1.73 m-2,而69.2%(9/13)基线肾功能受损的LDT治疗患者eGFR水平却在治疗过程中恢复至正常(≥90 ml·min-1·1.73 m-2)。在本研究中,只有 25例患者 eGFR升高≥20%,并且80%(20/25)来自LDT治疗组,而在出现eGFR下降的患者中,ETV组和TDF治疗组分别占 79.41%(54/68) 和 82.50%(33/68),eGFR 下降≥20%的患者仅2例,其中ETV组1例(1.47%),TDF组1例(2.50%)。我们的这些研究结果表明,经过24个月的治疗后,ETV和TDF治疗与CHB患者eGFR降低相关,LDT治疗与CHB患者eGFR改善相关,与其他的研究发现LDT单一疗法有益于肾脏功能改善类似[4-8,26]。
[1]Liaw YF,Kao JH,Piratvisuth T,et al.Asian-Pacific consensus statement on the management of chronic hepatitis B:a 2012update.Hepatol Int,2012,6(3):531-561.
[2]Perz JF,Armstrong GL,Farrington LA,et al.The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide.J Hepatol,2006,45(4):529-538.
[3]Pipili C,Cholongitas E,Papatheodoridis G.Review article:nucleos(t)ide analogues in patients withchronic hepatitis B virus infection and chronic kidney disease.Aliment Pharmacol Ther,2014,39(1):35-46.
[4]Tsai MC,Chen CH,Hung CH,et al.A comparison of efficacy and safety of 2-year telbivudine and entecavir treatment in patients with chronic hepatitis B:a match-control study.Clin Microbiol Infect,2014,20(2):90-100.
[5]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[6]Qi X,Wang JY,Mao RC,et al.Impact of nucleos(t)ide analogues on the estimated glomerular filtration rate in patients with chronic hepatitis B:a prospective cohort study in China.J Viral Hepat,2015,22(1):46-54.
[7]Turan I,Yapali S,Bademkiran F,et al.Telbivudine in liver transplant recipients:Renal protection does not overcome the risk of polyneuropathy and myopathy.Liver Transpl,2015,21(8):1066-1075.
[8]Lee S,Park JY,Song K,et al.Comparison of the effects of telbivudine and entecavir treatment on estimated glomerular filtration ratein patientswith chronichepatitisB.GutLiver,2015,9(6):776-783.
[9]Gane EJ,Deray G,Liaw YF,et al.Telbivudine improves renal function in patients with chronic hepatitis B.Gastroenterology,2014,146(1):138-146.e5.
[10]Gara N,Zhao X,Collins MT,et al.Renal tubular dysfunction during long-term adefovirortenofovirtherapy in chronic hepatitis B.Aliment Pharmacol Ther,2012,35(11):1317-1325.
[11]Laprise C,Baril JG,Dufresne S,et al.Association between tenofovir exposure and reduced kidney function in a cohort of HIV-positive patients:results from 10 years of follow-up.Clin Infect Dis,2013,56(4):567-575.
[12]Salome T,Kasamba I,Mayanja BN,et al.The effect of tenofovir on renal function among Ugandan adults on long-term antiretroviral therapy:a cross-sectional enrolment analysis.AIDS Res Ther,2016,13(1):28.
[13]Jose S,Hamzah L,Campbell LJ,et al.Incomplete reversibility of estimated glomerular filtration rate decline following tenofovir disoproxil fumarate exposure.J Infect Dis,2014,210(3):363-373.
[14]Ha NB,Trinh HN,Rosenblatt L,et al.Treatment outcomes with first-line therapies with entecavir and tenofovir in treatment-naive chronic hepatitis B patients in a routine clinical practice.J Clin Gastroenterol,2016,50(2):169-174.
[15]MalletV,SchwarzingerM,Vallet-Pichard A,etal.Effectof nucleoside and nucleotide analogues on renalfunction in patientswith chronic hepatitis B virusmonoinfection.Clin Gastroenterol Hepatol,2015,13(6):1181-1188,e1.
[16]Pradat P,Le Pogam MA,Okon JB,et al.Evolution of glomerular filtrationrate in HIV-infected,HIV-HBV coinfected and HBV-infected patients receiving tenofovir disoproxil fumarate.J Viral Hepat,2013,20(9):650-657.
[17]Koklu S,Gulsen MT,Tuna Y,et al.Differences in nephrotoxicity risk and renal effects among anti-viral therapies against hepatitis B.Aliment Pharmacol Ther,2015,41(3):310-319.
[18]Lin YS,Shih SC,Wang HY,et al.Comparison of telbivudine and entecavir on the change of off-treatment eGFR after 3 years of treatment in non-cirrhotic chronic hepatitis B patients.BMC Gastroenterol,2017,17(1):22.
[19]Tsai MC,Chen CH,Tseng PL,et al.Does nucleos(t)ide analogues treatment affect renal function in chronic hepatitis B patientswho have already decreased eGFR A longitudinal study.PLoS One,2016,11(3):e0149761.
[20]Levey AS,StevensLA,Schmid CH,et al.A new equation to estimate glomerular filtration rate.Ann Intern Med,2009,150(9):604-612.
[21]Hwang HS,Park CW,Song MJ.Tenofovir-associated?Fanconi syndrome and nephrotic syndrome in a patient with chronic hepatitis B monoinfection.Hepatology,2015,62(4):1318-1320.
[22]Conti F,Vitale G,Cursaro C,et al.Tenofovir-induced?Fanconi syndrome in a patient with chronic hepatitis B monoinfection.Ann Hepatol,2016,15(2):273-276.
[23]Mauss S,Berger F,Filmann N,et al.Effect of HBV polymerase inhibitors on renal function in patients with chronichepatitis B.J Hepatol,2011,55(6):1235-1240.
[24]Ha NB,Ha NB,Garcia RT,et al.Renal dysfunction in chronic hepatitis B patients treated with adefovir dipivoxil.Hepatology,2009,50(3):727-734.
[25]Lee S,Park JY,Song K,et al.Comparison of the effects of telbivudine and entecavirtreatmenton estimated glomerular filtration rate in patients with chronic hepatitis B.Gut Liver,2015,9(6):776-783.
[26]Liang KH,Chen YC,Hsu CW,et al.Decrease of serum angiotensin converting enzyme levels upon telbivudine treatment for chronic hepatitis B virus infection and negative correlations between the enzyme levels and estimated glumerular filtration rates.Hepat Mon,2014,14(1):e15074.

