CIAPIN1对HepG2细胞增殖和细胞周期的影响
欧志涛,詹远京,郭家伟,罗 铎
细胞因子诱导的凋亡抑制分子1(cytokine-ind uced apoptosis inhibitor 1,CIAPIN1)是受体依赖性激酶Ras信号通路中的效应分子[1]。研究显示,CIAPIN1被敲除后,胚胎鼠发育个体小,循环和造血器官,如心脏、肝脏、脾脏等发育异常[2]。另有研究指出,CIAPIN1表达与肝癌组织学分级呈负相关,与TNM分级呈正相关[3]。上述发现均提示CIAPIN1在肝癌的发生及发展过程中可能起重要作用,但CIAPIN1对肝癌细胞增殖能力的影响研究尚不多见。本研究构建重组慢病毒CIAPIN1表达载体和CIAPIN1沉默载体,探讨了体外调控CIAPIN1基因表达对肝癌HepG2细胞增殖能力的影响,并初步分析了其作用机制,现报告如下。
1 材料与方法
1.1 主要试剂、仪器和细胞 重组慢病毒CIAPIN1表达载体、CIAPIN1 siRNA慢病毒载体、无关对照siRNA慢病毒载体,均委托上海博上生物技术有限公司合成;ViraPowerTM Lentiviral Packaging Mix、LipofectamineTM 2000、293FT细胞,均购自Invitrogen公司;DMED培养液、胎牛血清,均购自Gibco公司;Matrigel,购自BD公司;全长 CIAPIN1 cDNA克隆pOTB7-CIAPIN1,购自上海英为信生物科技有限公司;鼠抗人CIAPIN1单克隆抗体、山羊抗鼠IgG-HRP,均购自Santa Cruz公司;EDTA购自Sigma公司;抗CyclinD1、抗CDK4、抗CDK2、抗Cyclin E抗体,购自Santa Cruz公司;NF-кB染色试剂购自Thermo公司;IKKβ、磷酸化IKBα、p65和磷酸化抗p65和抗PARP抗体,购自Bioworld Technology;RT-PCR检测仪及其配套分析软件,购自ABI公司;680型全自动酶标仪购自Bio-Rad公司;台式离心机、37℃恒温摇床,均为国产仪器。肝癌细胞株HepG2细胞由我院感染病研究所提供。
1.2 感染用病毒的包装 取对数生长期293FT细胞,以0.25%胰蛋白酶消化,调整细胞密度至6×108个/L,接种至10 cm培养皿,在37℃、5%CO2环境下培养24 h,至细胞达70%~80%融合后,加入ViraPowerTM Lentiviral Packaging Mix、Lipofectamine TM 2000及预先制备的重组慢病毒载体DNA,进行转染。48 h后,取病毒上清液,4℃下4000 g离心10 min,用0.45μm滤膜过滤,测定病毒滴度,分装,置于-80℃保存。
1.3 病毒感染 取HepG2细胞,按105个/孔接种至6孔板,室温培育8 h,分别加入CIAPIN1表达慢病毒、CIAPIN1 siRNA慢病毒、无关对照siRNA慢病毒感染或不转染,病毒感染复数与细胞数比例为10:1。随后,加入polybrene,调整其浓度至5 μg/ml,持续培养8 h,更换新鲜培养液,加入Blasticidin,调整其浓度至5 μg/ml,筛选培养2~3 w,获得稳定的转导细胞。为确保最终能够获得CIAPIN1基因高表达组、CIAPIN1基因低表达组,并与无关siRNA干扰组和空白对照组区分,采用RT-PCR法检测各组CIAPIN1 RNA水平,选择GAPDH基因为内参照。CIAPIN1引物序列:Forward 5’-CCA GTG GAG GCT CTG AAA GG-3’,Revers e 5’-GAC ACG CGG CCC TCA TT-3’,探针序列 :5’-FAM-ATAAGCTTCAAGCGTTAA C-TAMRA-3’;GAPDH 引物序列:Forward 5’-GGT GGT CTC CTC TGA CTT CAA CA-3’,Reverse 5’-CCAAATTCGTTGTCATACCAGGAA ATG-3’,探针序列:5’-FAM-CGA CAC CCA CTC CTC CAC CTT TGA CGC-TAMRA-3’。根据 Ct值确定对应基因的拷贝数,结果以CIAPIN1基因与内参照基因拷贝数比值表示。上述实验中每组设6孔,取均值。
1.4 细胞CIAPIN1蛋白表达量检测 采用免疫印迹法检测,收集各组细胞,超声破碎后测定蛋白含量,并取一定样品,行聚丙烯酰胺凝胶电泳,电转至PVDF膜,以5%脱脂奶粉在4℃条件下封闭6 h。随后,加入鼠抗人CIAPIN1抗体,在4℃条件下孵育过夜。再加山羊抗鼠IgG-HRP二抗,孵育1 h,以化学发光法检测CIAPIN1蛋白表达量。
1.5 细胞增殖检测 取对数生长期细胞,制备成4×104个/ml单细胞悬液,接种于96孔板,每孔200 μl,每组24孔,进一步将各组分为4个小组,37℃、5%CO2条件下培养,4个小组分别培养24 h、48 h、72 h、96 h,加 5 mg/ml MTT 20μg,继续培养 4 h,弃上清,加 DMSO 150 μl,震荡溶解,在酶标仪上测量490 nm波长下光密度值,以此结果绘制4组细胞生长曲线。
1.6 细胞周期测定 将同步化的各组细胞以PBS洗2次,加入预冷75%乙醇,4℃过夜固定后,弃乙醇,再次以PBS洗,加RNase 100 μg/ml,加碘化丙啶避光染色20 min,上流式细胞仪(FACS Calibur分析型,美国Bio-Rad公司)测定细胞周期。
1.7 其它相关蛋白检测 细胞周期相关蛋白分子包括 cyclinD1、CDK4、CDK2、cyclin E,NF-кB 信号通路相关分子、IKKβ、磷酸化IKBα、p65和磷酸化p65。均提取总蛋白后采用Western blotting法检测。1.8统计学方法 应用SPSS 19.0软件处理数据。CIAPIN1 mRNA及其蛋白的相对水平以(±s)表示,多组间数据的比较采用单因素方差分析及LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 四组细胞CIAPIN1 mRNA及其蛋白表达水平比较 CIAPIN高表达组CIAPIN1 mRNA及其蛋白表达水平较空白对照组或无关siRNA干扰组明显升高(P<0.05);CIAPIN低表达组CIAPIN1 mRNA及其蛋白表达水平较空白对照组或无关siRNA干扰组明显降低(P<0.05);空白对照组与无关siRNA干扰组IAPIN1 mRNA及其蛋白表达差异无统计学意义(P>0.05,表1、图1)。
表1 四组细胞CIAPIN1 mRNA及蛋白表达水平(±s)比较
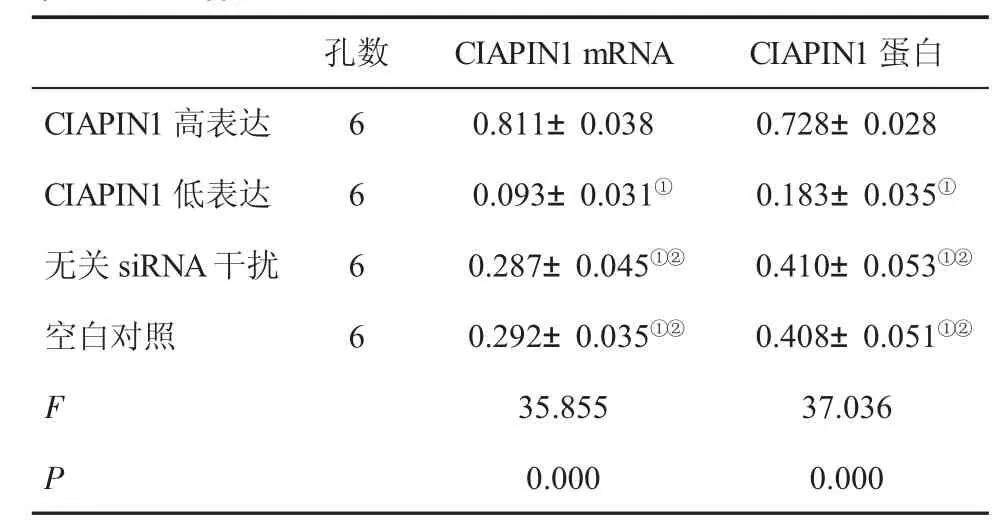
表1 四组细胞CIAPIN1 mRNA及蛋白表达水平(±s)比较
与CIAPIN1高表达组比,①P<0.05;与CIAPIN1低表达组比,②P<0.05
孔数CIAPIN1高表达CIAPIN1低表达无关siRNA干扰空白对照6 6 6 6 CIAPIN1 mRNA CIAPIN1蛋白0.811±0.038 0.728±0.028 0.093±0.031① 0.183±0.035①0.287±0.045①② 0.410±0.053①②0.292±0.035①② 0.408±0.051①②F 35.855 37.036 P 0.000 0.000

A:CIAPIN1 高表达组;B:CIAPIN1 低表达组;C:无关siRNA干扰组;D:空白对照组;GAPDH:甘油醛-3-磷酸脱氢酶

图2 四组细胞增殖情况比较 CIAPIN1高表达组细胞生长旺盛,CIAPIN1低表达组细胞生长受到明显抑制
2.2 四组细胞增殖情况比较 CIAPIN高表达组、无关siRNA干扰组和空白对照组细胞均持续保持良好的生长趋势,而CIAPIN低表达组细胞生长受到明显抑制(图2)。
2.3 细胞周期变化情况 CIAPIN1高表达组S期和G2/M期细胞比例明显高于其他各组,G0/G1期细胞比例明显低于其它各组;CIAPIN1低表达组S期和G2/M期细胞比例明显低于其它各组,G0/G1期细胞比例明显高于其它各组(P<0.05);空白对照组与无关siRNA干扰组比,细胞周期差异无统计学意义(P>0.05,表2)。
表2 细胞周期(n=6,±s)比较
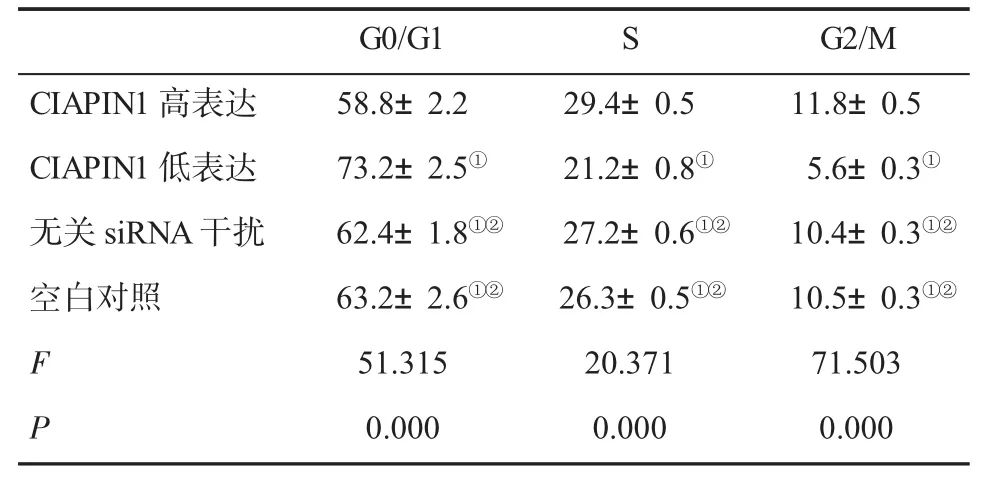
表2 细胞周期(n=6,±s)比较
与CIAPIN1高表达组比,①P<0.05;与CIAPIN1低表达组比,②P<0.05
?
2.4 四组细胞周期蛋白水平比较 CIAPIN1高表达组 cyclinD1、CDK4、CDK2、cyclinE 表达明显强于其它各组;CIAPIN1低表达组上述蛋白的表达明显低于其它各组,差异均有统计学意义(P<0.05,图3)。
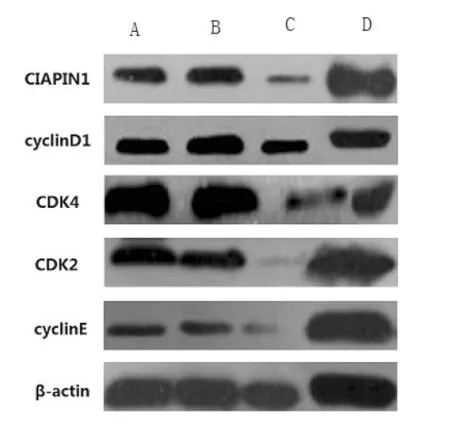
图3 四组细胞周期蛋白水平比较
2.5四组NF-кB信号通路相关分子的表达情况 CIAPIN1高表达组磷酸化IKBα和磷酸化p65表达高于其它各组,CIAPIN1低表达组上述指标低于其它各组,差异均有统计学意义(P<0.05);CIAPIN1低表达组p65水平明显高于其它各组,差异有统计学意义(P<0.05,表3)。
表3 四组NF-кB信号通路相关分子(n=6,±s)表达情况
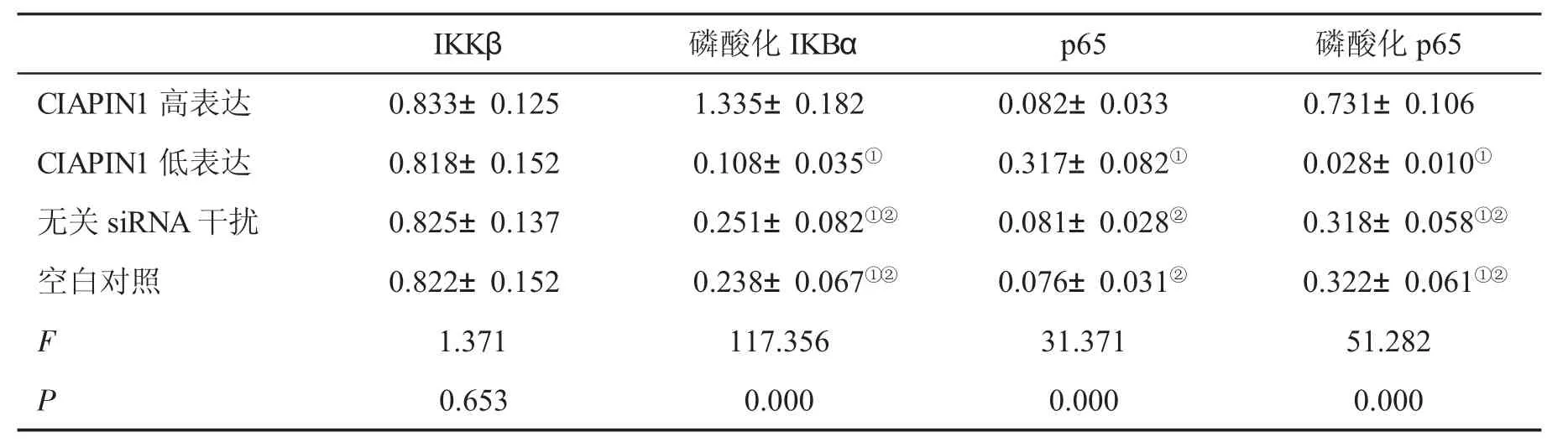
表3 四组NF-кB信号通路相关分子(n=6,±s)表达情况
与CIAPIN1高表达组比,①P<0.05;与CIAPIN1低表达组比,②P<0.05
?
3 讨论
CIAPIN1蛋白在胚胎和成人组织中广泛存在[4-8]。在胎儿的早期血管细胞、干细胞、骨骼肌细胞等影响生长发育的细胞中表达极高,提示其对促进细胞生长发育有重要作用[9];在成人,除上述组织外,胰岛细胞、皮肤角质层细胞、睾丸间质细胞中也能检出其高表达,提示其对维持细胞增殖有重要作用。
目前已有研究探讨了CIAPIN1基因及其蛋白对多种肿瘤细胞的影响,但得出的结论并不完全一致。如杨静等认为CIAPIN1基因在结肠癌组织低表达,可能与结肠癌的发生及发展有关,并指出抑制该基因的表达可能是靶向性治疗结肠癌的新方向。研究发现下调CIAPIN1 mRNA有助于抑制慢性髓系白血病细胞系K562细胞的增殖能力,说明CIAPIN1 mRNA高水平可能与K562细胞的增殖有关。肝癌组织CIAPIN1 mRNA水平越高,肿瘤分化程度越低,TNM分期越高,提示其高表达与肿瘤恶化有关[3]。
本研究重点探讨了CIAPIN1对HepG2增殖的影响,结果显示其能促进肿瘤细胞增殖,细胞在G1/S期明显缩短,而下调其表达,肿瘤细胞增殖能力明显受抑制,细胞被阻滞在G1/S期,说明其对肝癌细胞的生物学影响是促进其增殖能力。
本研究观察到CIAPIN1过表达组细胞周期相关蛋白 cyclinD1、CDK4、CDK2、cyclinE 均明显上升,且磷酸化IKBα、磷酸化p65表达也明显上升,提示CIAPIN1蛋白主要通过上调细胞周期蛋白、激活NF-кB通路等途径影响肝癌细胞的增殖。已有多项研究证实NF-кB信号通路直接参与了肝癌的发生发展,干扰NF-кB信号通路活化能够通过促细胞凋亡和改变细胞周期机制,抑制肝癌细胞的增殖。另有研究认为CIAPIN1基因还与肿瘤的血管形成和肿瘤多药耐药性形成等有明显的相关性。
[1]Nymoen DA,Holth A,Hetland Falkenthal TE,et al.CIAPIN1 and ABCA13 are markers of poor survival in metastatic ovarian serous carcinoma.Mol Cancer,2015,18(14):44.
[2]Wang XM,Gao SJ,Guo XF,et al.CIAPIN1 gene silencing enhances chemosensitivity in a drug-resistant animal model in vivo.Braz J Med Biol Res,2014,47(4):273-278.
[3]杨芳,吕立志,蔡秋程,等.RhoGDI2和CIAPIN1在肝癌组织中的表达及其临床病理意义.现代生物医学进展,2016,16(34):6652-6655.
[4]姚敏,顾星,王理,等.肝癌患者核因子-κB异常表达及转录干预对多药耐药的逆转效果.中华医学杂志,2016,96(10):761-766.
[5]吕永祥,郑伟.腹腔镜肝切除联合微波消融治疗肝细胞癌患者疗效及安全性评价. 实用肝脏病杂志,2016,19(6):692-695.
[6]张平平,汪培钦,陈岳祥,等.核因子-κB与肝癌发展关系的研究进展. 中华消化杂志,2014,34(1):65-67.
[7]李曼妮,刘建平,陶永胜,等.miR-185对肝癌细胞增殖、凋亡的影响及机制. 山东医药,2016,56(41):10-13.
[8]刘丽璇,吴灵飞,邓巍,等.丹参酮IIA对低氧条件下人肝癌HepG2细胞增殖、凋亡的影响及与HIF-1α、VEGF和野生型P53蛋白表达的关系.中国病理生理杂志,2014,30(12):2155-2160.
[9]张猛,张全,谭雨莎,等.miR-497靶向Bcl-2调控肝癌细胞增殖及凋亡的研究. 中国肿瘤临床,2016,43(16):697-701.

