HPLC法测定喹乙醇预混剂中喹乙醇的含量
周芷锦,包爱情,陆春波,林仙军,陈晓林(浙江省兽药饲料监察所,杭州311101)
喹乙醇是1965年由法国拜耳Bayer公司首先发现了它对动物的促进生长作用,于70年代开发的生长促进剂[1]。由于喹乙醇较强的促生长作用,喹乙醇一度被广泛使用。但研究表明喹乙醇有中度至显著的蓄积毒性,对大多数动物有明显的致畸作用,对人也有潜在的致畸形、致突变和致癌作用[2-3],因此喹乙醇在美国和欧盟都被禁止用作饲料添加剂,《中国兽药典兽药使用指南》2010版[4]也明确规定喹乙醇及其制剂不得用于水产养殖。农业部第168号公告[5]中也作了严格规定,规定喹乙醇只能用于体重低于35千克的猪,禁止用于家禽及水产养殖。
目前喹乙醇的检测方法有ELISA[6]、UPLC[7]、LC-MS/MS[8],均应用于饲料中喹乙醇及动物性食品中喹乙醇残留量的检测;吴宁鹏[9]等报道的兽药中非法添加喹乙醇HPLC-PDA方法的建立则侧重在兽药中非法添加喹乙醇检测方法的开发,尚无使用高效液相色谱法测定喹乙醇预混剂中喹乙醇的含量的报道。
喹乙醇预混剂收录于《中国兽药典》2010版一部[10],采用紫外分光光度法测定含量,紫外分光光度法具有便捷、准确等优点,但专属性不强,易受其他化合物影响。
因此,本文研究开发了高效液相色潽法测定喹乙醇预混剂中喹乙醇含量的方法。试验结果表明该方法简便、准确可靠、重现性好,能够有效地控制该产品的质量。
1 材 料
1.1 仪器 Waters 2695 高效液相色谱仪,配二极管阵列检测器,美国Waters公司; TU-1810紫外分光光度仪,北京普析通用仪器有限责任公司;XS-205电子天平,瑞士Mettler Toledo公司;KQ-500E型超声波清洗器,昆山市超声仪器有限公司。
1.2 试剂与材料 乙腈、甲醇为色谱纯,Merck KGaA 公司;其余试剂为分析纯;实验用水为milli-Q 超纯水。喹乙醇对照品(中国兽医药品监察所,批号:H0061103,含量:99.5%);喹乙醇预混剂供试品(批号分别为20160101,20160102和20160103,规格均为5%),由A厂生产;喹乙醇预混剂供试品(批号为201611182,规格为50%),由B厂生产。喹乙醇预混剂供试品(批号为1630101,规格为50%),由C厂生产。
2 方法与结果
2.1 色谱条件 色谱柱:Waters Symmetry C18柱(4.6 mm×250 mm,5 μm);流动相:0.02 mol/L磷酸二氢钾溶液(用三乙胺调pH为6.0)-乙腈(92∶8,V∶V);流速:1.0 mL/min;温度:30 ℃;检测波长:262 nm;进样量:10 μL。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取喹乙醇对照品约50 mg,置100 mL棕色量瓶中,加N,N-二甲基甲酰胺12 mL,振摇约1 min,加入1 mol/L盐酸溶液12 mL,超声5 min,冷却至室温,加水稀释至刻度,作为对照品储备液(约500 μg/mL)。精密量取适量,用流动相稀释成50 μg/mL的对照品溶液,即得。
2.2.2 供试品溶液 取喹乙醇预混剂适量(约相当于50 mg喹乙醇),精密称定,置100 mL棕色量瓶中,加N,N-二甲基甲酰胺12 mL,振摇约1 min,加入1 mol/L盐酸溶液12 mL,超声5 min,冷却至室温,加水稀释至刻度,过滤,精密量取续滤液5 mL,置50 mL棕色量瓶中,用流动相稀释至刻度。
2.2.3 阴性对照溶液 按处方比例制备不含喹乙醇的阴性对照样品,再按2.2.2方法制备成阴性对照溶液。
2.3 系统适应性试验 分别取对照品溶液、供试品溶液、阴性对照溶液注入液相色谱仪,进行200~400 nm波长扫描,记录喹乙醇的光谱图(图1);同时记录对照品、样品、阴性样品的色谱图(图2)。该色谱条件下,喹乙醇峰型较好,理论塔板数大于10000。阴性样品在混合对照品色谱图相应的位置上无吸收峰,表明处方中的其他辅料对测定结果并无干扰,满足定量检测需要。
2.4 方法学考察
2.4.1 线性范围 精密量取喹乙醇对照品贮备溶液(约500 μg/mL)适量,用流动相稀释成5、10、20、50、100 μg/mL的系列对照品溶液,按上述色谱条件,精密量取10 μL,注入色谱仪,记录色谱图,测定峰面积,以峰面积积分值(Y)对浓度(X,μg/mL)进行线性回归计算,方程为:Y=60928X+8480(R2=1.0000),线性范围5~100 μg/mL。结果表明在线性范围内,喹乙醇浓度与峰面积呈现良好的线性关系。
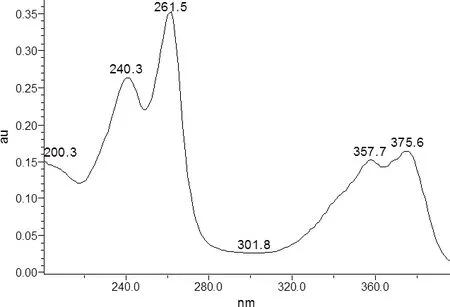
图1 对照品光谱图Fig 1 The spectrogram of olaquindox
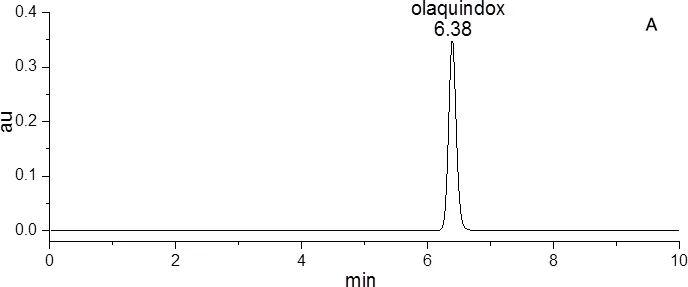
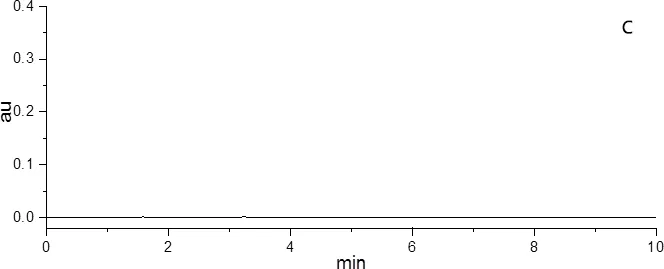
图2 对照品(A)、样品(B)和阴性样品(C)的色谱图Fig 2 The chromatogram of the reference substances(A), the sample(B)and the negative sample(C)
2.4.2 精密度试验 精密吸取对照品溶液(50 μg/mL)10 μL,按上述色谱条件,连续重复进样6次,记录峰面积,计算结果,喹乙醇峰面积的RSD为0.3%,表明仪器精密度良好。
2.4.3 稳定性试验 取同一供试品溶液(批号201611182),分别在0、1、2、4、6、8、12、24 h进样10 μL,记录色谱峰面积,计算喹乙醇峰面积的RSD为0.6%。结果表明供试品溶液在室温下放置24 h稳定。
2.4.4 重复性试验 取同一批供试品(批号201611182),分别称取6份,照2.2.2项下方法制备供试品溶液,测定供试品溶液中喹乙醇的含量。结果测得喹乙醇的含量分别为518.6、510.4、507.9、507.1、508.1、513.9 mg/g;RSD为0.9%。结果表明此方法重复性良好。
2.4.5 加样回收率试验 精密称取已知含量的喹乙醇预混剂(批号201611182,含量503.7 mg/g) 50 mg,各6份,置100 mL棕色量瓶中,按照80%,100%和120%三个水平,分别精密加入20 mg、25 mg、30 mg喹乙醇对照品,其余按2.2.2项同法处理后,测定并计算回收率,结果见表1。

表1 回收率试验结果(n=6)Tab 1 Results of recovery tests (n=6)
2.4.6 耐用性 研究比较了Waters Symmetry(4.6 mm×250 mm,5 μm)C18柱和Aglinet XDB(4.6 mm×250 mm,5 μm)C18柱,结果表明两者均完全满足喹乙醇预混剂的含量测定;对流动相pH值进行了考察,将水相用三乙胺调节pH至5.7,6.0和6.3进行试验,结果表明pH微小变化基本不产生影响;对温度进行了考察,选择25 ℃,30 ℃和35 ℃进行试验,结果表明温度仅能影响出峰时间,对峰形和理论板数均无显著影响;对流动相有机相比例进行考察,调整有机相∶水相为91∶9,92∶8和93∶7(V∶V),结果表明除出峰时间有微小变化外无显著差异。综上所述,建立的方法具有较好的耐用性。
2.5 实际样品测定 取不同批号的喹乙醇预混剂,按2.2.2项下方法处理,按上述色谱条件进行测定,计算样品中喹乙醇的含量,并与《中国兽药典》2010年版一部紫外方法进行比较,结果见表2。表中除批号为1630101的样品外,其余几批紫外分光光度法与液相法结果基本一致。而批号为1630101的样品正是由于添加了喹烯酮,导致使用紫外分光光度法检测时,喹烯酮与喹乙醇信号叠加,增强了响应,该研究已经由陆春波等人[11]发表论文做了专门的研究,在此不再赘述。
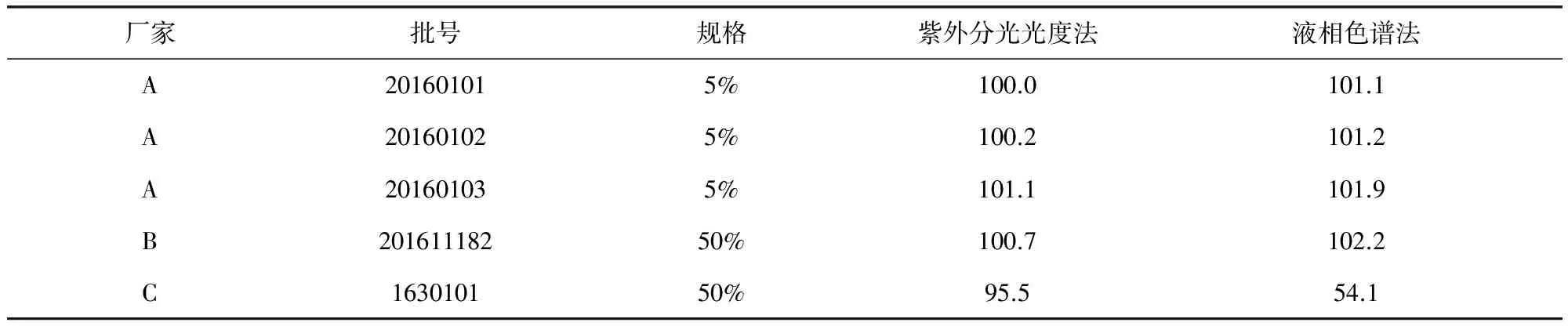
表2 样品含量测定结果(标示量/%,n=5)Tab 2 Results of content determination of samples (labelled amount/%, n=5)
3 讨论与小结
3.1 方法条件优化
3.1.1 波长的选择 在波长选择上,通过二极管阵列检测器(DAD)在200~400 nm进行了全扫描,结果显示喹乙醇在261.5 nm和375.6 nm的波长处有最大吸收(图1),且261.5 nm波长处响应更大,因此采用262 nm作为检测波长。
3.1.2 提取溶剂的选择 在提取溶剂上,因为喹乙醇在甲醇等常用溶剂中溶解性差,在N,N-二甲基甲酰胺中溶解性较好,且部分喹乙醇预混剂中含碳酸钙等辅料,因此沿用《中国兽药典》2010年版一部,使用N,N-二甲基甲酰胺和1 mol/L盐酸溶液提取样品。
3.1.3 流动相的选择 比较了水-甲醇(90∶10),水-乙腈(90∶10),0.02 mol/L磷酸二氢铵溶液-乙腈(90∶10)等流动相,结果表明上述流动相均导致喹乙醇峰峰形不够尖锐,在优化的流动相下,喹乙醇峰峰形尖锐,理论板数高,因此选用研究优化的流动相。
3.2 小结 研究建立了HPLC法测定喹乙醇预混剂中喹乙醇的方法。原标准采用紫外分光光度法测定,虽然具有简便高效的优势,但专属性较差,易受其他化合物干扰,液相方法则较好地解决了该问题。检测到一批采用紫外方法测定合格而用试验方法测定不合格的样品,充分说明开发液相方法的必要性。在合格样品的测定上,建立的方法与原紫外分光光度法相比,结果基本一致,且方法专属性强、简便、准确、重现性好,能够有效地控制该产品的质量。
[1] Linton A H, Hedges A J, Bennett P M. Monitoring for the development of antimicrobial resistance during the use of olaquindox as a feed additive on commercial pig farms[J]. The Journal of Applied Bacteriology, 1988, 64(4): 311-327.
[2] Chen Q, Tang S, Jin X, Zou J,etal. Investigation of the genotoxicity of guinocetone, carbadox and olaquindox in vitro using vero cells[J]. Food and Chemical Toxicology. 2009, 47(2): 328-334.
[3] Zou J J, Chen Q, Jin X,etal. Olaquindox induces apoptosis through the mitochondrial pathway in HepG2 cells[J]. Toxicology,2011,285(3): 104-113.
[4] 中国兽药典委员会. 中华人民共和国兽药典兽药使用指南 2010年版化学药品卷[S].
Commission of Chineses Veterinary Pharmacopoeia. Guide to Utilization of Veterinary Drug in Veterinary Pharmacopoeia of People's Republic of China, 2010, Chemical Medicine Volume.
[5] 农业部.农业部第168号公告[S].
Ministry of Agriculture. No.168 Bulletin of The Ministry of Agriculture of The Pepole's Republic of China[S].
[6] 何方洋, 郗日沫, 冯才伟, 等. 喹乙醇药物ELISA检测方法的建立[J]. 畜牧与兽医, 2011, 43(6): 56-60.
He F Y, Xi R M, Feng C W,etal. Determination of olaquindox by ELISA[J]. Animal Busbandry & Veterinary Medicine, 2011, 43(6): 56-60.
[7] 刘 淳.超高效液相色谱测定猪肉中喹乙醇的残留量[J]. 分析仪器, 2015, (2): 44-47.
Liu C. Determination of olaqunindox residue in pork by ultra high performance liquid chromatography[J]. Analytical Instrumentation, 2015, (2): 44-47.
[8] 易锡斌, 裘立群, 刘世琦, 等. 液相色谱-串联质谱同时测定禽肉组织中盐酸金刚烷胺、盐酸金刚乙胺、地塞米松、替米考星及喹乙醇代谢物的残留量[J]. 分析测试学报, 2015, 34(3): 346-351.
Yi X B, Qiu L Q, Liu S Q,etal. Simultaneous determination of amantadine hydrochloride, rimantadine hydrochloride, dexamethasone, tilmicosin and olaquindox metabolite residues in poultry tissues by high performance liquid chromatography coupled with tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2015, 34(3): 346-351.
[9] 吴宁鹏, 王丽景, 李慧素, 等. 五种兽药中非法添加喹乙醇和乙酰甲喹的HPLC-PDA:检测方法的建立[J]. 中国兽药杂志,2014, 48(12): 43-49.
Wu N P, Wang L J, Li H S,etal. Determination of olaquindox and mequindox illegally added in five kinds of veterinary drug by HPLC-PDA[J]. Chinese Journal of Veterinary Drug, 2014, 48(12): 43-49.
[10] 中国兽药典委员会. 中华人民共和国兽药典 2010年版一部[S].
Commission of Chineses Veterinary Pharmacopoeia. Veterinary Pharmacopoeia of People's Republic of China, 2010 edition, Part1[S].
[11] 陆春波, 高三玉, 罗成江, 等. HPLC-DAD法检测喹乙醇预混剂中违规添加喹烯酮的研究[J]. 中国兽药杂志, 2017, 51(3): 61-64.
Lu C B, Gao S Y, Luo C J,etal. Determination of quinocetone into olaquindox premix by HPLC-DAD[J]. Chinese Journal of Veterinary Drug, 2017, 51(3): 61-64.

