柴黄口服液长期毒性试验研究
刘 静,刘 欣,魏丽娟,宋婷婷,瞿红颖,贾 兴,耿智霞,魏占勇*,史万玉(1.河北远征药业有限公司,石家庄,050041;2.河北省兽药工程技术研究中心,石家庄 050041;.河北农业大学,河北保定,071000)
柴黄口服液临床上主要用于预防高温、高湿引起的家禽发热、精神不振、食少[1]。为了考察柴黄口服液临床上长时间应用的安全性,对该制剂进行了长期毒性试验研究[2]。试验通过将柴黄口服液在一定时间内高剂量给试验动物反复饮喂,观察动物出现损害的靶组织或靶器官及剂量效应关系,了解试验动物对柴黄口服液能够耐受的剂量范围,从而为评价柴黄口服液能否安全应用于临床提供科学依据,以保证用药安全。
1 材 料
1.1 试验动物 4周龄清洁级Wistar大鼠160只,雌雄各半,体重60±10 g,购自河北医科大学试验动物中心(合格证编号1411023;1606022)。大鼠购入后观察饲养一周,投入试验。
1.2 药物及试剂 柴黄口服液:河北远征药业有限公司生产的中试产品(含量:每mL相当于柴胡0.5 g、黄芩0.5 g,制法:以上二味,黄芩加水煎煮二次,每次1 h,合并煎液,滤过,滤液加硫酸调节pH值至2.0,静置,滤取沉淀,用乙醇适量洗涤后干燥,备用;柴胡用水蒸气蒸馏法提取挥发油;蒸馏后的水溶液与药液加水煎煮二次,第一次2 h,第二次1 h,合并煎液,滤过,滤液浓缩至相对密度为1.16~1.24(60 ℃),加入乙醇使含醇量达60%,搅匀,冷藏24 h,滤过,滤液回收乙醇,得相对密度为1.14~1.16(60 ℃)的浓缩液;加入上述黄芩提取物,调节pH值至5.6~5.8,加水至约900 mL,冷藏48 h,加入柴胡挥发油,滤过,加入蔗糖150 g,苯甲酸钠3 g,加水调至1000 mL,搅匀,灌装,即得。批号:151121)门冬氨酸氨基转移酶试剂盒(产品批号1400823)、丙氨酸氨基转移酶试剂盒(产品批号140318)、尿素氮试剂盒(产品批号140818)、肌酐试剂盒(产品批号140625)、血清白蛋白测定试剂盒(产品批号151203)、总蛋白测定试剂盒(产品批号160211)、总胆固醇测定试剂盒(产品批号151203)、血糖测定试剂盒(产品批号160521)、甘油三酯试剂盒(产品批号151203)等购于北京北化康泰临床试剂有限公司。
1.3 仪器 BC-2800Vet兽用全自动血液细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;A-6半自动生化分析仪:北京松上技术有限公司;721型分光光度计,上海第三分析仪器厂制造;OLYMPUS生物显微镜:日本制造;KD-202轮转式切片机:浙江省金华市科迪仪器设备有限公司;电子天平 型号:Precisa 92SM-202A。
2 方 法
2.1 试验动物及给药方法选择 由于新兽药在临床实际应用中,需要在鸡的饮水中连续添加超过1周,所以将试验的给药周期定为90 d;给药方法理应灌胃给药,但考虑到长达90 d的灌胃难以确保不对大鼠食道及胃造成损伤,同时巨大的应激也会影响试验结果。经前期预试验发现,在不显著影响大鼠饮水量的前提下,柴黄口服液在大鼠饮水中最大可以加到8%(即80 mL/L),故最后确定以饮水方式给药,最大剂量定为80 mL/L(即临床推荐剂量的80倍)。
2.2 试验分组 体重75±10 g Wistar大鼠160只,雌雄各半,随机分为4组(3个剂量药物组及对照组),每组40只,雌雄各20只,分笼饲养,每笼5只。
2.3 试验剂量及给药方式 依据《兽药研究技术指导原则汇编》兽药90 h喂养试验指导原则要求,试验设置高、中、低三个剂量以及一个空白对照组,其中高剂量为推荐临床用药量(即1 mL/L饮水)的80倍,即在饮水中加80 mL/L柴黄口服液;中剂量为推荐临床用药量的40倍,即在饮水中加40 mL/L柴黄口服液;低剂量为推荐临床用药量的20倍,即在饮水中加20 mL/L柴黄口服液。给药周期为90 d,将药物混于饮水中自由饮用,采食不限[3]。
2.4 观察指标与测定方法
2.4.1 临床表现 每天观察各组大鼠的活动、采食、饮水及发病情况。包括被毛是否贴身或稀疏竖散,是否神态萎靡、蜷缩不动、过度兴奋、躁动惊跳、肌肉麻痹或震颤、步态异常。出现中毒反应的大鼠取出单笼饲养,发现死亡或濒死大鼠时在1 h内尸检。
2.4.2 体重及饲料利用率 分别于给药30 d和90 d末对各组大鼠进行称重,比较其体重变化情况。同时全程记录各组饲料消耗量,计算各组饲料利用率[4]。
2.4.3 血液学检查 于给药30 d和90 d末,每组随机选取20只大鼠(雌雄各半)摘眼球采血,用全自动血液细胞分析仪测定白细胞计数及分类、红细胞计数、血红蛋白含量测定。
2.4.4 血液生化学检查 于给药30 d和90 d末,每组随机选取20只大鼠(雌雄各半)摘眼球取血,分离血清,用试剂盒测定AST、ALT、BUN、CRE、 ALB、TP、CHOL、GLU、TG等血液生化指标[5]。
2.4.5 脏器指数 上述于30 d和90 d末摘除眼球取血的大鼠,在取血前先称重,取血后剖检,称量心、肝、脾、肾、肺的重量,计算各脏器指数。称量前用滤纸吸干表面水分。
脏器指数=脏器湿重(g)/体重(g)×100
2.4.6 组织学检查 对照组和高剂量组的试验大鼠及尸检异常的试验大鼠要详细检查,其它剂量组的试验大鼠在高剂量组检查有异常时检查。受检的脏器为:心、肝、脾、肺、肾、胃、小肠、卵巢、睾丸[6-7]。
2.5 数据处理 用SPSS11.5进行单因素方差分析,采用多个试验组和一个对照组间的两两比较方法统计。
3 结 果
3.1 临床表现变化情况 在整个试验过程观察并记录了高、中、低剂量试验组和对照组大鼠的毛色洁净度,四肢、眼和瞳孔、摄食、饮水,粪便以及皮肤有无过敏反应。结果均未见异常。且整个试验过程所有大鼠未出现死亡和中毒性临床症状。
3.2 动物的体增重及饲料利用率测定结果 由表1结果可以看出,柴黄口服液以低(20 mL/L)、中(40 mL/L)、高(80 mL/L)剂量给大鼠饮水。各组于1~30 d及30~90 d期间,无论雌性大鼠还是雄性大鼠,各试验组大鼠的平均增重和饲料利用率均与对照组无显著差异(P>0.05)。
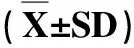
表1 柴黄口服液对大鼠增重、耗料量及饲料利用率的影响Tab 1 The effect that Chai huang oral liquid is on the weight gain of rats、the feed consumption and on the feed conversion ratio(±SD)
同一列标记不同小写字母代表差异显著(P<0.05);无不同字母代表差异不显著(P>0.05)
The same column follow by the different small letter are significantly different (P<0.05). The same column follow by the same small letter are not significantly different (P>0.05).
3.3 大鼠主要脏器指数的测定结果 柴黄口服液以20 mL/L、40 mL/L、80 mL/L剂量加入大鼠饮水中饮喂,连续饮喂30 d和90 d后,分别捕杀受试鼠,称量主要脏器,计算脏器指数,结果详见表2。
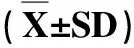
表2 大鼠主要脏器指数测定结果Tab 2 Measured results of the main viscera index in rats(±SD)
同一列标记不同小写字母代表差异显著(P<0.05) ;无不同字母代表差异不显著(P>0.05)
The same column follow by the different small letter are significantly different (P<0.05). The same column follow by the same small letter are not significantly different (P>0.05).
由表2可知,饲养试验开始30 d后各剂量组大鼠的主要脏器指数与对照组比较均无显著差异(P>0.05),各剂量组之间也差异不显著(P>0.05)。90 d后各剂量组大鼠的主要脏器指数与对照组比较均无显著性差异(P>0.05),各剂量组之间也差异不显著(P>0.05)。说明长时期饲喂柴黄口服液对大鼠的主要脏器指数均无明显不良影响。
3.4 试验大鼠血液常规指标结果 由表3可知,给药一个月后各试验组与对照组的白细胞数、红细胞数和血红蛋白含量以及白细胞分类均差异不显著(P>0.05),各试验组之间的血常规指标也均无显著差异(P>0.05)。给药三个月后各试验组与对照组的白细胞数、红细胞数和血红蛋白含量以及白细胞分类均差异不显著(P>0.05),各试验组之间的血常规指标也均无显著差异(P>0.05)。说明长期喂柴黄口服液对大鼠的血液学指标无明显不良影响。
3.5 试验动物血液生化指标检测结果 由表4、表5可以看出,在大鼠饮水中分别加入20 mL/L、40 mL/L、80 mL/L 的柴黄口服液,连续30 d和90 d后,试验组的门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、尿素氮(BUN)、肌酐(CRE)、血清白蛋白(ALB)、总蛋白(TP)、总胆固醇(CHOL)、血糖(GLU)和甘油三酯(TG)的含量均与对照组差异不显著(P>0.05 ),且各试验组各剂量水平之间差异也不显著(P>0.05),说明长期饲喂柴黄口服液对大鼠的肝肾等功能均无明显不良影响。
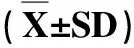
表3 大鼠血液常规指标测定结果Tab 3 Measured Results of routine blood test in rats
RBC:红细胞总数,WBC:白细胞总数,Hb:血红蛋白,Lymph(%):淋巴细胞百分率,Mon(%):单核细胞百分率,Gran(%):中性粒细胞百分率。同一列标记不同小写字母代表差异显著(P<0.05) ;无不同字母代表差异不显著(P>0.05)
RBC:Total number of erythrocyte, WBC:Total number of leucocytes, Hb:Hemoglobin, Lymph(%): Lymphocyte percentage, Mon(%):Monocyte percentage, Gran(%). Neutrophilic granulocyte percentage. The same column follow by the different small letter are significantly different (P<0.05). The same column follow by the same small letter are not significantly different (P>0.05).
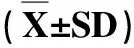
表4 大鼠30 d末血液生化指标测定结果Tab 4 Measured results of the blood biochemical indexes in rats on 30 d
AST:门冬氨酸氨基转移酶;ALT:丙氨酸氨基转移酶;BUN:血尿素氮;CRE:肌酐;ALB:血清白蛋白;TP:总蛋白;CHOL:总胆固醇;GLU:血糖;TG:甘油三酯。同一列标记不同小写字母代表差异显著(P<0.05) ;无不同字母代表差异不显著(P>0.05)
AST: Aspartate aminotransferase. ALT: alanine aminotransferase. BUN: blood urea nitrogen. CRE: creatinine. ALB: serum albumin. TP: total protein. CHOL: total cholesterol. GLU: blood glucose. TG: triglyceride. The same column follow by the different small letter are significantly different (P<0.05); the same column follow by the same small letter are not significantly different (P>0.05)
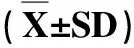
表5 大鼠90 d末血液生化指标测定结果Tab 5 Measured results of the blood biochemical indexes in rats on 90 d
同表4
3.6 各组大鼠剖检变化观察结果 试验结束时对各组大鼠进行捕杀剖检,肉眼进行病理学观察。主要观察心、肝、脾、肺、肾等主要脏器的外形、体积、色泽是否正常,有无充血、出血、肿胀和坏死等异常现象。结果发现,各用药组与不用药对照组大鼠的心、肝、脾、肺、肾等主要脏器均未见任何异常。表明,柴黄口服液即使连续90 d的给药,也未见对大鼠主要脏器外观形态造成明显不良影响。
3.7 病理组织学检查结果 取高剂量组和不用药对照组大鼠的心、肝、脾、肺、肾、胃、小肠、卵巢、睾丸等脏器以福尔马林固定,石腊切片,镜检各脏器的组织学结构变化。结果发现,高剂量组与不用药对照组大鼠的心、肝、脾、肺、肾、胃、小肠、卵巢及睾丸组织学结构清楚,均未见明显异常。
检查结果表明,长期毒性试验过程中,柴黄口服液对大鼠主要脏器的组织结构均未造成明显不良影响。
4 讨论与小结
黄伟等[8]研究表明 ,长时间给予一定剂量的柴胡总皂苷醇洗脱精制品可造成对大鼠明显的蓄积毒性,其毒性损伤部位以肝、肾损伤为主,经过30 d恢复期观察,其脏器损伤基本可恢复。给大鼠灌服不同剂量的柴胡总皂苷粗提物,各剂量组大鼠在药后15 d肝毒性表现已非常明显,21~30 d维持较高损伤水平,具体表现为随给药时间的延长,同一剂量的大鼠血清ALT,AST值升高显著,肝/体比值增大,肝组织病理形态学的改变加重。刘芳等[9]研究报道,灌胃(0.19~0.42)mL/kg的柴胡挥发油均可导致大鼠肝毒性损伤,随着给药剂量增大,肝毒性损伤程度明显增加。柴胡挥发油所致大鼠肝毒性在呈现一定的“量-效”关系的基础上还呈现一定的“时-效”关系,给药7 d高剂量组即可发生明显的肝毒性,给药15~21 d肝毒性表现明显,并开始出现死亡,给药30 d后大鼠死亡增加,并出现了其它一些继发毒性。上述结果表明柴胡挥发油致大鼠肝毒性损伤的剂量范围是(0.19~0.42)mL/kg,相当于生药量(92.6~204.7)g/kg。佟继铭等[10]研究了大鼠长期口服黄芩茎叶总黄酮产生的毒性反应及其严重程度,结果,大鼠用药90 d时2.0 g/kg总黄酮组大鼠RBC高于羧甲基纤维素钠对照组,停药14 d恢复正常。其它组大鼠的各项指标均无异常改变,也未发现迟发性毒性反应,说明黄苓茎叶总黄酮毒性较低。
赵世萍等[11]研究了柴黄益肾方提取物(CYE)对大鼠的长期毒性,将大鼠随机分为4个组,3个剂量组分别为8.8、4.4、2.2 g/kg,连续灌胃给予CYE6个月,对照组给予同体积生理盐水。停药后继续观察4周,测试大鼠体重、血液学指标、血液生化学指标、脏器指数及病理组织学变化。结果:高剂量组大鼠体重增长缓慢,3个剂量组与红细胞相关指标与对照组比较小幅下降,尿素氮与对照组比较小幅上升,高中剂量组肝脏指数小幅上升,与对照组比较有显著性差异,以上改变均在正常生理范围之内。说明,CYE在临床推荐剂量下有一定的安全性。
试验通过将柴黄口服液在一定时间内高剂量给试验动物反复饮喂,观察动物出现损害的靶组织或靶器官及剂量效应关系,并了解试验动物对柴黄口服液能够耐受的剂量范围,从而为评价柴黄口服液能否安全应用于临床提供科学依据,以保证用药安全。柴黄口服液的长期毒性试验为期90 d,主要从一般指标、增重及饲料利用、脏器指数、血液学常规、血液生化学检查及组织病理学等六方面观察该药对大鼠的慢性毒性反应。试验结果显示无论30 d末还是90 d末,受试药物三个剂量组的上述各项指标测定结果均与对照组无显著差异(P>0.05),该药对试验动物大鼠未见明显毒性反应,说明柴黄口服液无明显毒性,在临床上应用是安全的。
[1] 段文龙, 梁先明. 兽药研究技术指导原则汇编(2006-2011年)[M]. 北京:化学工业出版社,2013: 3.
Duan W L,Liang X M. A compilation of technical guidelines for veterinary drug research(2006-2011)[M].Beijing:Chemical Industry Press,2013: 3.
[2] 中华人民共和国农业部[Z]. 饲料安全性评价—亚急性毒性试验.
Promulgated by the Ministry of agriculture of the people's Republic of China[Z]. Food safety evaluation-subacute toxicity test.
[3] 兽药试验技术规范汇编[Z]. 2001: 5.
The office of the veterinary drug review Committee of the Ministry of agriculture[Z]. A compilation of veterinary drug test technical specifications. 2001: 5.
[4] 胡元亮主编.中药饲料添加剂的开发与利用[M]. 北京:化学工业出版社, 2005: 8.
Hu Y L. Development and utilization of Chinese herb feed additives[M]. Beijing: Chemical Industry Press, 2005: 8.
[5] 李建科, 卢健雄, 杨具田,等.甘肃棘豆饲喂大鼠的亚慢性毒性试验的血液学分析[J]. 中兽医医药杂志,1996,(3):6-9.
Li J K,Lu J X,Yang J T,etal. Hematological analysis of subchronic toxicity test in rats fed by Gansu acanth [J]. Chinese journal of veterinary medicine, 1996,(3):6-9.
[6] 许巧丽, 王加才, 张宗和,等. N,O-羧甲基壳聚糖对大鼠的亚慢性毒性试验[J]. 畜牧与兽医,2006,(38) 9:40-43.
Xu Q L,Wang J C,Zhang Z H,etal. N, The chronic toxicity test of N,O-carboxymethyl chitosan on the rat[J]. Animal Husbandry & Veterinary Medicine , 2006,(38) 9:40-43.
[7] 王新春, 郭淑丽, 杨竞春,等. 愈痹丸亚慢性毒性实验研究[J]. 中国医师杂志.2003,(5)4:566-568.
Wang X C,Guo S L,Yang J C,etal. The experimental study on the chronic toxicity of bi - bi pills[J]. Chinese Journal of physician, 2003,(5)4:566-568.
[8] 黄 伟, 刘芬娣, 孙 蓉. 柴胡总皂苷醇洗脱精制品对大鼠长期毒性研究[J]. 中国实验方剂学杂志, 2011, (2) : 213-218.
Huang W,Liu F D,Sun R. The experimental study on the chronic toxicity of Chaihu total saponin alcohol eluting refined products[J]. Chinese Journal of Experimental Chinese Medicine,2011, (2) : 213-218.
[9] 刘 芳, 李兰芳, 刘广杰,等. 黄芩水、醇提液急性毒性实验研究[J]. 河北中医, 2014, (3):425-427.
Liu F,Li L F,Liu G J,etal.The research that the acute toxicity experiment of the radix scutellariae water extract and the radix scutellariae alcohol extract[J]. Hebei Journal of Traditional Chinese Medicine,2014,(3):425-427.
[10] 佟继铭, 刘玉玲, 符景春. 黄芩茎叶总黄酮长期毒性研究[J]. 承德医学院学报, 1999,(01):11-13.
Tong J M,Liu Y L,Fu J C.The Long-term toxicity studies of scutellaria baiculensis stem-leaf total flavonoid[J]. Journal of Chengde Medical College,1999,(1):11-13.
[11] 赵世萍, 李 平, 潘 琳,等. 柴黄益肾方提取物的长期毒性实验研究[J]. 中日友好医院学报, 2006, (5):287-290.
Zhao S P,Li P.Pan L,etal. The Long-term toxicity studies of the Chaihuang Yishen extract[J]. Journal of China-japan Friendship Hospital,2006,(5):287-290.

