兔支气管败血波氏杆菌的分离鉴定及耐药性分析
牛江婷,方 词,伊淑帅,张 双,何羽扬,董国英,胡桂学*(.吉林农业大学动物科学技术学院,长春 308;.北京师范大学全球变化与地球系统科学研究院,北京 00875)
支气管败血波氏杆菌(Bordetellabroncbispetica,Bb)与百日咳杆菌(Bordetellapertussis,Bp)、副百日咳杆菌(Bordetellaparapertussis,Bpp)同属于波氏杆菌属,是一种寄生在人、哺乳动物或家禽呼吸道上皮纤毛上的革兰阴性短杆菌,感染后主要引起呼吸系统疾病,严重者可导致急性死亡[1-2]。兔的波氏杆菌病是由兔支气管败血波氏杆菌(又称为兔博德特氏杆菌)引起的一种以鼻炎、支气管肺炎以及脓疱型肺炎为主要临床症状的呼吸道传染病,常与兔多杀性巴氏杆菌、葡萄球菌以及链球菌混合感染,造成养殖场兔群的急性发病和大量死亡[3-4]。近年来,随着集约化家兔养殖业的发展以及家兔引种与频繁贸易,波氏杆菌在兔群中广泛传播,给家兔养殖带来了巨大的经济损失。针对这一现象,抗生素类药物作为强有效的预防及治疗措施受到养殖户的欢迎,但药物的过量使用与滥用造成的耐药性问题日益严重。因此,对地方或“自家”菌株进行耐药性分析,对临床合理用药具有重要的指导意义。本试验从内蒙古海拉尔区某规模化兔场病死兔肺脏内成功分离到一株细菌,经鉴定为支气管败血波氏杆菌,并对其进行了药物敏感试验和部分耐药基因检测,以期为当地兔场波氏杆菌病的合理用药提供参考。
1 材料与方法
1.1 材料
1.1.1 病料来源 2017年4月,内蒙古海拉尔区某规模化兔场2~4月龄兔群突然出现精神沉郁、食欲不振、咳嗽、打喷嚏、鼻分泌物增多等临床症状,5~7 d后病兔大量死亡。对病死兔进行剖捡,肉眼观察各组织器官,无菌采集肺脏、肝脏及心血,-20 ℃保存。
1.1.2 主要试剂 绵羊鲜血琼脂平板、TSA琼脂平板购自南京一基生化科技有限公司;革兰染色试剂盒、细菌微量生化鉴定管购自北京索莱宝科技有限公司;TIANamp Bacteria DNA Kit、Plasmid Mini Kit、Gel Extraction Kit购自天根生化科技(北京)有限公司;2×premix rTaq、pMD18-T Vector Cloning Kit、E.coliDH5α购自宝生物工程(大连)有限公司。
1.1.3 主要仪器 MCO-18AIC恒温培养箱(日本SANYO公司)、MCV131BNF超净无菌工作台(日本SANYO公司)、MikRo 22R高速冷冻离心机(德国HETTICH公司)、UV-2012PCS气浴恒温摇床(龙尼柯仪器有限公司)、g1000 PCR基因扩增仪(杭州博日科技有限公司)、全自动凝胶成像分析系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 细菌的分离纯化 取无菌采集的病变组织,选择新鲜创面分别于TSA、鲜血琼脂平板上进行划线培养,37 ℃恒温箱中倒置培养24~48 h,观察病原菌生长状态,挑取单一优势菌落继续纯培养。
1.2.2 染色、镜检 取少量分离菌纯培养物涂片,进行革兰染色,油镜下观察病原菌的形态结构和染色特点。
1.2.3 生化试验 将分离菌纯培养物接种于含5%胎牛血清的液体LB培养基中,取少量菌液加入微量生化鉴定管中,置于37 ℃恒温箱中培养。
1.2.4 PCR鉴定 使用细菌DNA提取试剂盒提取分离菌全基因组,分别采用16s rRNA通用引物与兔波氏杆菌鉴定引物[5]进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测,并进行胶回收、连接、转化,提取阳性质粒送往上海生工生物工程股份有限公司测序。
1.2.5 药物敏感性试验 以Kirby-Bauer(K-B)氏法进行药敏试验,测量病原菌的抑菌环直径,参考美国国家临床实验室标准委员会(NCCLS)提供的标准进行结果判定。
1.2.6 耐药基因检测 参照分离菌株药物敏感性实验结果,分别选取β-内酰胺类耐药基因blaTEM[6]、blaCTX-M[6],四环素类耐药基因tetA[7]、tetB[7],环胺类耐药基因sul1[7],氨基糖苷类耐药基因aadA1[7]进行PCR检测,对阳性扩增产物进行测序与基因比对。
2 结果与分析
2.1 病原菌的分离 病变组织经平板划线,于37 ℃倒置培养24~48 h,鲜血琼脂平板上呈现出表面光滑,边缘整齐,中间稍隆起的灰白色圆形菌落,直径约1 mm,周围形成隐约可见的β-溶血环;在含5%胎牛血清的TSA培养基上形成致密、光滑、稍有凸起的黄白色菌落。
2.2 染色、镜检及形态观察 经革兰染色后,油镜下观察该病原菌为两极浓染,两端钝圆的革兰阴性短杆菌,菌体大小均一,部分成对存在。
2.3 生化试验 采用微量生化鉴定管对该株分离菌进行生化试验,结果如表1所示。该菌不发酵蔗糖、乳糖、葡萄糖等糖类以及甘露醇等醇类;吲哚试验、M-R、V-P试验均呈阴性,不产生硫化氢;可利用枸橼酸盐,还原硝酸盐,氧化酶、接触酶、谷氨酸脱羧酶、脲酶反应呈阳性;生化鉴定结果与《伯杰氏系统细菌学手册》中波氏杆菌的描述一致,初步确定该分离菌株为波氏杆菌。

表1 分离菌生化鉴定结果Tab 1 Biochemical identification results of isolated strain
"+"表示阳性,"-"表示阴性。
"+" indicated positive, and "-" indicated negative.
2.4 PCR鉴定结果 16s rRNA通用引物扩增后,经1%琼脂糖凝胶电泳检测,获得大小约为1500 bp的目的片段,与预期结果一致(图1A);支气管败血波氏杆菌鉴定引物扩增出大小约为425 bp的目的片段,与预期结果一致(图1B)。测序结果经Blast在线比对,与波氏杆菌同源性高达99.8%,确定该分离株为兔源支气管败血波氏杆菌。
2.5 药物敏感性试验 该分离菌药敏试验结果如表2所示。由表可知,该菌株对卡那霉素、庆大霉素、诺氟沙星、甲氧嘧啶高度敏感;对强力霉素、环丙沙星等中度敏感;对青霉素G、阿莫西林、头孢拉啶、四环素等耐药。
2.6 耐药基因检测 采用文献中的引物检测分离菌的6种耐药基因,共筛选出blaTEM与tetB两种耐药基因,未检测到blaCTX-M、tetA、sul1与aadA1耐药基因的存在。图2为耐药基因blaTEM与tetB的检测结果,分别于300 bp与350 bp左右出现目的条带,与目的扩增条带305、374 bp一致。测序结果经NCBI在线比对,与已发表的猪源支气管败血波氏杆菌、兔源波氏杆菌、肺炎克雷伯氏菌和沙门菌相关耐药基因同源性为99.3%~99.9%。
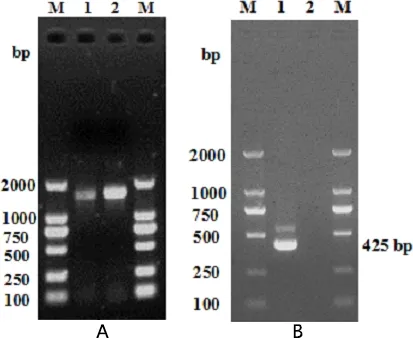
A:16s rRNA通用引物扩增结果。M,DL200 DNA Maker;1,分离株菌液;2,分离株基因组DNA B:波氏杆菌鉴定引物扩增结果。M,DL200 DNA Maker;1,分离株基因组DNA;2,阴性对照A: Amplification results of 16s rRNA universal primers.M, DL200 DNA Maker; 1, bacteria liquid; 2, genome DNA of isolated strain B: Amplification results of Bb' appraisal primers.M, DL200 DNA Maker; 1, genome DNA of isolated strain; 2, negative control图1 PCR扩增电泳图Fig 1 Amplification electrophoresis of PCR

表2 分离菌药敏试验结果Tab 2 Drug sensitive test results of isolated strain
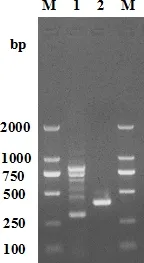
M:DL200 DNA Maker;1:blaTEM基因(305 bp);2,tetB基因(374 bp)M:DL200 DNA Maker;1:blaTEM gene (305 bp);2:tetB gene (374 bp)图2 耐药基因检测电泳图Fig 2 Tested electrophoresis of resistance gene
3 讨论与小结
兔细菌性呼吸系统疾病的病原主要包括支气管败血波氏杆菌、多杀性巴氏杆菌、葡萄球菌、大肠杆菌与链球菌等。其中,波氏杆菌与巴氏杆菌是规模化兔场多发的呼吸道病原菌,常混合感染,造成兔群的支气管肺炎与脓疱型肺炎,导致兔群急性死亡,制约兔养殖业的发展。由于波氏杆菌与巴氏杆菌在培养特性、菌落形态以及生化特点等方面具有很大的相似性,给临床诊断工作造成了极大地困难。实验从发病兔群肺脏中成功分离到一株细菌,经培养特性观察、革兰染色、生化鉴定以及PCR鉴定确定为支气管败血波氏杆菌。为了解该兔场所在地区兔波氏杆菌的耐药情况,对该分离株进行了药物敏感性试验与耐药基因检测。药物敏感性试验结果显示,该分离菌株对β-内酰胺类与四环素类抗生素的耐药最为严重,其中对青霉素G、阿莫西林、头孢拉啶完全耐药,对氨基糖苷类与喹诺酮类抗生素高度敏感(表2)。该分离菌株的耐药情况与以往报道的结果存在相似性,但是也存在不同。王晓芳等[6]对分离自浙江省的22株兔支气管败血波氏杆菌耐药情况进行了分析,分离菌株对林克酰胺类与β-内酰胺类抗生素耐药严重,耐药率达到91.0%~100%,对青霉素、头孢拉啶、林可霉素的耐药最为严重,但是,对四环素类、喹诺酮类与大环内酯类抗生素高度敏感。李长安等[8]对陕西某兔场波氏杆菌分离株耐药性进行了分析,结果显示分离菌株对环丙沙星、恩诺沙星等抗生素高度敏感,对红霉素、四环素等抗生素耐药。马增晖,王孝友等[9-10]研究结果均表明兔波氏杆菌对卡那霉素、环丙沙星、恩诺沙星高度敏感。由于不同地区流行毒株与抗生素使用情况的差异,导致波氏杆菌地区分离株耐药性存在着差异,但综合近年来波氏杆菌耐药性研究结果,波氏杆菌普遍对β-内酰胺类抗生素耐药,对氨基糖苷类与喹诺酮类抗生素高度敏感。这一结果对兔场波氏杆菌病的临床用药具有指导意义。
耐药性基因检测结果显示,该分离菌株携带有β-内酰胺类耐药基因blaTEM与四环素类耐药基因tetB,耐药基因检测结果与药敏试验结果一致。细菌产生的TEM性β-内酰胺酶是介导细菌对β-内酰胺类抗生素耐药的主要原因,编码β-内酰胺酶的基因主要由质粒携带,并可通过质粒的转化、转导与接合等方式转移给其他非耐药菌,造成耐药菌株的普遍存在[11-12]。王晓芳等[6]检测到blaTEM耐药基因在兔源波氏杆菌内广泛存在,与研究结果一致。blaTEM耐药基因的广泛存在解释了兔波氏杆菌对青霉素G、阿莫西林、头孢拉啶等β-内酰胺类抗生素普遍耐药的现象。该分离株检测到tetB耐药基因,并对四环素类耐药,可能是当地兔场大量使用四环素类抗生素造成菌株变异,产生对四环素类抗生素的耐药性。
伴随着兔养殖业的快速发展,抗生素的使用量也会大量增长,随之而来的细菌耐药现象也应受到广泛重视。兔波氏杆菌作为一种潜在的人畜共患病原菌,耐药菌株的出现不仅会制约兔养殖业的发展,也会对人类健康造成巨大威胁。因此,了解地方菌株的耐药情况与耐药基因携带情况,可为临床上抗生素的合理使用提供参考,也可以尽量减少耐药菌株的出现,对公共生物安全具有重要意义。
[1] Garcia D C, Guzman L, Cano M E,etal. Microbiological and clinical aspects of respiratory infections associated withBordetellabronchiseptica[J]. Diagn Micr Infec Dis, 2015, 82(1): 20-25.
[2] Wernli D, Emonet S, Schrenzel J,etal. Evaluation of eight cases of confirmedBordetellabronchisepticainfection and colonization over a 15-year period [J]. Clin Microbiol Infec, 2011, 17(2): 201-203.
[3] Yoda H, Nakayama K, Nakagawa M. Experimental infection ofBordetellabronchisepticato rabbits [J]. Jikken Dobutsu Experimental Animals, 1982, 31(2): 113-118.
[4] 刘 燕, 韦 强, 肖琛闻, 等. 兔波氏杆菌研究进展及防控对策思考[J]. 中国养兔杂志, 2014, (4): 36-38.
Liu Y, Wei Q, Xiao C W,etal. The research progress and prevention and control anlysis onBordetellabronchisepticaof rabbit [J]. Chinese Journal of Rabbit Farming, 2014, (4): 36-38.
[5] 刘 燕, 韦 强, 肖琛闻, 等. 兔巴氏杆菌和波氏杆菌多重PCR检测方法的建立[J]. 中国兽医学报, 2012, 32(2): 248-251.
Liu Y, Wei Q, Xiao C W,etal. Establishment of duplex PCR assay for the diagnosis ofPasteurellamultocidaandBordetellabronchisepticainfection in rabbits [J]. Chinese Journal of Veterinary Science, 2012, 32(2): 248-251.
[6] 王晓芳, 刘 燕, 肖琛闻, 等. 兔支气管败血波氏杆菌的分离鉴定及耐药基因检测[J]. 中国畜牧兽医,2015,42(3):544-548.
Wang X F, Liu Y, Xiao C W,etal. Isolation, Identification and Detection of Drug Resistant Genes of RabbitBordetellabronchiseptica[J]. China Animal Husbandry & Veterinary Medicine, 2015, 42(3): 544-548.
[7] 刘芳萍, 赵玉林, 李昌文, 等. 鸡源性沙门氏菌耐药基因检测与耐药相关性分析[J]. 中国预防兽医学报, 2013, 35(8):627-630.
Liu F P, Zhao Y L, Li C W,etal. Drug resistance gene detection and the resistance correlation analysis inSalmonellaisolated from chickens [J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(8):627-630.
[8] 李长安, 方艳琴, 陈晓霖,等. 兔支气管败血波氏杆菌的分离与鉴定[J]. 西北农业学报, 2011, 20(10):16-19.
Li C A, Fang Y Q, Chen X L,etal. Isolation and Identification ofBordetellabronchisepticaof Rabbit[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2011, 20(10):16-19.
[9] 马增晖, 尹秀凤, 薛家宾, 等. 家兔支气管败血波氏杆菌的分离鉴定[J]. 中国养兔杂志, 2008 , (5): 24-26.
Ma Z H, Yin X F, Xue J B,etal. Isolation and Identification ofBordetellaBronchisepticaof Rabbit [J]. Chinese Journal of Rabbit Farming, 2008, (5): 24-26.
[10] 王孝友, 杨 睿, 王永康, 等. 兔波氏杆菌的分离与鉴定[J]. 中国养兔杂志, 2012, (3): 8-10.
Wang X Y, Yang R, Wang Y K,etal. Isolation and Identification ofBordetellaBronchisepticaof Rabbit [J].Chinese Journal of Rabbit Farming, 2012, (3): 8-10.
[11] Bailey J K, Pinyon J L, Anantham S,etal. Distribution of the blaTEM gene and blaTEM-containing transposons in commensalEscherichiacoli[J]. Journal of Antimicrobial Chemotherapy, 2011, 66(4): 745.
[12] Wilke M S, Lovering A L, Strynadka N C. Beta-lactam antibiotic resistance: a current structural perspective [J]. Current Opinion in Microbiology, 2005, 8(5): 525-533.

