骨髓间充质干细胞培养液对牙周组织再生的影响
倪 璞, 刘宏伟
(同济大学口腔医学院牙周教研室,上海 200072)
种子细胞是牙周组织工程成功的关键因素之一,牙周膜干细胞(periodontal ligament stem cells, PDLSCs),牙周膜细胞(periodontal ligament cells, PDLCs)及躯干骨来源的骨髓基质细胞(bone marrow stromal cells, BMSCs)均被证明是牙周再生良好的种子细胞[1-3]。但种子细胞来源较少,培养难度较大,难以用于临床治疗。有外国学者利用骨髓充质干细胞(bone marrow mesenchymal stems, BMMSCs)培养液上清液制备琼脂糖凝胶,填入大鼠颅骨缺损,刺激骨缺损周围旁分泌因素,成功促进骨缺损的再生[4]。本实验选取不同种子细胞及BMMSCs细胞的培养液,比较这些培养液对SD大鼠牙周组织的修复效果,为进一步复杂的牙周组织工程的研究及临床应用提供基础。
1 材料与方法
1.1 实验动物与仪器
同批次6周龄雄性SD大鼠(SPF级),购自同济大学实验动物中心;低糖型DMEM培养基、胎牛血清、谷氨酰胺、青链霉素购自美国Gibco公司;0.25%胰蛋白酶、琼脂糖粉剂、CO2恒温孵箱购自美国Thermo公司;离心机购自德国Eppendorf公司;YJ-875型超净工作台购自苏州净化设备厂;倒置相差显微镜及照相系统购自日本Nikon公司;10cm培养皿及15、50mL离心管购自美国Corning公司。
1.2 方法
1.2.1 大鼠BMMSCs的培养 选取6周龄SD大鼠,予1%戊巴比妥钠0.006mL/g对大鼠行腹腔麻醉,75%乙醇浸泡5min,无菌条件下取出大鼠双侧股骨及胫骨,在无菌PBS中剥离多余组织,反复冲洗干净。剪开两端骨骼处,用5mL注射器抽取含10% FBS和1%双抗的低糖DMEM培养液从一端打入,冲出骨髓状物滴至含有同样培养液的10cm培养皿中,吹打成细胞悬液,置于5% CO2、37℃、95%饱和湿度的孵育箱中孵育。倒置显微镜下观察细胞生长情况。当细胞铺满瓶底80%时,用质量分数0.25%的胰酶消化,1∶3传代。取3~5代细胞进行实验。
1.2.2 人牙周膜细胞培养 取正畸患者拔除的损坏较少的前磨牙,浸泡于含1%双抗的低糖DMEM中,无菌条件下刮取牙根中1/3的牙周膜组织,剪成1.0mm×1.0mm×1.0mm小块,平铺于10cm培养皿底,加入含10% FBS和1%双抗的低糖DMEM培养液,置于5%CO2、37℃、95%饱和湿度的孵育箱中孵育。倒置显微镜下观察细胞生长情况。当细胞铺满瓶底80%时,用质量分数0.25%的胰酶消化,1∶2传代。取3~5代细胞进行实验。
1.2.3 实验分组 将大鼠分为实验组、对照组和空白组,每组填入不同的材料。实验组: 填入BMMSCs培养液(BMMSCs-CM)凝胶;对照组: 填入BMMSCs凝胶(BMMSCs)或填入牙周膜细胞凝胶(PDLCs)。空白组: 无任何填充物。
1.2.4 BMMSCs培养液提取 取3~5代大鼠BMMSCs铺满皿底80%时,使用仅含双抗的低糖DMEM进行培养,48h后收集上清液,4℃储存备用。
1.2.5 凝胶制备 实验组: 取BMMSCs培养液上清液,每毫升加入0.045g琼脂糖粉剂,烘箱加热至37℃溶解,冷却至室温凝结后即投入实验使用。对照组: 各自取3~5代大鼠BMMSCs和PDLCs离心(离心半径30cm,2000r/min,5min),弃上清液。离心后的BMMSCs及PDLCs,以PBS稀释混匀,维持细胞浓度为3×105/mL。混匀,每毫升中加入0.045g琼脂糖粉剂,加热至37℃溶解,冷却至室温凝结后即投入实验使用。
1.2.6 ELISA检测BMMSCs培养液 取实验组预备好的BMMSCs培养液、对照组不含血清的低糖DMEM,按试剂盒说明制备检测样品,对IGF-1、VEGF、PDGF-BB、BMP-2进行检测。
1.2.7 BMMSCs-CM诱导后RT-PCR及Western印迹法检测 分别利用实验组BMMSCs的培养液上清及对照组含10%FBS及双抗的低糖DMEM的常规培养液对PDLCs进行培养,48h后收集两组PDLCs,提取总RNA,按照TRIzol Reagent试剂盒说明,将其反转录为cDNA。按RT-PCR试剂盒说明进行反转录及cDNA扩增,再后对OPN、OCN、Runx2进行RT-PCR检测。将两组诱导后的PDLCs,采用RIPA法提取细胞蛋白,依BCA法检测蛋白浓度并统一上样,15%分离胶和5%浓缩胶行SDS-PAGE凝胶电泳,转至PVDF膜,放入BSA封闭液中摇床上2h,一抗孵育过夜,二抗孵育2h,行化学发光反应。分析牙周膜细胞OPN、OCN、Runx2蛋白表达情况。
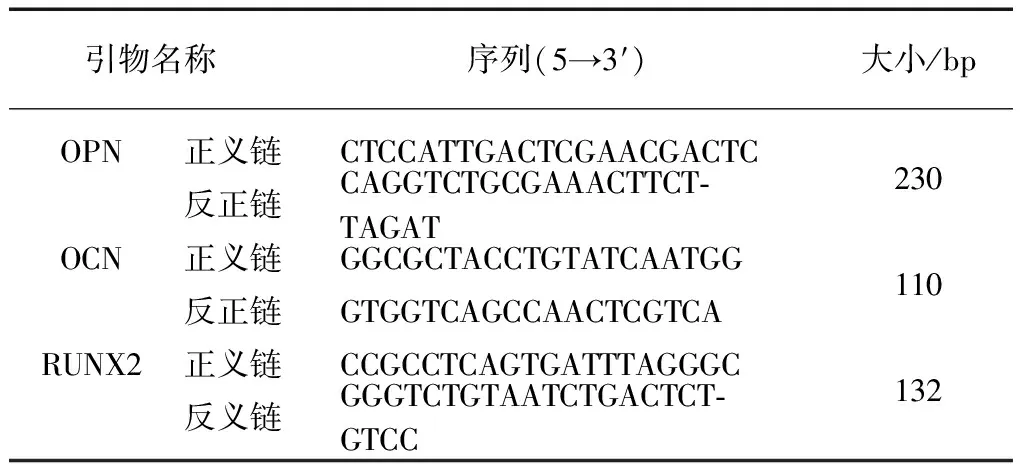
表1 RT-PCR引物序列
1.2.8 大鼠牙周缺损模型制备 取同批次6周龄雄性SD大鼠,将大鼠随机分为4组,每组8只。1%戊巴比妥钠麻醉后,用微创牙龈分离器和刀片翻开左下颌第一磨牙颊侧牙龈,使用低速裂钻并以裂钻直径为标准,生理盐水冷却下磨除范围为近根到远中根,高度为1mm,见图1。分别向各组缺损中填充预备好的材料,术后严密缝合,无需放置牙周塞治剂,术中随时吸取血液、唾液及生理盐水。术后正常饮食。填充材料后4周每组处死3只,8周每组处死5只大鼠,分离左侧下颌骨,4%多聚甲醛中体外固定48~72h。

图1 左下颌第一磨牙磨除颊侧牙槽骨后横断面示意图Fig.1 The cross section of the first molar of the left mandible
1.2.9 Micro-CT扫描及分析 利用Micro-CT系统在0.5mm铝滤过、70kV电压和200μA电流的条件下,将取下的颌骨以15μm分辨率扫描并三维重建。每个样本均选择其中有效的195张二维图像,勾画出第一磨牙颊侧及根分叉区自牙根尖至牙槽嵴顶的牙槽骨外围轮廓,利用系统自带软件计算,新生骨率,公式如下:
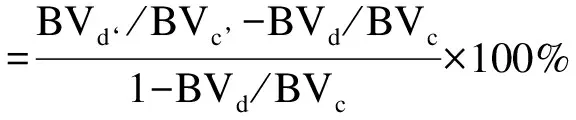
BVd表示术后即刻处死的大鼠下颌第一磨牙颊侧及根分叉区牙槽骨体积;BVc表示术前处死的同龄同批次未经处理的大鼠同区域牙槽骨体积;BVd‘表示术后4周及8周处死的大鼠下颌第一磨牙颊侧及根分叉区牙槽骨体积;BVc’表示术后4周及8周处死的同龄同批次未经处理的大鼠同区域牙槽骨体积;BVd/BVc表示术后即刻剩余骨率;BVd‘/BVc’表示术后4周或8周剩余骨率;1-BVd/BVc表示术后即刻骨缺损率。
1.2.10 组织学分析 用EDTA-甘油溶液完全脱钙后,冲水,梯度乙醇脱水,二甲苯透明,浸蜡后石蜡包埋,切片。H-E染色: 切片脱蜡入水,苏木精染色8min,冲水返蓝,伊红染色2min,冲水,梯度脱水,透明,封片。40倍光学显微镜下观察。
1.3 统计学处理
利用SPSS20.0软件对RT-PCR及Micro-CT所得数据进行t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠BMMSCs
体外培养原代大鼠BMMSCs,24h后部分贴壁,48~72h后可观察到少量短梭形或多角形细胞贴壁,1~2d后呈集落状生长,5~7d后细胞汇合达到80%,可消化传代。传代后细胞呈梭形,P3~P5代细胞增殖迅速,形态稳定,见图2。

图2 大鼠BMMSCs形态(×100)Fig.2 Morphology of BMMSCs(×100)
2.2 人牙周膜细胞
用组织块法培养PDLCs,5~7d内贴壁组织块边缘有细胞爬出,呈长梭形,数量随培养时间增加而增多。15~18d后细胞汇合达到80%,可消化传代。传代后细胞呈梭形,P3~P5代细胞增殖迅速,形态稳定,见图3。

图3 人牙周膜细胞形态(×100)Fig.3 Morphology of PDLCs(×100)
2.3 生长因子含量检测结果
实验组培养液内检测到IGF-1含量约1084.027pg/mL, VEGF含量约5.073pg/mL,未检测到PDGF-BB及BMP-2。对照组常规培养液内则未检测到任何生长因子。表明BMMSCs分泌了大量的生长因子,并累积在培养液中。
2.4 诱导培养后相关基因的表达
RT-PCR检查结果显示: BMMSCs培养液诱导组的骨相关基因OPN、OCN、Runx2表达均增高(P<0.05),见表2。Western印迹法检测结果显示: 经BMMSCs培养液诱导后,OPN、OCN、Runx2表达增高,优于常规培养液培养效果(P<0.05),结果与RT-PCR一致,见图4。

表2 RT-PCR检测结果
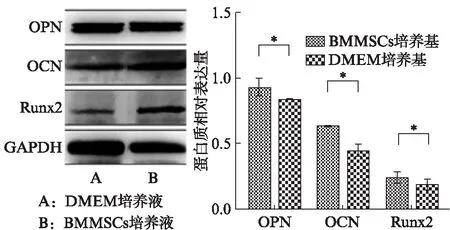
图4 Western印迹法检测相关蛋白的表达Fig.4 Detection of related proteins by Western blotting与DMEM培养基比较,*P<0.05
2.5 Micro-CT三维重建
术后4周和8周的Micro-CT三维重建结果显示: 8周时,实验组大鼠下颌骨第一磨牙颊侧牙槽骨恢复情况较好,已基本恢复牙槽骨术前形态。对照组及空白组牙槽骨恢复较差,见图5。

图5 术后4周及8周左侧下颌骨micro-CT三维重建Fig.5 Micro-CT 3D reconstructions of the Mandible in 4 weeks and 8 weeks after the operation
2.6 Micro-CT定量分析结果
Micro-CT三维扫描结果显示: 4周时,各组新生骨率差异无统计学意义(P>0.05)。8周时,实验组新生骨率明显高于对照组及空白组(P<0.05),见表4。

表4 各组8周时新生骨率
2.7 组织学表现
H-E染色结果显示: 4周时,各组第一磨牙颊侧牙槽骨在术后恢复的形态影像学表现无统计学意义,故仅对8周时做比较。术后8周的切片结果显示,实验组和对照组近中根颊侧均出现不同程度骨覆盖,形态不规则,由于在牙根标记切线制作过程中及术后恢复过程中,出现生理等不可预见问题,且切片过程中,切片角度及包埋角度无法做到完全一致,故该结果只能作为参考,无法进行统计学分析,见图6。对部分实验组切片颊侧进行放大,可见牙周膜结构,见图7。

图6 8周时左下颌第一磨牙近中根双侧改建H-E染色(×4)Fig.6 H-E staining of the rat mandibular first molar(×4)
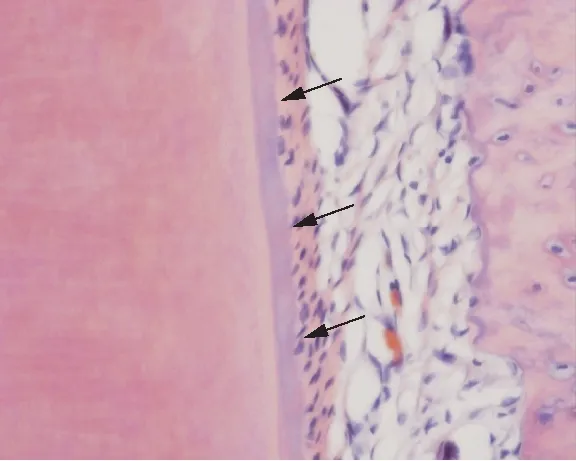
图7 8周时实验组左下颌第一磨牙近中根颊侧改建H-E染色结果(×40)Fig.7 H-E staining of the rat mandibular first molar buccal side(×40)箭头处为牙周膜
3 讨 论
PDLCs是一组异质性的细胞群,由成纤维细胞、成骨细胞、成牙骨质细胞及未分化的间充质干细胞多种细胞组成。Wang等[4]发现: 牙周膜干细胞更多存在于牙槽骨表面的牙周膜中,分离培养的牙槽骨表面的牙周膜干细胞具有较强的增殖能力和成骨成纤维分化的潜能。PDLCs是最具有牙周结缔组织附着再生能力的细胞,但仍然难以满足临床治疗和实验研究的需求。BMMSCs虽对很多特殊疾病有疗效,但实际操作中,常有移植后2d到数周,细胞消失的情况[5]。故Chen等[6]提出BMMSCs移植至缺损处后,其生长因子及细胞因子的分泌能刺激缺损周边的旁分泌因素,并能在BMMSCs的培养液中累积。
Osugi等[7]利用BMMSCs培养液制备凝胶,填入大鼠颅骨缺损,成功促进骨缺损的再生。从发育角度看,颌骨与其他颅面部骨骼一样来自于神经外胚层的神经嵴细胞[8],而细胞培养液易于获取,且其数量巨大,如其也能通过刺激牙周缺损处的旁分泌因素,从而达到了修复牙周缺损的效果,则为牙周组织的再生提供了新的途径和可能。
本实验通过ELISA法对BMMSCs培养液及低糖DMEM中的生长因子浓度进行检测,仅在培养液中检测到VEGF及IGF-1,未检测到其他指标,DMEM中则未检测到任何生长因子。表明BMMSCs分泌了大量的生长因子,并累积在培养液中。
Runx2在成骨分化的信号过程中起核心作用,能诱导细胞向成骨细胞定向分化。OCN、OPN是细胞质和胞外分泌蛋白,是成骨分化的重要指标。利用BMMSCs培养液对PDLCs进行48h的培养后,对以上指标进行RT-PCR和Western印迹法的分析,对比于常规培养液培养的PDLCs,三组指标均显示BMMSCs培养液组表达较高。这说明BMMSCs培养液中含有的大量生长因子可以促进PDLCs向成骨分化。综上分析得出如下结论: (1) 种子细胞可分泌大量生长因子,并在培养液中累积;(2) 经过BMMSCs培养液诱导培养后的细胞,成骨能力增强,更有利于牙周组织的再生。
目前,尚无相关利用细胞培养液恢复牙周组织的研究,且本课题组前期研究利用BMMSCs和PDLCs双膜片与牙根复合进行了动物的原位移植(牙生物性种植),系单个牙位实验,故本实验亦选择单个磨牙牙位(大鼠下颌第一磨牙近远中约1mm)的颌骨范围为实验区域。本实验将PDLCs及BMMSCs两种种子细胞及BMMSCs的培养液分别制备凝胶,放入统一规格的牙周缺损模型处进行比较,Micro-CT分析结果表明,同等情况下,BMMSCs培养液比细胞更能促进和诱导缺失的颌骨再生。BMMSCs-CM组的统计学分析结果显示,牙槽骨恢复情况已接近术前状态。组织学分析结果提示,BMMSCs-CM组恢复了部分牙周膜结构。
在颌骨微环境(micro-environment)中,多种细胞与细胞外基质及体内的各种细胞因子相互作用共同促成了组织发育的过程,在此过程中,各种信号分子通过微环境调控,导致了细胞的迁移,增殖和分化。有学者发现躯干骨的BMSCs通过血管通道到达牙周组织参与修复[9]。可见,颌骨微环境十分复杂,且与牙周组织的再生密不可分。目前,已有多种生物活性分子已被证明具有较强的促进牙周组织修复的功能,包括TGF-β、IGF、BMP、PDGF、bFGF、EMD[10-12]等。
综上所述,BMMSCs培养液在颌骨微环境中能更好地刺激原位细胞再生,这可能是由于BMMSCs培养液内可能累积了大量可以刺激缺损周边的旁分泌因素的细胞因子等。但并非所有实验组大鼠都恢复了牙周膜结构,这可能是因为: (1) 缺损模型制备时可能牙骨质受到损伤,导致恢复时牙本质与牙槽骨直接结合,从而未能有效形成牙骨质及牙周膜结构;(2) 所使用的大鼠BMMSCs并非来自颌骨,而是来自躯干骨,颌骨微环境相当复杂,非自体原位的细胞受到的不利影响较多;(3) 术后恢复过程中有炎症的存在,导致牙周膜结构无法正常形成。
结合本实验结果,BMMSCs培养液在颌骨微环境中能更好的刺激各种信号分子,增强缺损周边乃至躯干骨的相关细胞向缺损处迁徙,从而达到修复牙周组织的效果。这可能是由于BMMSCs培养液中积累了大量能刺激旁分泌因素的生长因子等。这为牙周组织再生提供了新的途径,但培养液利用旁分泌因素的具体机制,仍需进一步探讨。
[1] SEO B M, MIURA M, GRONTHOS S, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet, 2004,364(9429): 149-155.
[2] TABA M JR, JIN Q, SUGAI J V, et al. Current concepts in periodontal bioengineering[J]. Orthod Craniofac Res, 2005,8(4): 292-302
[3] KUNZE M, HUBER A, KRAJEWSKI A, et al. Efficient gene transfer to periodontal ligament cells and human gingival fibroblasts by adeno-associated virus vectors[J]. J Dent, 2009,37(7): 502-508.
[4] WANG L, SHEN H, ZHENG W, et al. Characterization of stem cells from alveolar periodontal ligament[J]. Tissue Eng Part A, 2011,17(7-8): 1015-1026.
[5] KINNAIRD T, STABILE E, BURNETT M S, et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms[J]. Circulation, 2004,109(12): 1543-1549.
[6] CHEN L, TREDGET E E, WU P Y G, et al. Paracrine Factors of Mesenchymal Stem Cells Recruit Macrophages and Endothelial Lineage Cells and Enhance Wound Healing[J]. PLoS One, 2008,3(4): e1886.
[7] OSUGI M, KATAGIRI W, YOSHIMI R, et al. Conditioned media from mesenchymal stem cells enhanced bone regeneration in rat calvarial bone defects[J]. Tissue Eng Part A, 2012,18(13-14): 1479-1489.
[8] COULY G F, COLTEY P M, LE D N. The triple origin of skull in higher vertebrates: a study in quail-chick chimeras[J]. Development, 1993,117(2): 409-429.
[9] MCCULLOCH C A, NEMETH E, LOWENBERG B, et al. Paravascular cells in endosteal spaces of alveolar bone contribute to periodontal ligament cell populations[J]. Anat Rec, 1987,219(3): 233-242.
[10] TEARE J A, RAMOSHEBI L N, RIPAMONTI U. Periodontal tissue regeneration by recombinant human transforming growth factor-beta 3 in Papio ursinus[J]. J Periodontal Res, 2008,43(1): 1-8.
[11] RATHE F, JUNKER R, CHESNUTT B M, et al. The effect of enamel matrix derivative (Emdogain) on bone formation: a systematic review[J]. Tissue Eng Part B Rev, 2009,15(3): 215-224.
[12] 金振宇,刘宏伟.颌骨骨髓基质细胞对牙周膜细胞生物学特性的影响[J].同济大学学报(医学版),2016,37(1): 22-27.

