Prominin1在C57BL/6小鼠视网膜色素上皮中的表达
邵志华, 李瑛泽, 许 洁, 于金军, 刘志学, 李思光
(1. 同济大学医学院,上海 200092; 2. 南昌大学生命科学学院,南昌 330031; 3. 同济大学生命科学与技术学院,上海 200092)
Prominin1为5次跨膜的胆固醇结合糖蛋白[1-2],定位于干细胞/肿瘤干细胞和光感受细胞等细胞膜上表面的凸起[3-6]。目前,Prominin1的配体和功能尚不清楚。研究发现,Prominin1的双等位基因突变或缺失导致视网膜变性,光感受细胞外节形成异常[7-12],因此,其可能在功能性质膜凸起的形成上发挥重要作用[7,13]。虽然有研究证明Prominin1在光感受细胞表达[9,11,14],但对其在视网膜色素上皮(retinal pigment epithelium, RPE)的表达鲜有报道。
Prom1cre/ERT2+/Gt(ROSA)26SorCAG-ZsGreen1+杂合鼠为Prominin1阳性细胞示踪小鼠,融合蛋白cre-ERT2在Prominin1启动子的驱动下表达。腹腔注射他莫昔芬后,cre-ERT2与他莫昔芬结合转入细胞核内,继而cre剪切杂合小鼠基因组ZsGreen上游的终止序列(stop序列),促进绿色荧光蛋白ZsGreen的表达,即Prominin1阳性细胞及其后代可见绿色荧光。
本研究使用Prom1cre/ERT2+/Gt(ROSA)26SorCAG-ZsGreen1+转基因小鼠,结合免疫荧光和PCR技术,首次阐述了Prominin1在不同发育时期RPE的表达,丰富了Prominin1的组织表达谱,为视网膜的生长发育及疾病发生的研究提供了新的线索。
1 材料与方法
1.1 实验动物
野生型C57BL/6小鼠(6~8周龄)购于上海普尔毕凯实验动物有限公司。转基因小鼠B6N;129S-Prom1tm1(cre/ERT2)Gilb/J(Prom1cre/ERT2+/-)和B6.Cg-Gt(ROSA)26Sortm6(CAG-ZsGreen1)Hze/J(Gt(ROSA)26SorCAG-ZsGreen1+/+)购于Jackson实验室(The Jackson Laboratory)。
1.2 试剂和抗体
他莫昔芬(T5648)、玉米油(C8267)、NaOH(S5881)、蔗糖(V900116)、EDTA(EDS)、Tris-HCl(T1503)、Triton X-100(T9284)、Tween 20(P1379)和荧光抗衰减封片剂(10981)购自Sigma公司;无水乙醇(10009218)购自国药集团药业股份有限公司;PBS(SH30256)购自HyClone公司;TRIzol(15596-026)、驴抗小鼠(A-21209,1∶1000)、驴抗兔(A-11072,A-21206,均1∶1000)购自Invitrogen公司;RNA反转录试剂盒(RR036A)和SYBR Premix Ex Taq II Mix(RR820A)购自TaKaRa公司;Rabbit anti-Otx2抗体(AB9566,1∶500)购自Millipore公司;Rat anti-Prominin1抗体(14-1331,1∶100)购自eBioscience公司;DAPI(10236276001,1∶1000)购自Roche公司;Donkey血清(017-000-121)购自Jakson公司。
1.3 实验方法
1.3.1 PCR鉴定转基因小鼠 转基因小鼠B6N;129S-Prom1tm1(cre/ERT2)Gilb/J和B6.Cg-Gt(ROSA)26Sortm6(CAG-ZsGreen1)Hze/J按雌雄2∶1比例进行合笼,获得F1代杂合小鼠。F1代杂合小鼠出生后20d剪取尾尖,碱裂解法提取DNA后进行PCR鉴定。碱裂解法采用NaOH(25mmol/L)和EDTA(0.2mmol/L)混合液,98℃裂解1h。裂解产物冷却至室温后用等量的Tris-HCl(40mmol/L,pH为8.8)中和后离心,上清液可用于后续的PCR反应。转基因小鼠B6N;129S-Prom1tm1(cre/ERT2)Gilb/J的PCR鉴定引物序列为Mutant1 F: 5′-CAGGCTGTTAGCTTGGGTTC-3′, Mutant1 R: 5′-AGGCAAATTTTGGTGTACGG-3′,产物长度为320bp;B6.Cg-Gt(ROSA)26Sortm6(CAG-ZsGreen1)Hze/J的PCR鉴定引物序列为Mutant2 F: 5′-GGCATTAAAGCA-GCGTATCC-3′,Mutant2 R: 5′-AACCAGAAGTGG-CACCTGAC-3′,产物长度为199bp。PCR扩增反应体系为Taq Mix 12.5μL,引物各1μL,鼠尾裂解产物1μL,加去离子水至25μL。PCR扩增反应条件为 94℃ 预变性3min,94℃变性30s,61℃退火30s,72℃ 延伸40s,反应35个循环,72℃延伸2min。筛选cre/ERT2+/CAG-ZsGreen1+杂合鼠用于后续实验。
1.3.2 小鼠合笼 野生型和转基因小鼠分别按雌雄2∶1比例进行合笼,第2天早上检查阴栓,有阴栓的小鼠为E 0.5(embryonic stage 0.5)。出生后第1天的新生鼠为P1(postnatal day 1)。
1.3.3 他莫昔芬诱导重组 他莫昔芬100mg先后溶于预热的1ml无水乙醇和9ml玉米油中,配置成10mg/ml的溶液。孕鼠按100μg/g剂量腹腔注射,新生鼠按照80μg/g剂量腹腔注射。
1.3.4 冰冻切片 小鼠麻醉后经4%多聚甲醛灌注,4℃固定过夜。PBS清洗后,用10%~30%蔗糖梯度脱水,经OCT包埋剂-80℃包埋后,进行冰冻切片(厚度12~14μm)。
1.3.5 荧光定量PCR 分离的RPE组织用TRIzol法进行RNA提取,经RT反转录反应获得cDNA,1∶10稀释后进行荧光定量PCR。Prominin1的引物序列如下。正义链: 5′-GCCTCTACCCTGGAAG-CAAA-3′,反义链: 5′-GATGCTGGTGGATGGCTCTT-3′,产物长度为100bp。PCR反应体系为SYBR Premix Ex Taq II Mix 10μL,引物各1μL,稀释的cDNA 1μL,加去离子水至20μL。PCR扩增反应条件为95℃预变性30s,95℃变性5s,60℃退火100s,72℃延伸40s,反应40个循环。
1.3.6 免疫荧光染色 冰冻切片用PBS清洗3次后,用0.25%透膜液室温透膜20min;PBS清洗3次后3% donkey血清室温封闭30min,一抗按比例稀释后4℃ 孵育过夜;PBS清洗3次后二抗和DAPI按比例稀释后室温孵育1h;PBS清洗3次,用荧光抗衰减封片剂封片,荧光共聚焦显微镜成像。
1.4 统计学处理
数据用统计学软件SPSS 20.0进行配对样品t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 转基因小鼠基因型的鉴定
引物Mutant1和Mutant2分别为转基因小鼠B6N;129S-Prom1tm1(cre/ERT2)Gilb/J和B6.Cg-Gt(ROSA)26Sortm6(CAG-ZsGreen1)Hze/J的鉴定引物。用Mutant1和Mutant2引物进行PCR扩增后,产物经电泳可见320bp和199bp产物,说明转基因小鼠为Prom1cre/ERT2+/Gt(ROSA)26SorCAG-ZsGreen1+杂合鼠,见图1。
2.2 转基因小鼠示踪Prominin1在不同发育时期RPE的表达
孕13.5d(E13.5)、15.5d(E15.5)和出生后1d(P1)的新生鼠,分别腹腔注射他莫昔芬,7d收取胎鼠和新生鼠的眼球,冰冻切片后进行Otx2免疫荧光染色。由于RPE为色素上皮且表达Otx2,因此色素和Otx2可用于RPE的定位。E13.5和E15.5的胎鼠部分RPE中表达ZsGreen(图2A′~F′),而P1小鼠的RPE中不表达ZsGreen(图2G′~I′)。示踪小鼠RPE中ZsGreen阳性表示此细胞在注射他莫昔芬时表达Prominin1,或者其可能来源于Prominin1阳性的细胞,因此本结果说明E13.5和E15.5时部分RPE可能表达Prominin1,而P1时的RPE不表达Prominin1。
2.3 荧光定量PCR检测Prominin1在不同发育时期RPE的表达
为了进一步验证示踪小鼠的研究结果,用定量PCR检测了Prominin1在野生型胎鼠和出生后小鼠RPE的表达情况。结果显示,Prominin1在胎鼠的表达明显高于出生后(P<0.01);胎鼠中Prominin1在E13.5和E15.5高表达,均显著高于E10.5(P<0.05)和E17.5(P<0.01),但两者间差异无统计学意义(P>0.05),见图3。出生后Prominin1的表达明显下降,其在P1与P4的RPE中表达无差异。此结果与转基因小鼠示踪的结果一致。
2.4 免疫荧光检测Prominin1在不同发育时期RPE的表达
为了进一步验证和探究Prominin1在不同发育时期RPE的表达,对E10.5、E13.5、E15.5、E17.5和P1的野生型小鼠RPE进行了Prominin1免疫荧光检测。结果与荧光定量PCR的结果一致,在胚胎期的小鼠RPE中可检测到Prominin1的表达(红色荧光),出生后未见Prominin1的表达,见图4。其中E10.5、E13.5和E15.5的荧光较明显(图4A′~L′),而E17.5的荧光较弱(图4M′~P′)。
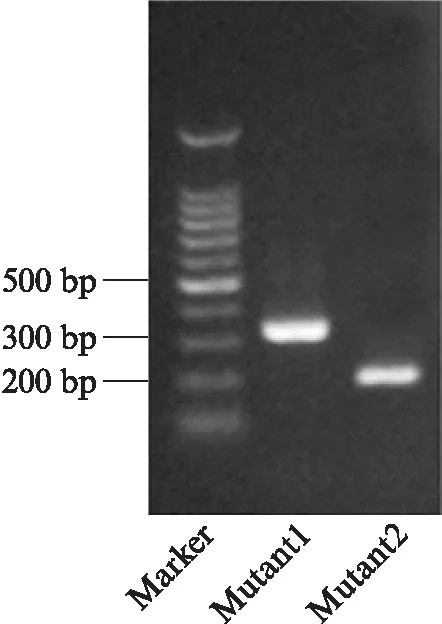
图1 PCR鉴定转基因小鼠Fig.1 The detection of transgenic mice

图2 转基因小鼠示踪Prominin1在不同发育时期RPE的表达Fig.2 Tracing the expression of prominin1using genetically modified mice in developmental RPE孕鼠(A~F,A′~F′)和新生鼠(G~I,G′~I′)腹腔注射他莫昔芬7d后切片,用Otx2和DAPI进行染色,荧光共聚焦显微镜成像;标尺: A~F为100μm,G~I为200μm,A′~C′为25μm,D′~I′为50μm;TM: 他莫昔芬
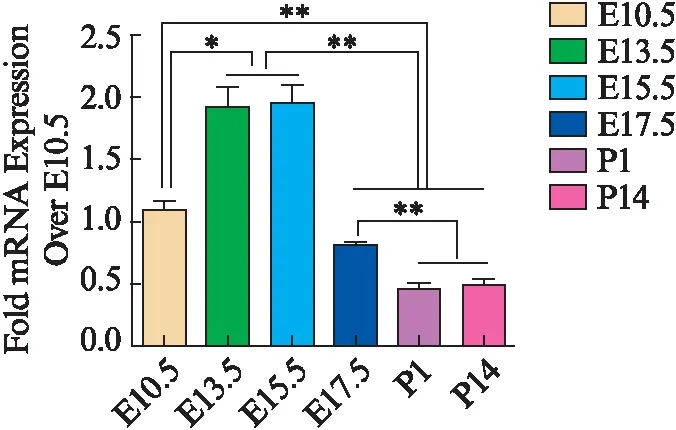
图3 PCR检测Prominin1在不同发育时期RPE的表达Fig.3 The expression of Prominin1 in developmental RPE detected by RT-PCRE10.5与E13.5和E15.5的RPE比较,*P<0.05;胎鼠(E10.5,E13.5,E15.5,E17.5)与出生后(P1和P14)的RPE比较,**P<0.01;E10.5,E13.5和E15.5与E17.5的RPE比较,**P<0.01
3 讨 论
RPE是一层位于神经视网膜和脉络膜之间的单层色素上皮,其在支持、营养神经视网膜和维持视觉功能方面发挥着重要的作用[15]。因此,研究RPE的基因和蛋白表达对阐明RPE的生理和病理功能具有重要的意义。Prominin1是胆固醇结合糖蛋白,在多种上皮细胞中表达。但是其在RPE的表达尚未见报道。由于Prominin1位于细胞膜上表面的凸起,如微绒毛等,而RPE细胞上表面存在大量的微绒毛[16],因此,推测RPE可能也表达Prominin1。
组织特异性遗传修饰小鼠是细胞体内示踪研究的重要工具[17]。其中,组织特异性Cre/ERT2重组酶转基因示踪小鼠和ROSA26-ZsGreen报告系统小鼠杂交的后代,可用于示踪组织特异性基因的表达。本研究使用Prominin1阳性细胞的示踪小鼠B6N;129S-Prom1tm1(cre/ERT2)Gilb/J和ROSA26-ZsGreen报告系统小鼠B6.Cg-Gt(ROSA)26Sortm6(CAG-ZsGreen1)Hze/J杂交后代进行了示踪研究。本研究显示,胎鼠的RPE中表达Prominin1,而出生后的小鼠RPE不表达。此外,对野生型小鼠的RPE的定量PCR和免疫荧光染色显示,Prominin1主要在E13.5和E15.5达。与本研究不同的是,2011年,Jaszai等[14]利用原位杂交对胎鼠和出生后的小鼠视网膜进行研究,结果显示: Prominin1仅在神经视网膜光感受细胞外节和部分内核层细胞表达,而在RPE中未见Prominin1的表达。这种差异的原因可能是因为RPE为色素上皮,细胞内聚集大量的色素颗粒,这些色素对非荧光染色有一定的干扰。
Prominin1作为干细胞表面标志物,已经在神经和肿瘤等多种干细胞表面被发现[18-20],但是其具体的功能尚不清楚。然而,对视网膜退行性疾病的研究发现Prominin1的c.1726C>T纯合突变可导致视网膜色素变性[10];插入突变可导致光感受细胞营养不良;R373C的错义突变可导致家族性黄斑变性[11]。对R373C错义突变小鼠的进一步研究发现Prominin1的突变可影响光感受细胞外节的形态发生;电镜研究发现RPE内有脂褐素样物质的异常堆积。

图4 免疫荧光检测Prominin1在不同发育时期RPE的表达Fig.4 The expression of Prominin1 in developmental RPE of mice shown by immunofluorescence不同发育时期的胎鼠(A~P、A′~P′)和新生鼠(Q~T、Q′~T′)的冰冻切片,用Otx2、Prominin1和DAPI进行染色,荧光共聚焦显微镜成像;标尺: A~T为50μm,A′~D′为12.5μm,E′~T′为25μm
这些研究结果提示Prominin1的突变可能会导致RPE的异常。由于RPE对神经视网膜有营养、支持和保护等功能,其形态和功能的异常也会导致光感受细胞的异常[21]。因此,Prominin1是否参与RPE细胞质膜凸起的形成及其在RPE中的功能值得进一步研究。
综上所述,本研究首次证实了Prominin1在胎鼠RPE中表达,特别是在E13.5和E15.5的表达明显。本研究不仅丰富了Prominin1的组织表达谱,也为视网膜的生长发育及疾病发生的研究提供了新的线索。
[1] MIRAGLIA S, GODFREY W, YIN A H, et al. A novel five-transmembrane hematopoietic stem cell antigen: isolation, characterization, and molecular cloning[J]. Blood, 1997,90(12): 5013-5021.
[2] CORBEIL D, ROPER K, FARGEAS C A, et al. Prominin: a story of cholesterol, plasma membrane protrusions and human pathology[J]. Traffic, 2001,2(2): 82-91.
[3] BAUER N, FONSECA A V, FLOREK M, et al. New insights into the cell biology of hematopoietic progenitors by studying prominin-1 (CD133) [J]. Cells Tissues Organs, 2008,188(1-2): 127-138.
[4] IROLLO E, PIROZZI G.CD133: to be or not to be, is this the real question?[J]. Am J Transl Res, 2013,5(6): 563-581.
[5] 石小军,江华.胰腺肿瘤干细胞研究进展[J].同济大学学报(医学版),2016,37(4): 119-123.
[6] MARZESCO A M. Prominin-1-containing membrane vesicles: origins, formation, and utility[J]. Adv Exp Med Biol, 2013,777: 41-54.
[7] JASZAI J, FARGEAS C A, FLOREK M, et al. Focus on molecules: prominin-1 (CD133) [J]. Exp Eye Res, 2007,85(5): 585-586.
[8] MICHAELIDES M, HUNT D M, MOORE A T. The genetics of inherited macular dystrophies[J]. J Med Genet, 2003,40(9): 641-650.
[9] MAW M A, CORBEIL D, HELLWIG A, et al. A frameshift mutation in prominin (mouse)-like 1 causes human retinal degeneration[J]. Hum Mol Genet, 2000,9(1): 27-34.
[10] ZHANG Q, ZULFIGAR F, XIAO X, et al. Severe retinitis pigmentosa mapped to 4p15 and associated with a novel mutation in the PROM1 gene[J]. Hum Genet, 2007,122(3-4): 293-299.
[11] YANG Z, CHEN Y, LILLO C, et al. Mutant prominin 1 found in patients with macular degeneration disrupts photoreceptor disk morphogenesis in mice[J]. J Clin Invest, 2008,118(8): 2908-2916.
[12] PRAS E, ABU A, ROTENSTREICH Y, et al. Cone-rod dystrophy and a frameshift mutation in the PROM1 gene[J]. Mol Vis, 2009,15: 1709-1716.
[13] FLOREK M, BAUER N, JANICH P, et al. Prominin-2 is a cholesterol-binding protein associated with apical and basolateral plasmalemmal protrusions in polarized epithelial cells and released into urine[J]. Cell Tissue Res, 2007,328(1): 31-47.
[14] JASZAI J, FARGEAS C A, GRAUPNER S, et al. Distinct and conserved prominin-1/CD133-positive retinal cell populations identified across species[J]. PLoS One, 2011,6(3): e17590.
[15] BHARTI K, MILER S S, ARNHEITER H. The new paradigm: retinal pigment epithelium cells generated from embryonic or induced pluripotent stem cells[J]. Pigment Cell Melanoma Res, 2011,24(1): 21-34.
[16] STRAUSS O. The retinal pigment epithelium in visual function[J]. Physiol Rev, 2005,85(3): 845-881.
[17] GLASER S, ANASTASSIADIS K, STEWART A F. Current issues in mouse genome engineering[J]. Nat Genet, 2005,37(11): 1187-1193.
[18] LUO Y, COSKUN V, LIANG A, et al. Single-cell transcriptome analyses reveal signals to activate dormant neural stem cells[J]. Cell, 2015,161(5): 1175-1186.
[19] ZHOU Q, CHEN A, SONG H, et al. Prognostic value of cancer stem cell marker CD133 in ovarian cancer: a meta-analysis[J]. Int J Clin Exp Med, 2015,8(3): 3080-3088.
[20] CHEN Y L, LIN P Y, MING Y Z, et al. The effects of the location of cancer stem cell marker CD133 on the prognosis of hepatocellular carcinoma patients[J]. BMC Cancer, 2017,17(1): 474.
[21] GOLESTANEH N, CHU Y, XIAO Y Y, et al. Dysfunctional autophagy in RPE, a contributing factor in age-related macular degeneration[J]. Cell Death Dis, 2017,8(1): e2537.

