Con A、α-Galcer与LPS/D-Gal N诱导免疫性肝损伤小鼠NKT细胞功能改变的比较研究*
游 佳, 陈 薇, 郑 琦, 陈 靖, 朱月永
(福建医科大学附属第一医院肝病中心, 福州 350004)
免疫性肝损伤是由于药物等相关因素触发,导致肝组织内大量炎症细胞浸润, 产生免疫炎症应答,从而导致免疫反应为基础的肝脏损伤,约占肝损伤疾病的20%[1]。免疫性肝损伤是导致肝纤维化、肝硬化乃至肝脏肿瘤等终末病变发生的重要因素,决定了肝脏疾病的转归和发生发展,严重危害人类健康[2]。然而,免疫性肝损伤的发病机制至今尚未完全阐明,更缺乏特效的治疗药物,而其中,一种客观规范、稳定可靠、符合免疫性肝损伤临床发病特点的动物模型是研究该疾病的重要基础。据文献报道[3-4],目前应用最为广泛的免疫性肝损伤动物模型主要包括以下3种药物干预:刀豆蛋白A(concanavalin A, Con A)、α-半乳糖神经酰胺(α-galactosylceramide, α-Galcer)与脂多糖(lipopolysaccharide, LPS)/D-氨基半乳糖(D-galactosamine, D-Gal N),均能引起机体免疫炎症反应,导致肝组织损伤。NKT细胞(natural killer T cells)是一类既表达T细胞受体又表达NK细胞表面标志的一组异质性淋巴细胞亚群,在先天固有性免疫和后天适应性免疫中均发挥重要作用,是目前免疫性损伤研究中的热点。本研究拟以NKT细胞功能为切入点,探讨其在Con A、α-Galcer与LPS/D-Gal N分别诱导免疫性肝损伤模型小鼠中的变化特点,对于免疫性肝损伤的发病机制及保肝药物筛选研究都具有重要意义。
1 材料与方法
1.1 实验动物
SPF级雄性C57BL/6小鼠40只,体质量22~26 g,购自福建医科大学实验动物中心[SCXK(闽)2016-0002],饲养于福建医科大学附属第一医院动物房。购入后先适应性喂养5 d,期间自由饮水摄食。
1.2 试剂与主要仪器
Con A、α-Galcer、LPS/D-Gal N均购自美国Sigma公司;肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、干扰素-γ(interferon-γ, IFN-γ)、白细胞介素-6(interleukin-6, IL-6)兔抗鼠多克隆抗体均购自美国R&D公司;辣根过氧化物酶标记的山羊抗兔二抗购自武汉博士德公司;PE标记的兔抗CD3、FITC标记的鼠抗NKR-P1A购自英国Abcam公司;RIPA裂解液、BCA试剂盒购自美国Thermo公司;全自动生化检测仪购自日本日立公司;MK3型酶标仪购自美国Thermo公司;5417R低温高速离心机购自德国Eppendorf公司;倒置荧光显微镜购自日本Olympus公司;手动轮转式切片机购自德国Leica公司;流式细胞仪购自美国Beckman Coulter公司;凝胶成像分析系统购自美国Bio-Rad公司。
1.3 实验设计
40只小鼠随机分为4组,包括空白对照组、Con A模型组、α-Galcer模型组和LPS/D-Gal N模型组,每组10只。参照文献方法[5-7]分别对各模型组进行造模,Con A模型组给予一次性尾静脉注射ConA溶液(18 mg/kg),α-Galcer模型组给予一次性腹腔注射α-Galcer溶液(40 μg/kg),LPS/D-Gal N模型组分别给予一次性腹腔注射LPS溶液(10 μg/kg)和D-Gal N溶液(700 mg/kg)。造模完成后8 h,所有小鼠称重,眼眶取血后脱颈处死,取肝脏称重,计算肝指数(=肝质量/体质量×100%),然后部分肝组织保存于4%多聚甲醛溶液中用于病理检测,部分肝组织于液氮中冻存待用。
1.4 血清ALT、AST水平检测
取小鼠血液样品,室温静置2 h,3 000 r/min离心10 min,取上清,生化检测仪检测血清ALT、AST水平。
1.5 肝组织病理学检测
取固定于4%多聚甲醛溶液中的小鼠肝组织,常规石蜡包埋后切片,经苏木精-伊红染色(HE染色)后显微镜下观察、拍片,分析各组动物肝组织的病理损伤情况。
1.6 肝组织NKT细胞含量检测
取小鼠肝组织,充分剪碎后收集,经120目、100目重叠的尼龙网过滤,滤液于4℃、12 000 r/min条件下离心15 min;生理盐水重悬,置于2 ml小鼠percoll淋巴细胞分离液中, 1 500 r/min离心10 min;收集交界面处的淋巴细胞层细胞,洗涤两次,加入PE标记的CD3和FITC标记的NKR-P1A各10 μl,避光孵育1 h后,流式细胞仪上机检测。
1.7 肝组织TNF-α、IFN-γ、IL-6蛋白表达量检测
取冷冻保存的小鼠肝组织,加入一定量RIPA裂解液,冰上匀浆后于4℃、12 000 r/min条件下离心15 min,取上清液制备组织蛋白提取液,BCA试剂盒法测定组织蛋白含量。按照Western blot实验步骤分别检测小鼠肝组织中TNF-α、IFN-γ、IL-6的蛋白表达量,根据目的蛋白和内参蛋白对应灰度值的比值计算蛋白的相对表达水平。
1.8 统计学处理
2 结果
2.1 各模型小鼠肝指数及血清ALT、AST水平分析
与空白对照组比较,Con A组、α-Galcer组和LPS/D-Gal N组肝指数均显著增加(P<0.01或P<0.05),血清ALT、AST水平明显异常升高(P<0.01);各模型组之间肝指数无明显差异(P>0.05),但ConA组血清ALT、AST水平较α-Galcer组有明显升高(P<0.05,表1)。

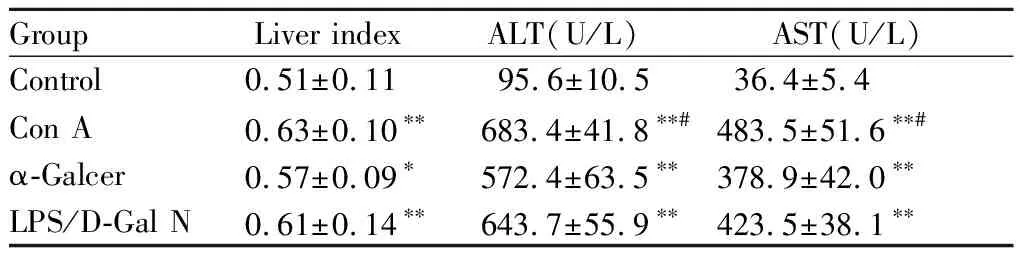
GroupLiver indexALT(U/L)AST(U/L)Control 0.51±0.1195.6±10.536.4±5.4Con A 0.63±0.10∗∗ 683.4±41.8∗∗#483.5±51.6∗∗#α-Galcer0.57±0.09∗ 572.4±63.5∗∗378.9±42.0∗∗LPS/D-Gal N 0.61±0.14∗∗ 643.7±55.9∗∗423.5±38.1∗∗
Con A: Concanavalin A; α-Galcer: α-galactosylceramide; LPS/D-Gal N: Lipopolysaccharide/D-galactosamine; ALT: Alanine aminotransferase; AST: Aspartate aminotransferase
*P<0.05,**P<0.01vscontrol;#P<0.05vsα-Galcer
2.2 各模型小鼠肝组织病理结构分析
空白对照组小鼠肝组织细胞形态正常,排列整齐,肝小叶、肝窦完整,细胞核大小一致,分布均匀;Con A组小鼠肝组织存在脂肪样变性,细胞肿胀、排列较散乱,肝小叶缺失,肝窦内有红细胞淤积,部分区域可见淋巴细胞、中性粒细胞浸润;LPS/D-Gal N组小鼠肝组织细胞肿胀、排列较散乱,肝窦结构紊乱,肝小叶不完整且存在点状坏死情况;α-Galcer组小鼠肝组织细胞分布较均匀,细胞稍微肿胀,部分区域存在炎性浸润和坏死病灶,但面积明显减少,损伤相对较轻。从病理结果分析,Con A组小鼠肝损伤最重,LPS/D-Gal N组次之,α-Galcer组则相对较轻(图1,见彩图页Ⅱ)。
2.3 各模型小鼠肝组织NKT细胞含量分析
与空白对照组比较,各模型组小鼠肝组织NKT细胞含量均明显上升(P<0.01或P<0.05),并以ConA组和α-Galcer组上升最为显著(P<0.01);各模型组之间比较,ConA和α-Galcer组较LPS/D-Gal N组有明显差异(P<0.05,图2)。

Fig.2Analysis of NKT cell content in liver tissues of each group of mice (n=6)
*P<0.05;**P<0.01vscontrol;#P<0.05vsLPS/D-Gal N
2.4 肝组织TNF-α、IFN-γ、IL-6蛋白相对表达量分析
与空白对照组比较,各模型组小鼠肝组织炎性因子TNF-α、IFN-γ、IL-6表达均显著上调(P<0.01),其中LPS/D-Gal N组相对其余两模型组炎性因子的表达上调最小,但组间比较无统计学差异(P>0.05,图3)。

Fig.3Relative expressions of TNF-α, IFN-γ and IL-6 proteins in liver tissues of mice (n=4)
Con A: Concanavalin A; α-Galcer: α-galactosylceramide; LPS/D-Gal N: Lipopolysaccharide/D-galactosamine; TNF-α: Tumor necrosis factor-α; IFN-γ: Interferon-γ; IL-6: Interleukin-6
**P<0.01vscontrol
3 讨论
肝损伤动物模型的建立和应用对于肝脏疾病发病机制的研究及治疗药物的筛选有着重要的现实意义。目前肝损伤动物模型的造模方法很多,主要可分为四大类:化学性肝损伤模型、药物性肝损伤模型、免疫性肝损伤模型和酒精性肝损伤模型[8]。其中,因免疫性肝损伤发病率逐年提高,其相关实验研究也备受关注,本研究以3种常用的免疫性肝损伤动物模型为研究对象,通过比较研究NKT免疫细胞功能改变情况,旨在寻找一种在病理生理机制上更接近临床发病特点的免疫性肝损伤动物模型。
AST和ALT是反应肝损害的敏感指标,其升高程度在一定程度上能反映肝细胞受损程度,是目前临床上肝功能检测经典指标之一[9]。肝指数是肝脏重量占体重的比值,在表观层面反映了肝脏的代谢功能及病变情况[10]。本实验发现,各模型组小鼠血清AST和ALT水平均显著升高,肝功能受损;肝指数病理性增加,肝组织有病变发生。HE染色深入观察肝组织病理情况发现,各模型组小鼠肝组织均存在不同程度的脂肪样变性、胞体肿胀、排列散乱、炎性浸润和坏死病灶等病理现象。上述结果说明,Con A、α-Galcer和LPS/D-Gal N诱导的肝损伤模型小鼠均存在肝功能受损及肝组织病变等情况,但其中α-Galcer组损伤相对较轻。
NKT细胞是免疫细胞中一类独特的具有NK细胞特性的淋巴细胞,在肝脏中广泛分布。作为机体重要的免疫细胞,NKT细胞以“双刃剑”的方式调节着免疫系统,一方面,通过识别CD1d抗原复合物而活化,发挥固有免疫作用,保护机体组织;另一方面,活化的NKT 细胞能快速分泌大量炎性细胞因子,造成局部炎性紊乱,损伤机体组织[11-12]。TNF-α、IFN-γ、IL-6是参与体内炎症反应的主要细胞因子,其中,TNF-α是炎症反应过程中最重要的炎性介质,直接介导炎症反应和组织病理损伤;IL-6是炎性反应的促发剂,表达增加会导致细胞变性、坏死;IFN-γ则是活化并刺激免疫细胞分泌TNF-α、IL-6的激动剂[13-14]。本实验发现,各模型组小鼠肝组织中NKT细胞含量较对照组显著上升,炎性因子表达显著升高,表明Con A、α-Galcer和LPS/D-Gal N都可能是通过激活NKT细胞介导组织炎症反应,导致免疫性肝损伤疾病的发生,但LPS/D-Gal N对NKT细胞的激活能力明显低于Con A和α-Galcer。
综上,本研究发现Con A、α-Galcer和LPS/D-Gal N均能有效诱导免疫性肝损伤动物模型,但不同造模方法在肝损伤程度及NKT细胞功能方面有一定差异;其中,Con A诱导的动物模型肝脏病理损伤及免疫紊乱最为明显,更符合疾病临床特点,可作为免疫性肝损伤的首选模型。

