时间分辨荧光分析法测定抗原培养滤液蛋白10对结核性胸腔积液诊断的临床研究
王雪梅,周松林,熊国亮
(江西省胸科医院内科,江西 南昌 330006)
胸腔积液是临床常见的病症,是结核性与恶性渗出性胸腔积液的主要原因。我国结核病发病率高,结核性胸腔积液是最常见的肺外结核[1-2],胸腔积液结核杆菌培养或涂片使结核性胸腔积液的诊断与鉴别诊断比较困难,检测抗酸杆菌的阳性率偏低[3-4]。抗原培养滤液蛋白10(CFP10)是结核分枝杆菌感染早期分泌的蛋白,为致病型结核分枝杆菌特有,可作为活动性结核的标志物,在非致病分枝杆菌及卡介苗(BCG)中缺失[5],检测CFP10能避免因感染非致病分枝杆菌或者卡介苗而出现假阳性的现象[6]。时间分辨荧光免疫分析法(TRFIA)具有高灵敏度、可定量等特点,可作为一种免疫学检查方法,其线性范围宽、成本低、稳定性强[7]。目前国内尚未有诊断结核性胸腔积液采用TRFIA测定CFP10的相关报道,本研究旨在建立该检测方法,为结核性胸腔积液的早期诊断提供技术支持。
1 资料与方法
1.1 一般资料 选择2015年1月—2016年6月在江西省胸科医院住院的结核性胸腔积液106例患者为观察组,其中男性80例,女性26例,年龄16~85岁,平均年龄(55.04±19.48)岁。另选择同期住院的非结核性胸腔积液40例患者为对照组,包括18例癌性胸腔积液和22例其他感染性胸腔积液。其中男性27例,女性13例,年龄15~84岁,平均年龄(58.70±18.02)岁。两组的年龄、性别比较差异无统计学意义(P>0.05)。
1.2 纳入和排除标准 纳入标准:观察组胸膜活检可见结核结节;表现有盗汗、食欲下降、发热、全身乏力等结核病症状;经抗结核治疗后症状缓解;纯化蛋白衍生物试验结节大于1.5 cm×1.5 cm;符合胸腔积液Light 标准对渗出性胸腔积液的判断,胸腔积液细胞学检测主要为淋巴细胞。术前均未接受抗结核治疗。本研究获医院伦理评审委员会批准,研究对象均签署知情同意书。排除标准:患有恶性肿瘤、严重肝肾脏器病变、合并急慢性炎性感染疾病、自身免疫系统疾病。
1.3 仪器与试剂 全自动时间分辨荧光免疫分析仪(1235 Auto DELFIA,美国Perkin Elmer 公司),全自动酶联免疫分析仪(Wellscan MK2,芬兰Denley Dragon公司),发光增强液(美国Perkin Elmer 公司),Sephacryl S200柱(美国GE公司),Eu3+标记试剂盒及CFP10单克隆抗体由杭州启泰生物技术有限公司提供,结核分枝杆菌CFP10 ELISA试剂盒及结核抗体试剂由上海双赢生物有限公司提供,牛血清白蛋白(BSA)由上海生物制品研究所提供。患者入院后在治疗前均抽取胸腔积液20 mL,并采集空腹静脉血5 mL用于酶联免疫吸附法(ELISA)检测,-20 ℃保存。
1.4 研究方法
1.4.1 固相包被抗体制备 用50 mmol·L-1pH=9.6的碳酸盐缓冲液将CFP10单克隆抗体稀释至浓度为5 μg·L-1,然后于96孔微孔板每孔中加入200 μL,4 ℃保存过夜,将包被液倾去并洗涤1次,采用去金属离子的1%牛血清白蛋白(BSA)加磷酸盐吐温缓冲液于37 ℃封闭2 h。弃去封闭液,洗涤后真空抽干,于-20 ℃冷冻保存。
1.4.2 Eu3+标记抗体制备 将Eu3+-DTTA用超纯水复融并配制成5 g·L-1浓度的Eu3+-DTTA溶液;将CFP10单克隆抗体于0.2 mol·L-1pH=9.5的强有力的化学结合力(CBS)内透析24 h,以1∶3的比例将Eu3+-DTTA溶液在搅拌条件下加入透析好的抗体内,振荡25 min后避光静置于4 ℃环境下标记48 h。过Sephacryl S200柱分离,洗脱液以50 mmol·L-1pH=7.8的Tris-HCl缓冲液,确定蛋白含量,合并第1峰各管,同时以Eu3+标记试剂盒检测合并峰管的Eu3+浓度。标记率测定后稀释分装并冻干保存。
1.4.3 参考标准品的设置 将CFP10蛋白0.4 mL相继等倍稀释直到确定临界点,通过对数曲线确定线性范围为2.5~1 800 μg·L-1,最终确定5个标准品,将CFP10配制为浓度分别为2.5、25、100、500、1 800 μg·L-1的标准溶液,按每瓶1 mL 分装后冻干,于-20 ℃冷冻保存。
1.4.4 TRFIA法检测CFP10抗原 采用双抗体夹心法,将100 μL标准品或胸腔积液标本加入包被了CFP10蛋白单克隆抗体的微孔中,20 ℃振荡孵育1 h,洗涤3次后,加入用分析缓冲液进行1∶100稀释的Eu3+-抗CFP10蛋白单克隆抗体100 μL,20 ℃振荡孵育1 h,洗涤5次。滴入增强液100 μL,振荡10 min,于荧光检测仪上测定荧光值,最后依据标准曲线计算出标本中CFP10蛋白的含量。
1.4.5 Eu3+标记抗体标记率测定 将做好标记的抗体原液在紫外分光光度计上测吸光度OD值,以280 nm为标准,OD值为0.51。采用增强液将标记原液稀释后测定荧光值,参考试剂盒提供的标准品。
2 结果
2.1 回收率比较 取含量为116.5 μg·L-1CFP10蛋白的胸腔积液依次加入浓度为25、100、500 μg·L-1的标准参考品中进行回收试验,回收率分别为96.84%、96.32%、97.45%,平均回收率为96.87%。
2.2 剂量-反应曲线 CFP10抗原-TRFIA剂量-反应曲线的标准低点与标准高点的荧光计数相差大于2个数量级,荧光计数值与被测物的含量成算术级数正比例关系,曲线拟合相关系数r2=0.998,见图1。

图1 CFP10抗原的TRFIA标准曲线
2.3 精确度 TRFIA法的平均批内CV与平均批间CV分别为2.98%及4.20%,分别优于ELISA法的6.27%及7.74%,且TRFIA法不同浓度的批内CV与批间CF均低于ELISA法的相应浓度值,见表1。

表1 TRIFA与ELISA的精确度比较(n=25)
2.4 灵敏度 以浓度不同的CFP10蛋白(2.5、5、10、25、50、100、500 μg·L-1)进行检测,TRFIA法的最低检出浓度为2.5 μg·L-1,而ELISA法的最低检出浓度为25 μg·L-1。取检测荧光值较高的1例结核性胸腔积液患者的胸腔积液标本,倍比稀释至1∶32 768,同时用ELISA法与TRFIA法检测CFP10蛋白抗原,TRFIA法在1∶16 384结果仍为阳性,有检测出抗原;而ELISA法的结果在1∶4 096时已为阴性。
2.5 TRFIA法临界值 TRFIA法检测观察组CFP10的Log浓度为(1.924±0.57) μg·L-1,对照组的Log浓度为(0.108±0.03) μg·L-1,两组比较差异有统计学意义(t=24.72,P<0.01)。对观察组绘制ROC曲线,曲线下面积(AUC)为0.923,见图2。取临界值为11.86 μg·L-1时,灵敏度与特异度分别为95.28%与92.50%,总一致率为94.52%;阳性预测值与阴性预测值分别为97.12%和88.10%。ELISA法以29.52 μg·L-1为临界值时,灵敏度与特异度分别为86.79%和85.00%,低于TRFIA法。具体数据见表2。
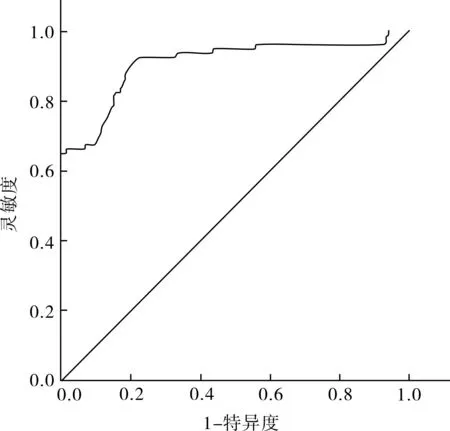
图2 TRFIA法灵敏度与特异度

检测方法结果确诊结果/例(%)阳性阴性合计TRFIA阳性101(95.28)3(7.50)104阴性5(4.72)37(92.50)42ELISA阳性92(86.79)6(15.00)98阴性14(13.21)34(85.00)48合计10640146
3 讨论
胸腔积液是指由胸膜、肺脏以及肺外疾病引起的过多液体积聚在胸膜腔内[8],胸腔积液可由多种因素导致,目前临床最为常见的是结核性与恶性胸腔积液。结核性胸腔积液是引起渗出性胸腔积液的重要病因,作为结核病的高发地区,本病的治疗亟待解决。在胸腔积液的发展过程中,多种因素在其中发挥着重要的调节与介导作用,结核性与恶性胸腔积液中的差异尤其显著,因此可以根据其鉴别胸腔积液性质。结核性分枝杆菌CFP-10是自结核分枝杆菌的早期培养滤液中,可产生多种分泌性蛋白,是一种低分子量蛋白质[9]。其能编码产生CFP10这一特异性培养滤液蛋白,具有RD1特异性基因序列[10-11],该区仅存在于极少数致病性分枝杆菌内,包括苏尔加分枝、结核分枝杆菌复合群、堪萨斯分枝杆菌等,并不是所有的致病性分枝杆菌与卡介苗都都特异性地缺失RD1序列[12],具有良好的抗原性,外周血单个核细胞产生γ-干扰素(IFN-γ)及发生增殖反应,作为特异性抗原诱导结核菌素试验(PPD)皮肤试验阳性者的良好指示剂。感染结核分枝杆菌后,并不是马上存在结核抗原,而需要一定的时间,一般感染8周后才逐渐出现,因此检测快速诊断结核性胸腔积液的有效方法是对胸腔积液中的结核性分枝杆菌所分泌特异性抗原,结核感染的诊断研究中以CFP-10为目标抗原检测为重要指标不断受到关注[13-14]。
TRFIA是一种超微量的免疫分析检测方法,采用具有独特荧光特点的镧系元素离子及其螯合物标记抗原或抗体。由于能达到原子水平标记,对标记物的影响非常低,因此其灵敏度非常高,极大程度减少了非特异性结合[15]。TRFIA的特异性荧光的衰变时间非常长,是传统荧光的103~106倍,由于其具有独特的荧光特性,TRFIA法与现有的放免法、化学发光法等临床常用检测相比,具有灵敏度高、操作简易、重复性好、标准曲线范围宽、标记物稳定、没有放射性污染、不被样本自然荧光干扰等特点与优势。对于相同批次检测的试剂,由于TRFIA有着稳定性,可使用两点定标或通过设定参考曲线标记,大大降低了检测成本,提高了检测效率。
本研究结核性胸腔积液应用TRFIA方法检测CFP10蛋白抗原含量,检测范围远较ELISA法宽,最低检出浓度仅为2.5 μg·L-1。灵敏度达到满意的水准, 是良好的定量诊断试剂。本研究显示TRFIA法的灵敏度95.28%与特异度92.50 %,均高于ELISA方法检测值,与李新玲等[6]研究结果比较一致。总诊断一致率可高达94.52%,说明TRFIA法对结核性胸腔积液能获得满意的诊断效果,检测CFP10抗原具有非常高的准确性。ROC曲线不受发病率与诊断界值的影响,作为一种经典的诊断试验评价曲线,它综合反映了特异性、敏感性,曲线随诊断界值变化的动态改变,诊断价值高时AUC应大于0.9,其价值可根据AUC的大小来评价。通过分析得出ROC曲线AUC为0.923,提示结核性胸腔积液采用TRFIA法可获得较高的诊断价值。
综上所述,胸腔积液中采用TRFIA法测定CFP10蛋白含量,可提高结核性胸腔积液的诊断效率,具有早期诊断优势,且优势表现为灵敏度高、特异性强,对于鉴别恶性胸腔积液、结核性有着重要的价值,值得进一步深入探讨与应用推广。
[1] 余碧芸,周莹艳,邵川,等.结核感染T细胞斑点试验与ADA活性检测对结核性胸腔积液的诊断评价[J].中华医院感染学杂志,2016,26(10):2235-2238.
[2] 刘佳庆,张立,冯爽,等.液相芯片技术检测多种细胞因子对结核性胸腔积液诊断价值的评估[J].中华检验医学杂志,2015,38(8):562-566.
[3] LEE SJ,KIM HS,LEE SH,et al.Factors influencing pleural adenosine deaminase level in patients with tuberculous pleurisy[J].Am J Med Sci,2014,348(5):362-365.
[4] GOPI A,MADHAVAN SM,SHARMA SK,et al.Diagnosis and treatment of tuberculous pleural effusion in 2006[J].Chest,2007,131(3):880-889.
[5] ZHANG H,PENG P,MIAO S,et al.Recombinant Mycobacterium megmatis expressing an ESAT6-CFP10 fusion protein induces anti-mycobacterial immune responses and protects against Mycobacterium tuberculosis challenge in mice[J].Scand J Immunol,2010,72(4):349-357.
[6] 李新玲,黄怀宇,吴俊渊,等.时间分辨荧光免疫法检测脑脊液结核分枝杆菌特异性抗原的诊断价值[J].中华医院感染学杂志,2012,22(18):4168-4170.
[8] 王晓娟,施焕中.关于胸腔穿刺术的几个问题[J].中华结核和呼吸杂志,2015,38(7):551-552.
[9] 阳幼荣,吴雪琼,张俊仙,等.结核分枝杆菌CFP10-ESAT6重组融合蛋白抗原血清学诊断价值[J].中华感染控制杂志,2011,10(4):241-243,247.
[10] 王晓玮,程筱雯,张焰,等.结核分枝杆菌CFP10、ESAT6 蛋白的原核表达、纯化及ELISPOT 检测方法的建立与应用[J].安徽医科大学学报,2015,50(9):1347-1351.
[11] ARLEHAMN CS,SIDNEY J,HENDERSON R,et al.Dissecting mechanisms of immunodominance to the common tuberculosis antigens ESAT- 6,CFP10,Rv2031c (hspX),Rv2654c(TB7.7),and Rv1038c(EsxJ)[J].J Immunol,2012,188(10):5020-5031.
[12] YANG H,CHEN H,LIU Z,et al.A novel B-cell epitope identified within Mycobacterium tuberculosis CFP10/ ESAT-6 protein [ J].PLos One,2013,8(1):e52848.
[13] SUTHERLAND JS,LALOR MK,BLACK GF,et al.Analysis of host responses to Mycobacterium tuberculosis antigens in a multi-site study of subjects with different TB and HIV infection states in sub-Saharan Africa[J].PLoS One,2013,8(9):e74080.
[14] 袁凯,梁德,吴雪琼,等.以CFPl0/ESAT6融合蛋白为抗原的酶联免疫斑点技术在脊柱结核感染辅助诊断中的应用价值[J].中国医学科学院学报,2015,37(1):44-49.
[15] 杭建峰,吴英松,余伟鸿,等.癌胚抗原的时间分辨免疫荧光分析及其诊断试剂的研制[J].细胞与分子免疫学杂志,2006,22(1):121-124.

