高压液相色谱技术分离制备杆菌肽各组分的研究
仲伟潭,宋盼,彭亮,郭月玲,王崔岩,张雪霞
(微生物药物国家工程研究中心、河北省工业微生物代谢工程技术研究中心、华北制药集团新药研究开发有限责任公司,河北 石家庄 050015)
杆菌肽是多肽类抗生素,1943年被美国Johnson第一次发现,可以从枯草杆菌和地衣芽胞杆菌发酵液中提取分离制得[1]。杆菌肽由12个氨基酸组成[2],含有A、B、C、D、E、F、G等至少9种组分,其中,杆菌肽A为主要活性组分[3],杆菌肽A在碱性条件下可自发氧化,形成没有抗菌活性的杆菌肽F组分[4]。杆菌肽的抗菌谱与青霉素相似,主要用于治疗耐青霉素的葡萄球菌感染[5]。由于其副作用大,在临床上主要是外用,广泛用于治疗深部真菌、皮肤[6]和黏膜真菌等疾病。杆菌肽还是一个重要的饲料添加剂,5×10-6~100×10-6浓度可促进家禽和牲畜对食物的利用以增重[4]。
目前,对于杆菌肽的提取分离方法[7]以及分析检测方法[8-10]的报道已经不少,但是对于分离制备杆菌肽各组分的报道极少,并且工艺复杂。本文运用制备型高压液相色谱技术,优化工艺条件,分离制备出了杆菌肽组分A、B1、B2、B3、C1、C2、C3,其化学结构式见图1,为杆菌肽的进一步研究奠定了基础。
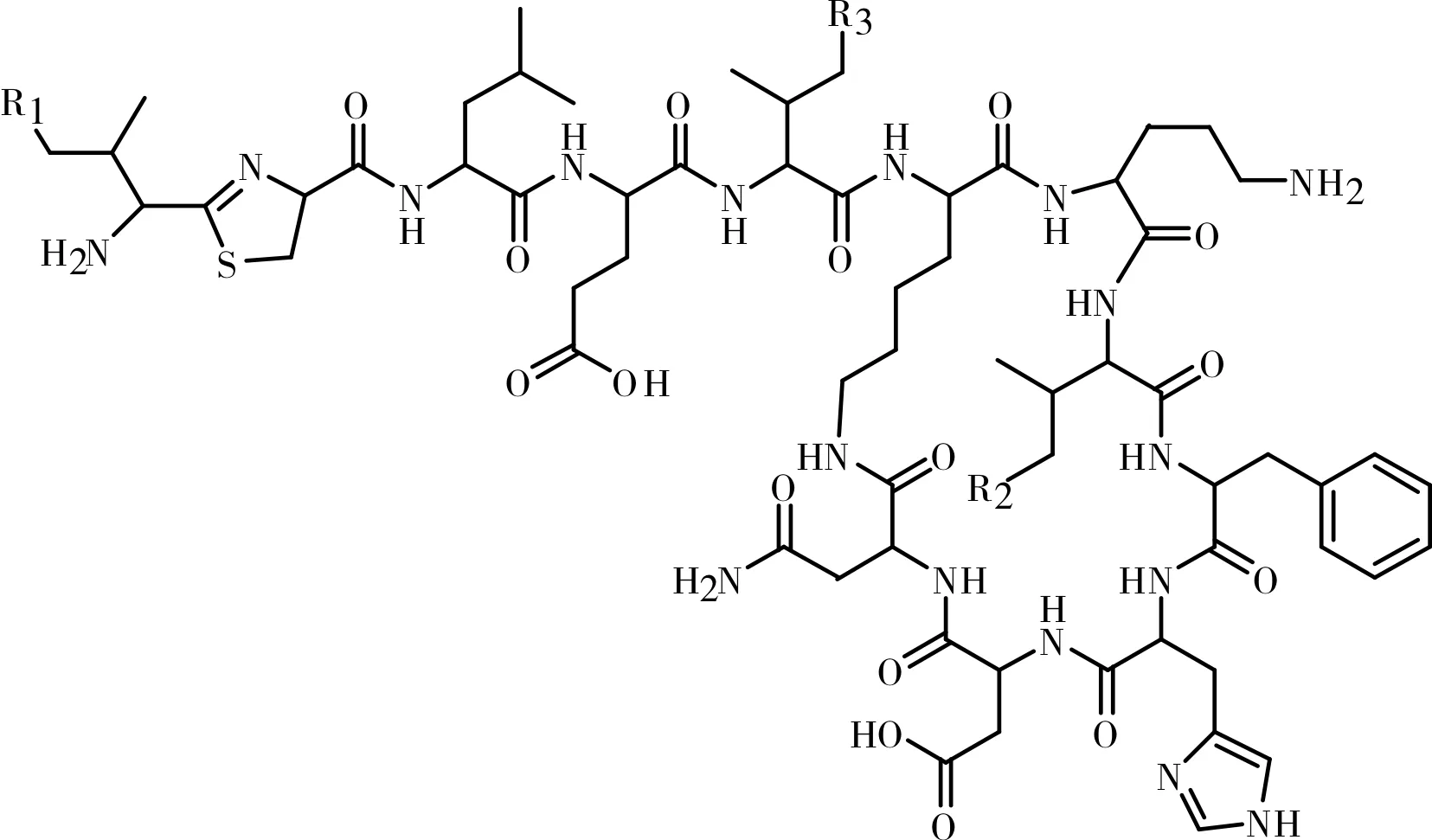
图1 杆菌肽各组分的结构式
1 材料与方法
1.1 材料与仪器 杆菌肽粗粉,华北制药新药研发中心自制;HZ816大孔吸附树脂,上海华震科技有限公司;甲醇(制备级),安徽时联特种溶剂股份有限公司;乙醇(工业级),沧州兴隆化工有限公司;甲醇(色谱级),美国Merck公司;乙腈(色谱级),美国Merck公司;去离子水,华北制药新药研发中心自制;其它试剂均为国产分析纯。高压液相制备色谱仪,汉邦科技有限责任公司;LA-2010A型高效液相色谱仪,岛津公司;冻干机,德国Martin Christ公司;RE-52AA型旋转蒸发器,上海荣生化仪器厂;pH计,梅特勒·托利多实验室pH计FE20;Nicolet Magna-IR 550型傅立叶红外光谱仪,美国Nicolet公司;TU-1901紫外可见分光光度计,北京普析通用仪器有限责任公司;INVOA 500型核磁共振波谱仪,美国Varian公司;ZMD Micromass型质谱仪,美国Micromass公司。
1.2 方法
1.2.1 色谱条件 (1)分析色谱条件。分析型色谱柱:纳微Unisil C18色谱柱(4.6 mm×250 mm,5 μm);流动相:A为甲醇;B为1.54‰乙酸铵水溶液(乙酸调pH至5.0)-乙腈(9∶1,V/V);A∶B=53∶47;柱温:40 ℃;流速:1.0 mL·min-1;进样量:10 μL;分析时间:40 min;检测波长:254 nm。(2)高压液相制备色谱条件。制备型色谱柱:纳微Unisil C18色谱柱(30 mm×250 mm,10 μm);流动相:A为甲醇(制备级);B为1.54‰乙酸铵水溶液[(乙酸调节pH至5.0)-乙腈=(9∶1,V/V)];A∶B=9.0∶11.0;总流速:40 mL·min-1;上样量:200 mg;分析时间:60 min,检测波长:254 nm。
1.2.2 杆菌肽粗粉的纯化 称取130 g杆菌肽粗粉用300 mL去离子水溶解,注入4LHZ816吸附树脂柱,流速60 mL·min-1,弃去柱流出液。吸附完成后,用3BV(BV:树脂柱床体积)30%乙醇溶液洗涤,弃去柱流出液。再以4BV 60%乙醇溶液洗脱,收集洗脱液。将洗脱液中的乙醇经旋转蒸发回收后,浓缩液冷冻干燥,得42 g杆菌肽样品。
1.2.3 杆菌肽各组分的制备 称取杆菌肽样品2.0 g,加入20 mL流动相溶解,0.45 μm微孔滤膜过滤,注入分析型高压液相色谱仪,根据色谱图分别收集各组分流出液[8]。分别合并分析型高压液相色谱仪检测后单个组分含量高于90%的杆菌肽组分收集液,45 ℃真空浓缩,除去甲醇(回收)后,上HZ816树脂柱吸附,水洗,60%乙醇解析,解析液浓缩至杆菌肽组分大约60 g·L-1,冷冻干燥,得杆菌肽组分冻干粉。
2 结果
2.1 高压液相制备色谱条件的确立 由于杆菌肽组分的化学结构式中有大量的酰胺键(酰胺基)、羧基、氨基等,分子极性较大;从电荷性质看,单个分子中含有两个游离羧基、两个游离氨基、两个含氮唑环,整体偏碱性更多一些,在这个基础上选用纳微Unisil C18反相色谱柱进行分离制备,检测波长选定为254 nm。根据参考文献[11-12],最终对制备色谱条件的流动相配比、pH值、上样量等因素进行优化。
2.1.1 流动相pH的确立 由于杆菌肽A在碱性条件下可自发氧化,形成没有抗菌活性的杆菌肽F,所以选用了偏酸性的pH进行实验。从制备色谱图上看,见图2,pH为5.0时分离效果比较好,从高压液相色谱仪检测结果看,在此pH值各组分的收集液纯度均达到95%以上,因此选用pH值5.0制备杆菌肽各组分,见表1。
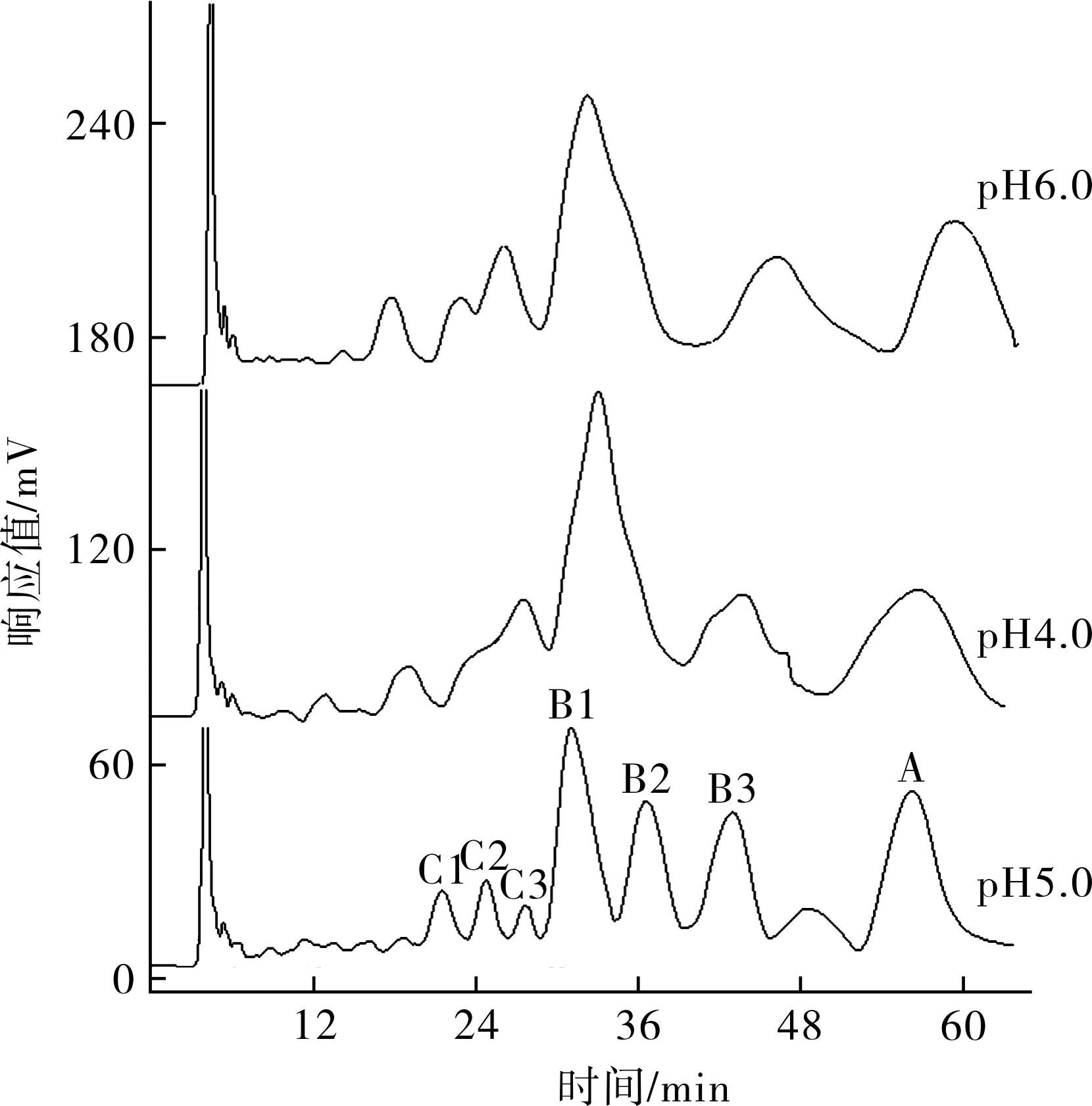
图2 不同pH的流动相下杆菌肽各组分的高压液相色谱图
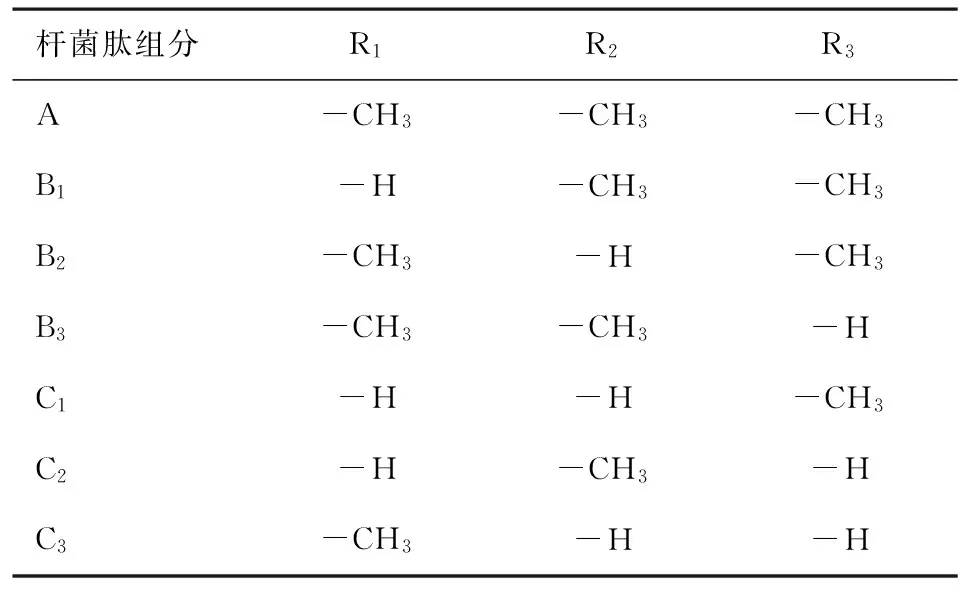
杆菌肽组分R1R2R3A-CH3-CH3-CH3B1-H-CH3-CH3B2-CH3-H-CH3B3-CH3-CH3-HC1-H-H-CH3C2-H-CH3-HC3-CH3-H-H
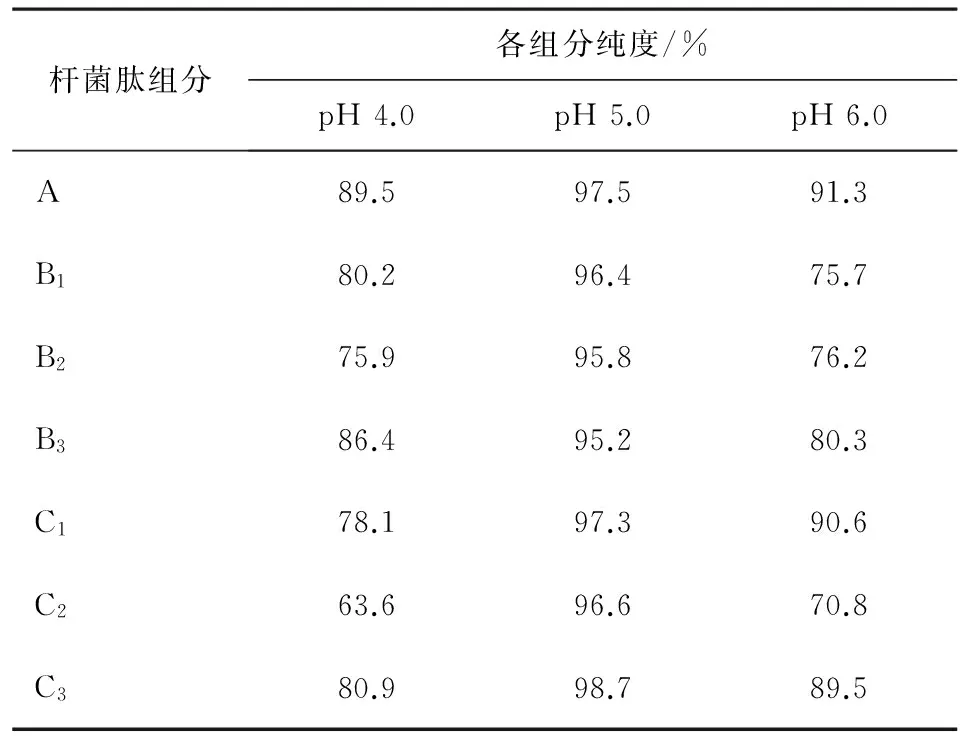
表2 不同pH的流动相制备杆菌肽各组分的HPLC结果
2.1.2 流动相配比的确立 不同的流动相配比对分离度和柱压都有一定的影响,因此本实验分别考察了A∶B=8.0∶12.0、A∶B=9.0∶11.0、A∶B=10.0∶10.0、A∶B=11.0∶9.0配比下杆菌肽各组分的分离情况,结果表明:A比例越高,各组分出峰越快,可以缩短制备周期,但是A比例过高,分离度明显下降,以至于不能收集到高纯度的C3组分,适当降低A比例,有利于提高分离度,使各组分有效分离,但A比例太低,柱压会升高,各组分出峰时间会延迟。综合考虑,选择A∶B=9.0∶11.0为最佳流动相配比。
2.1.3 上样量的确立 由于杆菌肽样品中各杂质组分含量较低,尤其是C3组分含量仅有5%左右,上样量太小,影响制备量,制备周期延长,耗时耗材,因此分别考察上样量为100、150、200、250 mg的分离效果,以收集到的C3组分纯度为指标,结果表明,上样量太大,分离度明显下降,收集不到高纯度的C3组分。为了避免载样过量,保证一定的分离度,以及避免样品可能在柱子顶部沉积,对柱子造成损害,综合考虑,确定上样量为200 mg。
2.2 样品检测 冷冻干燥制得的杆菌肽各组分,经分析型高压液相色谱仪测定分析,结果发现各组分色谱图基本为单一色谱峰,如图3所示,采用面积归一化法计算,纯度均在95%以上。制得的各组分红外光谱测定数据与其分子中功能团所应具有的红外吸收峰一致(见表3)。在水溶液中,经紫外可见分光光度计测定,制得的各组分最大吸收波长为251 nm,与杆菌肽各组分的化学结构应表现的性质一致。经质谱仪和核磁共振波谱仪对各组分进行波谱分析和结构鉴定,所得数据与文献[13]报道一致。
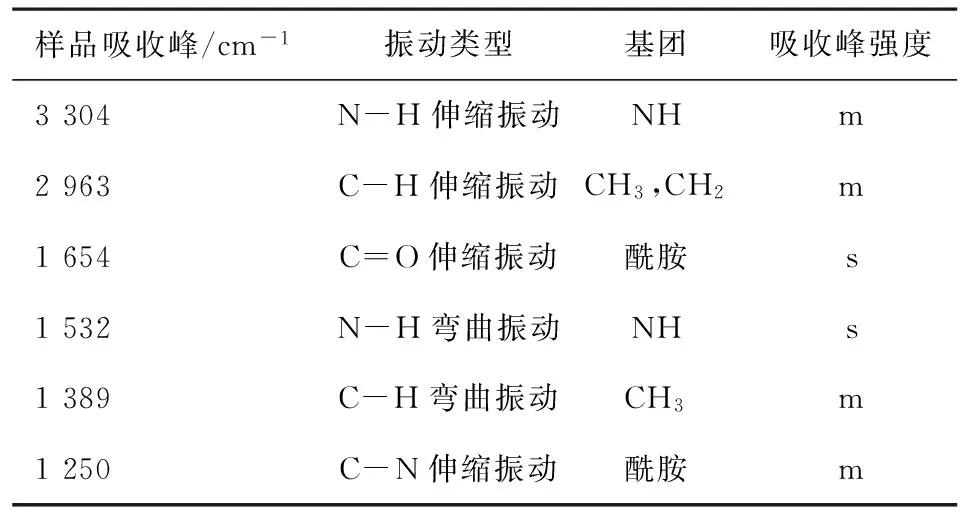
表3 杆菌肽各组分红外(IR)吸收峰及其归属
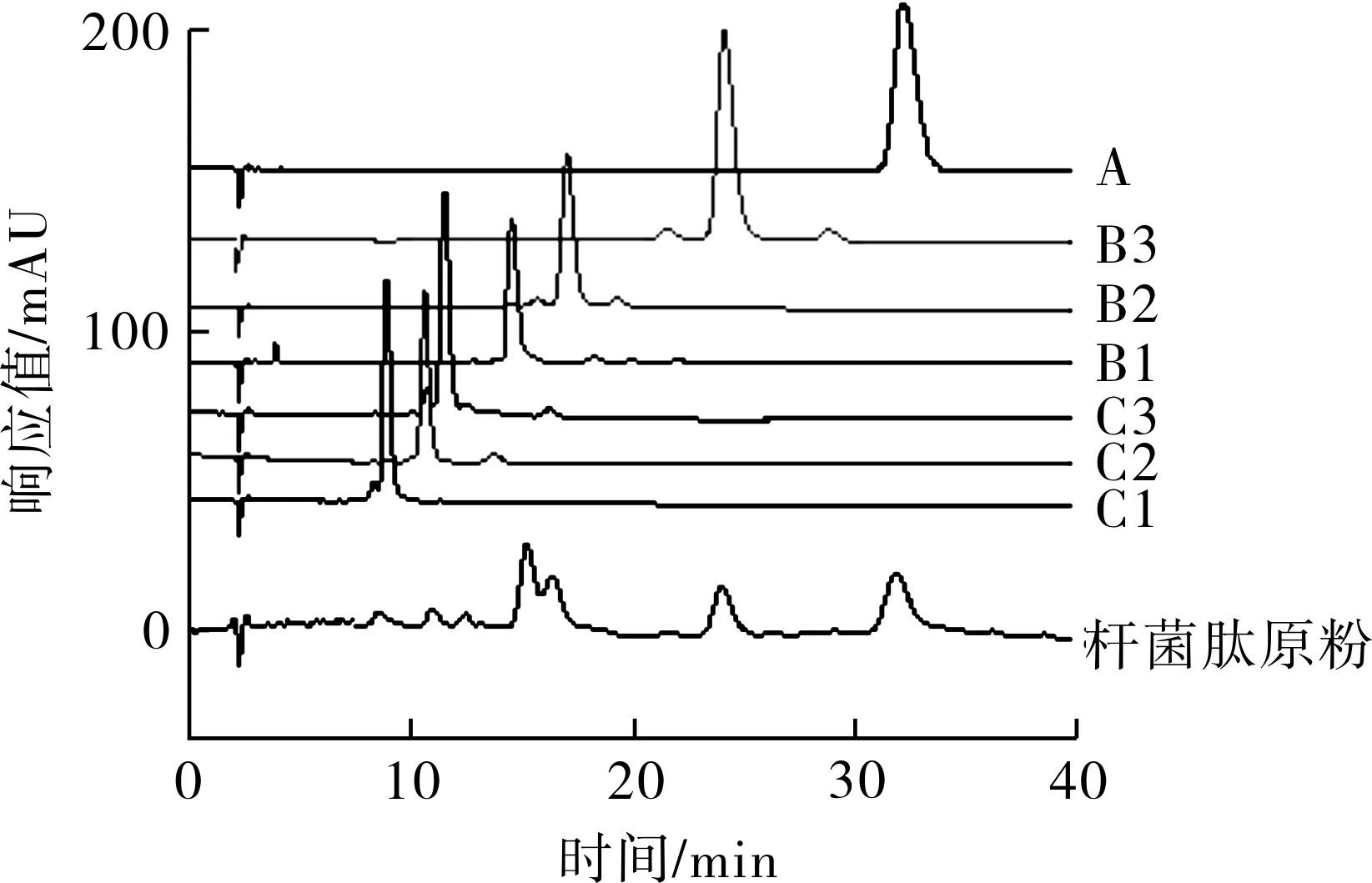
图3 杆菌肽原粉及各组分的HPLC色谱图
3 讨论
杆菌肽是一种多组分的多肽类抗生素,在发酵产物中A和B的含量总和在96%左右,其它组分含量很低。要分离制备出杆菌肽的各组分,难度很大,目前相关方面的报道极少,并且工艺复杂。本文主要介绍用制备型高压液相色谱仪分离制备出杆菌肽A、B1、B2、B3、C1、C2、C3等7个组分的方法(7个组分的详细分析数据和谱图将另文发表),产品纯度均在95%以上。此方法操作简单,所用有机溶剂可回收,对环境污染小,为杆菌肽的分离纯化奠定了基础。
[1] 张炜,张雪霞,耿文飞,等.一种杆菌肽及其锌盐的制备方法:中国,CN201610097982.X.[P].2016-04-20.
[2] 徐加兵,魏晓东,那可,等.杆菌肽产生菌的诱变育种及培养基优化[J].中国医药工业杂志,2013,44(5):446-448,452.
[3] 徐超,吕凤霞,别小妹,等.地衣芽孢杆菌Bacitracin A高产工业培养基优化[J].食品工业科技,2016,37(18):197-201,207.
[4] 胡立勇,宋友礼.杆菌肽的研究[J].国外医药:抗生素分册,1988,9(1):55-64.
[5] RAUSSENS V,NARAYANASWAN V,GOORMAGHTIGH E,et al.Hydrogen/deuterium exchange kinetics of apolipophorin-Ⅲ in lipid-free and phospholipid-bund states.An analysis by Fourier transform infrared spectroscopy[J].J Biol Chem,1999,271(38):89.
[6] 谢瑞,李力,张明亮,等.杆菌肽高产菌株的诱变选育[J].食品工业科技,2015,36(11):188-192,196.
[7] 杨宏,李军,孙立文,等.一种提取分离杆菌肽的方法:中国,CN102153633A[P].2011-08-17.
[8] 宋如,彭敬梅,张健,等.高效液相色谱法测定杆菌肽的含量[J].河北化工,2009,32(9):70-71.
[9] 王茉莉,宋更申,常俊山.HPLC法同时测定杆菌肽原料药中主成分的含量及有关物质[J].中国药房,2015,26(6):834-837.
[10] PAVLI V,KMETEC V.Pathways of chemical degradation of polypeptide antibiotic bacitracin[J].Biol Pharm Bull,2006,29(11):2160-2167.
[11] 李伟,欧阳藩.制备色谱操作条件的优化[J].生物技术通报,2000(2):32-35.
[12] 宁德生,梁小燕,方宏,等.半制备高压液相色谱法制备罗汉果苷V标准品[J].食品科学,2010,31(12):137-140.
[13] GOVAERTS C,LI C,ORWA J,et al.Sequencing of bacitracin A and related minor components by liquid chromatography/electrospray ionization ion trap tandem mass spectrometry[J].Rapid Commun Mass Spectrom,2003,17(12):1366-1379.

