两种不同骨替代材料在上颌前牙区种植体周围骨缺损中的应用效果评价
王鸣照,何家才
(安徽医科大学口腔医学院、安徽医科大学附属口腔医院种植中心,安徽 合肥 230032)
随着口腔种植技术的不断更新与成熟,不同类型的骨替代材料应用逐渐增加,越来越多的医生及患者更加重视上颌前牙区种植美学效果。本文研究对比了两种骨替代材料在上颌前牙区种植体周围骨缺损中的成骨能力及成骨效果,以期为美学区种植体周围骨缺损修复提供临床指导。
1 资料与方法
1.1 研究对象 选取2014—2016年就诊于安徽医科大学附属口腔医院种植中心的上颌前牙区种植体周围骨缺损患者20例,其中女性8例,男性12例,共计植入32枚种植体。其中Bio-Oss组18枚,PerioGlas组14枚,所有病例均上覆Bio-Gide胶原膜。患者术区上前牙剩余牙槽骨宽度3~5 mm,骨高度足够。
1.2 方法
1.2.1 材料与器械 种植机:MD200种植机(瑞士);种植体:NobelReplaceTM种植体及配件(Nobel Biocare,瑞典);Straumann Bone Level Implant种植体及配件(Straumann,瑞士);骨替代材料:Bio-Oss人工骨粉(瑞士盖氏制药有限公司);倍骼生(PerioGlas,美国诺邦生物制品有限公司);Bio-Gide胶原膜(瑞士盖氏制药有限公司)。
1.2.2 手术方法 常规消毒铺巾,术区阿替卡因肾上腺素局部浸润麻醉,即刻或延期行种植体植入术。在牙槽嵴顶做水平切口并在颊侧做减张切口,翻瓣、暴露牙槽骨,逐级扩孔备洞至预设直径后植入种植体,上覆封闭螺丝,植体周围骨缺损区植入Bio-Oss骨粉或PerioGlas ,上覆Bio-Gide膜,缝合关闭窗口。术后锥形束CT(CBCT)检查,1周拆除缝线,6个月后行二期手术,即行永久冠修复。分别于术后6个月和12个月拍摄CBCT复诊检查。前牙区种植体植入及冠修复过程见图1。
1.3 评价指征 于种植体植入术后6个月和12个月的定期随访。以术后6个月检查为基准,计算种植体的存留率,评估红色美学指数(PES),测量边缘骨水平及唇腭向骨板宽度,以及调查患者满意度。所有患者均拍摄术前术后CBCT,所有测量指标均由同一名医生进行观察评估。
1.3.1 成功率标准 目前国际上公认的种植体植入成功的评判标准是Albrekkson等[1]于1986年在骨结合会议上制定的标准,包括以下特征:临床检查中,植入的种植体无松动症状,放射学检查中种植体周围骨组织无低密度阴影区,植体负重后每年骨吸收量低于0.2 mm,患者无明显不适、感觉异常、疼痛、麻木等症状。5年累计成功率不低于85%,10年累计成功率不低于80%。本研究因需要测量骨吸收改变量,仅按照Wheeler等[2]推荐的种植体存留标准,将种植体存留率作为种植义齿修复成功的指标。
1.3.2 软组织评估 2005 年 Fürhauser等[3]提出了美学区种植体周软组织评估指标PES。PES共包括7个参数:近中龈乳头、远中龈乳头、唇侧龈缘水平、软组织形态、牙槽突外形、软组织颜色、软组织质地,每个参数等级评定有 0、1、2 三个等级,2代表最佳,0代表最差,总分最高为14,最低分为0,分别代表种植体周软组织美学疗效最佳和最差。

注:A.术前口内照,11、21缺失;B.术中翻瓣后,可见上颌前牙区唇侧骨板凹陷;C.植入两枚ITI种植体;D.前牙区分别入两种骨替代材料,11处为Bio-Oss骨粉,21处为PerioGlas骨粉;E.上前牙区植骨区域上覆Bio-Gide胶原膜;F.缝合关闭创口;G.试戴永久基台及修复冠;H.最终黏接后口内照片;I.从左至右依次为右上1术前、术后、术后6个月、术后12个月的CBCT;J.从左至右依次为右上1术前、术后、术后6个月、术后12个月的CBCT。
图1 前牙区种植体植入及冠修复过程
1.3.3 骨组织评估 唇腭向骨板宽度,通过CBCT测量种植体周围术前、术后、术后6个月及术后12个月的唇腭向骨板宽度,分析比较Bio-Oss组和PerioGlas组的骨吸收状况。边缘骨水平(MBL)即边缘骨水平的改变,于术后6个月、术后12个月,以种植体平台为参考点,测量种植体平台到牙槽骨边缘与种植体相结合处的距离,分别测量近远中边缘骨水平,此处边缘骨水平测量值为近远中边缘骨水平的平均值。
1.3.4 患者满意度调查 患者主观满意度问卷调查参考 Pjetursson等[4]的研究, 内容包括:咀嚼功能, 敢用种植牙咬(和自己的牙相比较) ,是否存在异物感,发音,美观,是否易清洁,清洁方便度,舒适程度,需要复查,达到预期效果,是否会再种,是否会推荐他人,是否物有所值,总体满意度。患者对上述14项问题进行参考评价,患者根据主观评价给予相应评价,分为满意,较满意,不满意。
1.4 统计学方法 使用SPSS 17.0软件进行数据分析,两组间术后PES的差异采用两组独立样本t检验进行分析;采用重复测量方差分析对两组在4个时间点(术前、术后、术后6个月和术后12个月)的唇腭向骨板宽度进行分析,采用协方差分析分别对两组间术后与术后6个月唇腭向骨板宽度的改变量、术后6个月与术后12个月唇腭向骨板宽度的改变量、术后6个月与术后12个月MBL的改变量进行分析,P<0.05为差异有统计学意义。
2 结果
术后随访1年,种植体存留率100%。患者主观评价均为满意与较满意。
2.1 两组PES的比较 采用独立样本t检验分别对术后6个月、术后12个月的PES进行分析,结果发现:术后6个月、术后12个月两种骨替代材料的PES均差异无统计学意义,具体数据见表1。

表1 术后6个月和术后12个月两种骨替代 材料PES值的比较
2.2 两组的唇腭向骨板宽度比较 采用重复测量方差分析法对两种骨替代材料四个时间点(术前、术后、术后6个月和术后12个月)的唇腭向骨板宽度进行分析,结果发现:两种骨替代材料四个时间点唇腭向骨板宽度的差异有统计学意义(P<0.001),且两组在四个时间点上的差异有统计学意义(P=0.007),具体数据见表2。
采用协方差分析对术后与术后6个月唇腭向骨板宽度的改变量(即:以组别为固定因素,术后唇腭向骨板宽度为协变量,术后6个月唇腭向骨板宽度为因变量)进行分析,结果发现:组别对术后6个月唇腭向骨板宽度有影响(P<0.001),术后唇腭向骨板宽度对术后6个月唇腭向骨板宽度有影响(P<0.001),即两组间术后与术后6个月唇腭向骨板宽度改变量的差异有统计学意义,具体数据见表3。
采用协方差分析对术后6个月与术后12个月唇腭向骨板宽度的改变量(即:以组别为固定因素,术后6个月唇腭向骨板宽度为协变量,术后12个月唇腭向骨板宽度为因变量)进行分析,结果发现:不同组别中术后12个月唇腭向骨板宽度差异无统计学意义(P=0.963),但术后6个月唇腭向骨板宽度对术后12个月唇腭向骨板宽度有影响(P<0.001),即两组间术后6个月与术后12个月唇腭向骨板宽度改变量的差异无统计学意义,具体数据见表3。
2.3 两组MBL的比较 采用协方差分析对术后6个月与术后12个月MBL的改变量(即以组别为固定因素,术后6个月MBL为协变量,术后12个月MBL为因变量)进行分析,结果发现:组别对术后12个月MBL没有影响(P=0.440),但术后6个月MBL对术后12个月MBL有影响(P<0.001),即两组间MBL改变量的差异无统计学意义,具体数据见表4。
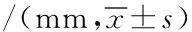
表2 四个时间点两种骨替代材料唇腭向骨板宽度的比较
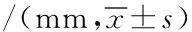
表3 两种骨替代材料术前术后唇腭向骨板宽度改变量的比较
注:“—”表示无统计量或P值。
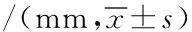
表4 两种骨替代材料术后MBL改变量的比较
注:“—”表示无统计量或P值。
3 讨论
由于上颌前牙区的临床位置及其解剖特点,前牙缺失后剩余牙槽骨唇腭向宽度不足在临床上十分常见。目前应用于口腔颌面部的骨替代材料有自体骨、同种异体骨、异种骨和人工无机材料。自体骨被视为骨移植的金标准材料,因为其具有较好的骨诱导性、骨传导性和成骨特性[5],这些良好的特性源自于其结构和细胞蛋白成分[6],与其他骨替代材料相比,自体骨移植材料的愈合速度较快[7],然而自体骨的获取需要额外的手术位点,更多的手术时间,相应的手术风险和术后并发症的发生概率也随之增高,同时,移植的自体骨组织也比较容易萎缩[8]。人工骨替代材料可以避免自体骨移植的二次手术和供区创面,材料来源相对安全,患者接受度高。现有的研究显示:无论单独使用还是和自体骨组织混合使用,骨替代材料都能起到和自体骨一样的效果[9-10]。研究还显示:种植于单纯的骨替代材料或者混合有自体骨的骨替代材料的种植体的存活率要优于种植于100%自体骨的种植体[11-12]。
在本研究中,主要对比Bio-Oss和PerioGlas两种骨替代材料在上颌前牙区的应用效果。Bio-Oss是一种类似人体骨质的脱蛋白牛骨矿物质,为颗粒和多孔骨块形式,具有骨传导性,在成骨微环境中会形成骨陷窝结构,但其黏附作用较弱,易从缺损处流失,需与可吸收或不可吸收的屏障膜等配合使用,但对于Bio-Oss的吸收性能,有一定的争议性。现有文献的研究结果显示,随着时间的推移,该材料很难完全吸收[13-14]。PerioGlas作为一种生物活性玻璃,由45%的二氧化硅,24.5%的氧化钙,24.5%的Na2O以及6%的P2O5组成,具有良好的骨诱导性和可吸收性, 因此可以在其自身消融的过程当中引导自身新骨形成,最终使缺损区为正常骨组织替代[11]。PerioGlas含有的钙磷成分会在体内环境中形成碳酸羟基磷灰石层,该过程始于pH值的改变,导致钙、磷、钠等离子的迁移。硅和磷酸钙的释放可以刺激成骨细胞的增殖,成骨细胞会在钙磷基质中进一步产生胶原纤维,形成一个厚度为100~200 μm的骨-生物玻璃的相互作用界面,这在骨再生的过程中起着尤为重要的作用。但是生物玻璃有一定的脆性,所以不适合应用于压力负载过大的种植区域[15-18]。本课题中采用的PerioGlas为注射型骨替代材料,易于操作,可塑性强,可以完全适应上颌前牙骨缺损区的复杂形态,并与自体骨组织结合紧密。然而,其机械强度较Bio-Oss低,吸收速度较Bio-Oss快,很容易造成植骨区强度不够,致使在新骨形成前无法提供足够的机械支持。
上颌前牙区软组织的美学效果同样也需要足够的骨量支持,缺牙区牙槽骨的厚度是保证软组织美学效果的关键。本课题中两组骨替代材料PES在术后6个月和术后12个月比较差异无统计学意义(P>0.05),说明Bio-Oss和PerioGlas都具有良好的成骨效果,所以在软组织的美学上差异性较小。对于软组织处理,所有植骨者均采用梯形切口,唇侧软组织瓣进行适当的松解,尽量保存原有牙龈乳头的形态,尽可能保留附着龈和游离龈,减少张力,同时保持瓣的血供。唇腭向骨板厚度在两种骨替代材料使用后对比,术后、术后6个月、术后12个月均P<0.05,说明两者在骨增量方面具有一定的差异性,对比植骨后术后与术后6个月之间骨吸收差值分析,差异有统计学意义(P<0.05),说明PerioGlas的吸收程度大于Bio-Oss。对比植骨后术后6个月与术后12个月之间骨吸收差值分析,差异无统计学意义(P>0.05),说明该阶段两种骨替代的吸收情况趋于稳定。对比植骨后术后6个月与术后12个月之间边缘骨水平改变量,差异无统计学意义(P>0.05),说明两种骨替代材料使用后骨重建活动区域稳定。
在本课题长期观察中发现,种植体颊侧骨缺损区域植骨术后上覆Bio-Gide膜,可以有效的减少颊侧骨吸收,对于唇腭向骨板厚度较小的病例,植入的种植体方向会偏向腭侧,修复时将采用角度基台修复或者改变螺丝固位开口方向,在有些通过植骨后仍无法达到一定美学效果的,可以通过在修复冠上增加粉红色牙龈瓷来增加修复美学。在使用PerioGlas时,对于骨缺损范围较小的区域可不覆生物膜,其成型性较好,但稳定性较差,在缝合过程中应严密无张力缝合创口,避免创口破裂,导致术后感染及骨替代材料溢出。
综上所述,两种骨替代材料对上颌前牙区种植体周围骨缺损均有较好的临床效果,但因随访时间较短,样本量较小,对种植修复的长期效果仍有待进一步探讨。
[1] ALBREKTSSON T,ZARB G,WORTHINGTON P,et al.The long-term efficacy of currently used dental implants:a review and proposed criteria of success[J].Int J Oral Maxillofac Implants,1986,1(1):11-25.
[2] WHEELER SL,HOLMES RE,CALHOUN CJ.Six-year clinical and histologic study of sinus-lift grafts[J].Int J Oral Maxillofac Implants,1996,11(1):26-34.
[3] FÜRHAUSER R,FLORESCU D,BENESCH T,et al.Evaluation of soft tissue around single-tooth implant crowns:the pink esthetic score[J].Clin Oral Implants Res,2005,16(6):639-644.
[4] PJETURSSON BE,KAROUSSIS I,BÜRGIN W,et al.Patients' satisfaction following implant therapy A 10-year prospective cohort study[J].Clin Oral Implants Res,2005,16(2):185-193.
[5] BLOCK MS,KENT JN,KALLUKARAN FU,et al.Bone maintenance 5 to 10 years after sinus grafting[J].J Oral Maxillofac Surg,1998,56(6):706-714.
[6] KHAN SN,BOSTROM MP,LANE JM.Bone growth factors[J].Orthop Clin North Am,2000,31(3):375-388.
[7] DEL FABBRO M,TESTORI T,FRANCETTI L,et al.Systematic review of survival rates for immediately loaded dental implants[J].Int J Periodontics Restorative Dent,2006,26(3):249-263.
[8] VAN DEN BERGH JP,TEN BRUGGENKATE CM,KREKELER G,et al.Maxillary sinusfloor elevation and grafting with human demineralized freeze dried bone[J].Clin Oral Implants Res,2000,11(5):487-493.
[9] WALLACE SS,FROUM SJ.Effect of maxillary sinus augmentation on the survival of endosseous dental implants A systematic review[J].Ann Periodontol,2003,8(1):328-343.
[10] PJETURSSON BE,TAN WC,ZWAHLEN M,et al.A systematic review of the success of sinus floor elevation and survival of implants inserted in combination with sinus floor elevation[J].J Clin Periodontol,2008,35(8 Suppl):216-240.
[11] AGHALOO TL,MOY PK.Which hard tissue augmentation techniques are the most successful in furnishing bony support for implant placement[J].Int J Oral Maxillofac Implants,2007,22(Suppl):49-70.
[12] DEL FABBRO M,ROSANO G,TASCHIERI S.Implant survival rates after maxillary sinus augmentation[J].Eur J Oral Sci,2008,116(6):497-506.
[13] HALLMAN M,LUNDGREN S,SENNERBY L.Histologic analysis of clinical biopsies taken 6 months and 3 years after maxillary sinus floor augmentation with 80% bovine hydroxyapatite and 20% autogenous bone mixed with fibrin glue[J].Clin Implant Dent Relat Res,2001,3(2):87-96.
[14] YILDIRIM M,SPIEKERMANN H,BIESTERFELD S,et al.Maxillary sinus augmentation using xenogenic bone substitute material Bio-Oss in combination with venous blood A histologic and histomorphometric study in humans[J].Clin Oral Implants Res,2000,11(3):217-229.
[15] GORUSTOVICH A,ROSENBUSCH M,GUGLIELMOTTI MB.Ch-aracterization of bone around titanium implants and bioactive glass particles:an experimental study in rats[J].Int J Oral Maxillofac Implants,2002,17(5):644-650.
[16] SAN MIGUEL B,KRIAUCIUNAS R,TOSATTI S,et al.Enhanced osteoblastic activity and bone regeneration using surface-modified porous bioactive glass scaffolds[J].J Biomed Mater Res A,2010,94(4):1023-1033.
[17] Ananth H,Kundapur V,Mohammed HS,et al.A Review on Biomaterials in Dental Implantology[J].Int J Biomed Sci,2015,11(3):113-120.
[18] GATTI AM,SIMONETTI LA,MONARI E,et al.Bone augmentation with bioactive glass in three cases of dental implant placement[J].J Biomater Appl,2006,20(4):325-339.

