覆盖对中小径级毛竹林地土壤细菌群落的影响
李伟成,杨慧敏,高贵宾,温星,盛海燕3*
(1.国家林业局竹子研究开发中心/浙江省竹子高效加工重点实验室,杭州310012;2.西南林业大学生命科学学院,昆明650224;3.杭州环境保护科学研究院,杭州310005)
20世纪70年代至21世纪初,竹类植物对缓解森林资源供需矛盾和协调森林经济效益做出了巨大贡献[1]。第八次全国森林资源清查(2009—2013年)数据表明,我国竹林面积为6.01×106hm2,其中毛竹林占70%以上[2]。毛竹(Phyllostachys edulis)是我国最主要的笋材两用竹种,其用途范围广泛,造林后可持续经营,已在南方诸省得到规模化推广。然而,现有毛竹林多数为中小径级低产林,且面临着林地衰退、经济下滑、劳动力和农资成本不断上升等问题[2],因此,对中小径级毛竹林进行大面积改造的意义不大。综合考虑其潜在的利用价值,改善其生态系统环境,探索新的“春笋冬出”地表覆盖模式已成为毛竹林可持续经营亟待解决的问题。
利用农林剩余物覆盖的技术兴起于澳大利亚和美国,目前在我国的应用亦十分广泛。我国农林剩余物多为有机物料,种类丰富,如砻糠和果壳、秸秆类(包括稻草、麦秆和玉米秆等)、树叶(包括竹叶)和锯末(包括木材和竹材)等[3-4]。覆盖技术具有平衡土壤水分和肥力,改善土壤-大气的界面层气流和热量状况等多方面的生态效应[5],已成为许多国家和地区广泛采用的土壤管理调控技术之一[6-7]。研究发现,地膜或杂草覆盖有蓄水保墒的作用,可促进土壤功能微生物群的活动[3]。一方面,施肥和地膜覆盖使土壤微生物多样性受短期土壤养分环境改变的影响[8];另一方面,长期管理措施使土壤结构和组成成分发生明显的改变,从而影响微生物的群落结构、功能及代谢活性[7]。针对中小径级毛竹林经济效益日趋衰退的现状,实施以冬季覆盖地表增温和重度施肥为技术核心的“春笋冬出”集约栽培可实现巨大的经济效益。然而,毛竹林地覆盖经营中大量引入有机覆盖物和化学肥料(氮肥为主),极易导致生态系统退化,爆发式萌发休眠芽,打破自身固有的生长发育与繁殖生活史节律,是一种被动适应[2],严重影响毛竹林的可持续经营。研究表明,土壤微生物是维持土壤系统稳定性、健康和质量的关键因素[9],对植物生长也具有重要作用[7,10-11]。
长期覆盖和重度施肥模式对环境和资源进行了高强度人为干扰,被大量引入毛竹林地的外源有机物料与毛竹林地自然凋落物的分解过程不同,而微生物活动是控制分解过程最为关键的因子[7]。在这种强选择压下,人工毛竹林系统与近自然毛竹林生态系统存在怎样的差异、其土壤细菌多样性如何变化、轮休是否为覆盖作业的必要补充、以及如何提升土壤微生物多样性与群落结构等问题亟待解决。因此,本试验以中小径级的低产毛竹林为研究对象,基于覆盖和轮休的不同状态,分析覆盖毛竹林的土壤微生物群落变化特征,探讨不同经营状态对毛竹林生态系统土壤微生物结构的影响,为中小径级低产毛竹定向培育和衰退毛竹林生态修复技术的研究提供技术支撑和数据参考。
1 试验地自然概况
毛竹覆盖试验地位于浙江省湖州市长兴县小浦镇葡萄岕(119°45′51″E,30°58′59″N),属亚热带海洋性季风气候。年平均气温(15.6±0.5)℃,有效积温5 750℃,无霜期239 d,年平均降水量1 309 mm,年平均日照时数1 810.3 h,历年平均日照百分率为41%,光照分配较均匀。土壤以发育于酸性岩浆岩的红壤为主。试验地土壤层深厚,可达1.5 m。林地海拔77~81 m,坡度<5°,坡向(东南坡,SE)161°~166°,土壤有机质平均质量分数为30.2 g/kg,全氮1.16~2.24 g/kg,有效磷98.00~101.76 mg/kg,速效钾54.75~92.61 mg/kg。
2 材料与方法
2.1 试验设计
试验地从2009年开始进行覆盖轮休(3年覆盖+2年轮休为1个周期)经营,面积共2 hm2。覆盖试验地母竹平均胸径9.4 cm。当年留养1~5年生母竹2 700~3 300株/hm2。5—6月进行垦复,垦复深度10~15 cm,并抛施行鞭肥[750 kg/hm2复合肥,硫酸钾型m(N)∶m(P2O)∶m(K2O)=15∶15∶15;以下所用复合肥都为此成分];8—9月施孕笋肥(1 500 kg/hm2复合肥);10—11月,满园灌水,竹林土壤湿度>80%,然后施7 500 kg/hm2鸡粪有机肥(鸡粪干物质约含粗蛋白19.3%、脂肪2.4%、灰分13.1%、糖类10.3%、纤维7.2%,氮2.45%、磷2.66%、钾0.91%)+1 875 kg/hm2竹炭肥(C/N=14.7,pH 8.13~8.50,电导率5.47 mS/cm,含水率30.5%,N 11.9%,P2O54.8%,K2O 5.7%)[2],覆土;11—12月,对毛竹林地进行双层覆盖,下层稻草(15~20 cm)起发酵增温作用,同时施水,上层谷壳(20~25 cm)起保温作用。轮休区域1~5年生母竹2 250~3 000株/hm2,其中2、3、4年生竹比例达到80%,1年和5年生竹控制在20%;同时,5—6月初垦复并施行鞭肥(750 kg/hm2复合肥),8—9月施孕笋肥(750 kg/hm2复合肥),并平整地块。
样地划分为对照(从未实施覆盖和施肥)、第2年覆盖、第2年轮休和2009—2015年长期覆盖,样地状况详见表1。2016年3月进行土壤取样。每块样地内设置5 m×5 m的样方5个,沿样方对角线每隔1~2 m确定取样点,去除表层凋落物和杂质后,用土钻取深度为0~20 cm土壤,样方内的土样混合均匀,去除根和石头,放置于干冰低温采样箱内。4~6 h内带回实验室,保存于-80℃超低温冰箱中,用于DNA的提取和后续试验。
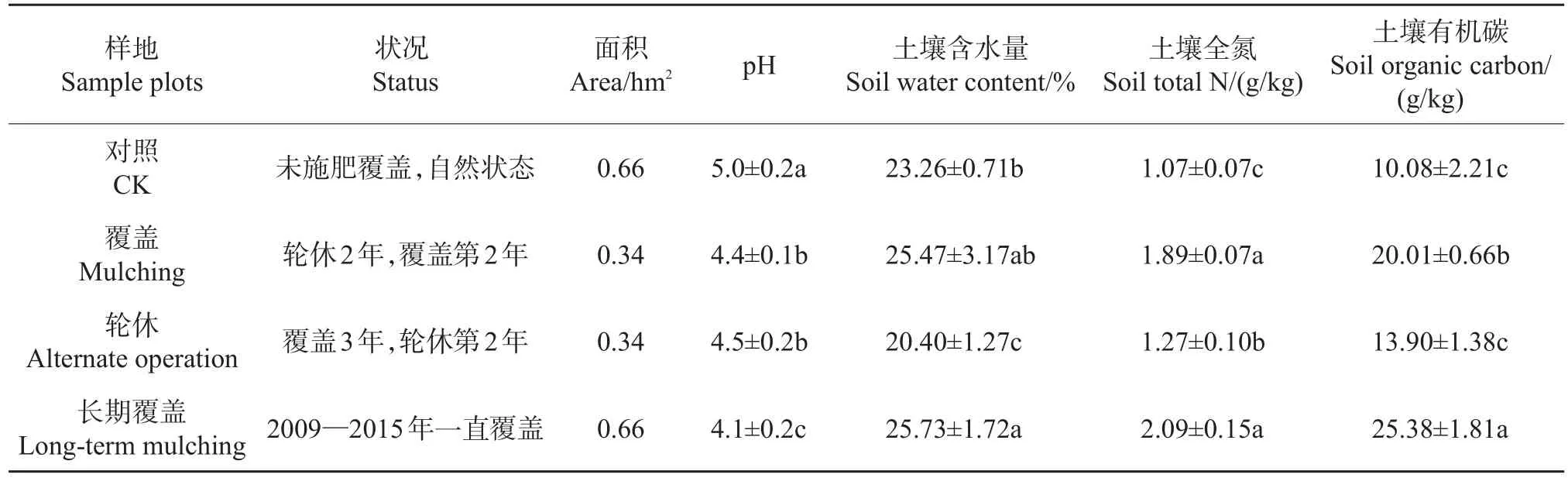
表1 样地经营状态Table 1 Status of sample plots
2.2 DNA提取、聚合酶链式反应和Illumina Miseq测序
DNA提取采用TIANamp Stool DNA试剂盒[购自天根生化科技(北京)有限公司]。对微生物基因组16S rDNA v3/4高变区进行扩增,引物序列如下。上游引物:CCTACGGGNGGCWGCAG;下游引物:GACTACHVGGGTATCTAATCC。
聚合酶链式反应(polymerase chain reaction,PCR)体系:模板量约为10 ng;1×反应缓冲液(NEB Q5TM)、0.3 mmol/L dNTP、1 U HotStarTaq聚合酶共10µL;10µmol/L上游引物和10µmol/L下游引物各1µL(Invitrogen公司,美国);然后加Ambion无核酸酶水(Thermo Fisher Scientific公司,美国)至20µL。PCR反应条件:94℃预变性2 min;94℃变性20 s,52 ℃退火40 s,72 ℃延伸1 min,35个循环;72℃保持2 min;4℃保存。样本添加特异性标签序列,采用以下PCR反应体系:模板量1µL(Amplicon PCR纯化后产物);1×反应缓冲液(NEB Q5TM)、0.3 mmol/L dNTP、1 U Q5TM DNA聚合酶(NEB公司,美国)共10µL;10µmol/L上游引物和10µmol/L下游引物各1µL(Invitrogen公司,美国);Ambion无核酸酶水(Thermo Fisher Scientific公司,美国)7µL。PCR反应条件:98℃预变性30 s;94℃变性10 s,65 ℃退火30 s,72 ℃延伸30 s,11个循环;72℃保持5 min。每个样品的PCR产物割胶回收后用紫外-可见分光光度计(NanoDrop ND1000,美国)测量其浓度。
文库构建和Illumina MiSeq测序由杭州晶佰生物科技有限公司进行。
2.3 测序数据分析
测序后的DNA序列采用PANDAseq进行拼接[11]。拼接后的序列应用USEARCH除去嵌合体[12],然后用QIIME软件将所有样品序列进行整合[13]。1个微生物可操作单元(operational taxonomic unit,OTU)为序列相似度大于97%的DNA序列。基于Greengenes v13_08数据库提取OTU并进行种属分类。去掉序列占比<0.005%的OTU,然后进行后续分析[14]。用QIIME软件计算多样性指数,包括Shannon指数、Chao1指数等。同时,比较不同样品原核生物群落的差异。利用SPSS 11.0软件的最小显著差数法(least-significant difference,LSD)进行多重比较分析;利用R语言软件的非加权UniFrac(unweighted UniFrac)进行土壤细菌群落结构的主坐标分析(principal co-ordinate analysis,PCoA)。
3 结果与分析
3.1 基于高通量测序的细菌群落结构
对照、覆盖、轮休和长期覆盖4类样地的样本覆盖度(最终测序结果占整个基因组的比例)分别为(98.99±0.12)%、(99.14±0.26)%、(98.92±0.20)%和(99.12±0.24)%,均大于95%,表明测序结果能代表样品中的细菌组成。经高通量测序发现,中小径级毛竹林4类经营状态下的样地细菌类群达到26门69纲118目197属。其中:对照样地的细菌类群为24门61纲99目132科156属,覆盖样地的细菌类群为24门62纲97目129科151属,轮休样地的细菌类群为24门60纲97目132科160属,长期覆盖样地的细菌类群为24门58纲88目123科150属。
3.1.1 门的分类水平
由图1可知:对照样地细菌类群在门的分类水平上的优势类群(平均所占比例大于5%)分别为酸杆菌门(Acidobacteria,44.22%)、AD3(14.21%)、变形菌门(Proteobacteria,8.23%)、绿弯菌门(Chloroflexi,7.91%)和疣微菌门(Verrucomicrobia,6.82%);覆盖样地细菌类群门水平上的优势类群分别为酸杆菌门(42.38%)、变形菌门(17.79%)、TM7(6.11%)、绿弯菌门(5.77%)和放线菌门(Actinobacteria,5.07%);轮休样地细菌类群门水平上的优势类群分别为酸杆菌门(30.85%)、AD3(15.18%)、变形菌门(14.72%)、放线菌门(8.39%)和绿弯菌门(7%);长期覆盖样地细菌类群门水平上的优势类群分别为酸杆菌门(34.43%)、变形菌门(25.41%)、TM7(6.68%)和放线菌门(6.65%)。比较各菌门数量发现:上述菌门中仅酸杆菌门在4类样地中都大量存在;对照样地中变形菌门、放线菌门、TM7和拟杆菌门(Bacteroidetes)数量较其他类型样地低,AD3、疣微菌门和GAL15的数量较其他类型样地高;覆盖样地的AD3和疣微菌门数量较少;长期覆盖样地中绿弯菌门和AD3数量较少。
3.1.2 属的分类水平
从表2中可以发现,在对照、覆盖、轮休和长期覆盖4块样地的20个土壤样品中,在属的分类水平上分别检测到(97.66±0.67)%、(97.63±0.33)%、(95.04±0.39)%和(98.58±0.51)%的明确分类信息。在属分类水平上(≥1.00%),Koribacteraceae科未定属(Koribacteraceae;g_)和Ellin6513目未定属(Ellin6513;f_;g_)在所有样地中都大量存在,且各样地间在统计学上差异显著(P<0.05);与对照样地相比较,覆盖、轮休与长期覆盖样地细菌比例明显上升(P<0.05)的有酸杆菌科未定属(Acidobacteriaceae;g_)、Solibacteraceae科未定属(Solibacteraceae;g_)、酸微菌目未定属(Acidimicrobiales;f_;g_)、Gaiellaceae科未定属(Gaiellaceae;g_)、Chitinophagaceae科未定属(Chitinophagaceae;g_)、鞘脂杆菌科未定属(Sphingobacteriaceae;g_)、纤线杆菌纲未定属(Ktedonobacteria;o_;f_;g_)、WD2101目未定属(WD2101;f_;g_)、变形菌门所有8个属、TM7-1纲未定属(TM7-1;o_;f_;g_)、auto67-4W科未定属(auto67-4W;g_)和WPS-2门未定属(WPS-2;c_;o_;f_;g_);而与其他3类样地比较(P<0.05),对照样地细菌比例明显上升的有Koribacteraceae科未定属(Koribacteraceae;g_) 、Ellin6513 目 未 定 属(Ellin6513;f_;g_)、AD3门2个未定属(ABS-6;o_;f_;g_和JG37-AG-4;o_;f_;g_)、B07-WMSP1目未定属(B07-WMSP1;f_;g_)、GAL15门未定属(GAL15;c_;o_;f_;g_)、芽单胞菌门Gemm-1目未定属(Gemm-1;o_;f_;g_)、Ellin515科 未 定 属(Ellin515;g_)和DA101属(DA101)。
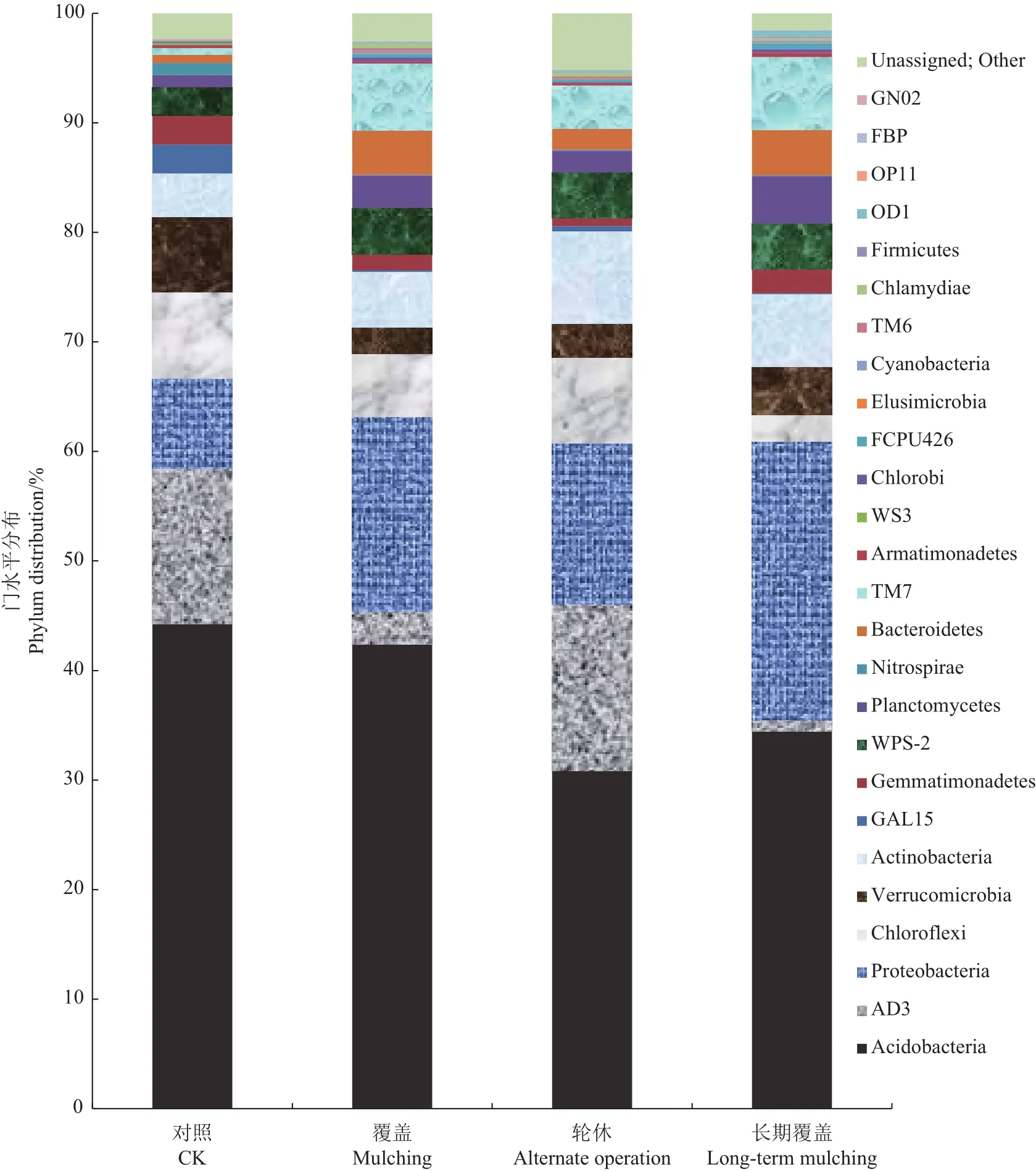
图1 4种经营类型毛竹林土壤细菌门分类水平分布Fig.1 Phylum distribution of soil bacteria in four types of sample plots
3.2 土壤细菌的多样性指数分析
α-多样性种类复杂度指数是对单个样本物种多样性的分析[15]。本试验对原始序列条数、OTU数、Shannon指数和Chaol指数进行了评价,结果(图2)显示:对照样地的原始序列条数最低,为(22 052±370)条,与其他3类样在统计学上差异显著(P<0.05),说明对照样地细菌群落在总体数量上处于弱势;而覆盖、轮休和长期覆盖的原始序列条数差异不显著,其中长期覆盖样地的原始序列条数平均值较低(24 437条)。OTU数表明,对照与长期覆盖样地差异不显著,而两者与覆盖和轮休样地都有显著
差异(P<0.05)。Shannon指数表明,对照样地的细菌物种多样性最低(8.33±0.33),且与其他3类样地有显著差异(P<0.05),覆盖与轮休两者间差异不显著,说明覆盖使毛竹林土壤的细菌物种多样性上升。长期覆盖样地的Chaol指数最低(1 342±34),且与其他3类样地有显著差异(P<0.05);覆盖轮休样地的Chaol指数最高(1 662±36),而与覆盖样地差异不显著,与对照和长期覆盖样地均有显著差异(P<0.05),说明长期覆盖样地使土壤细菌物种总数即丰度下降,而覆盖和轮休模式使土壤细菌丰度上升。
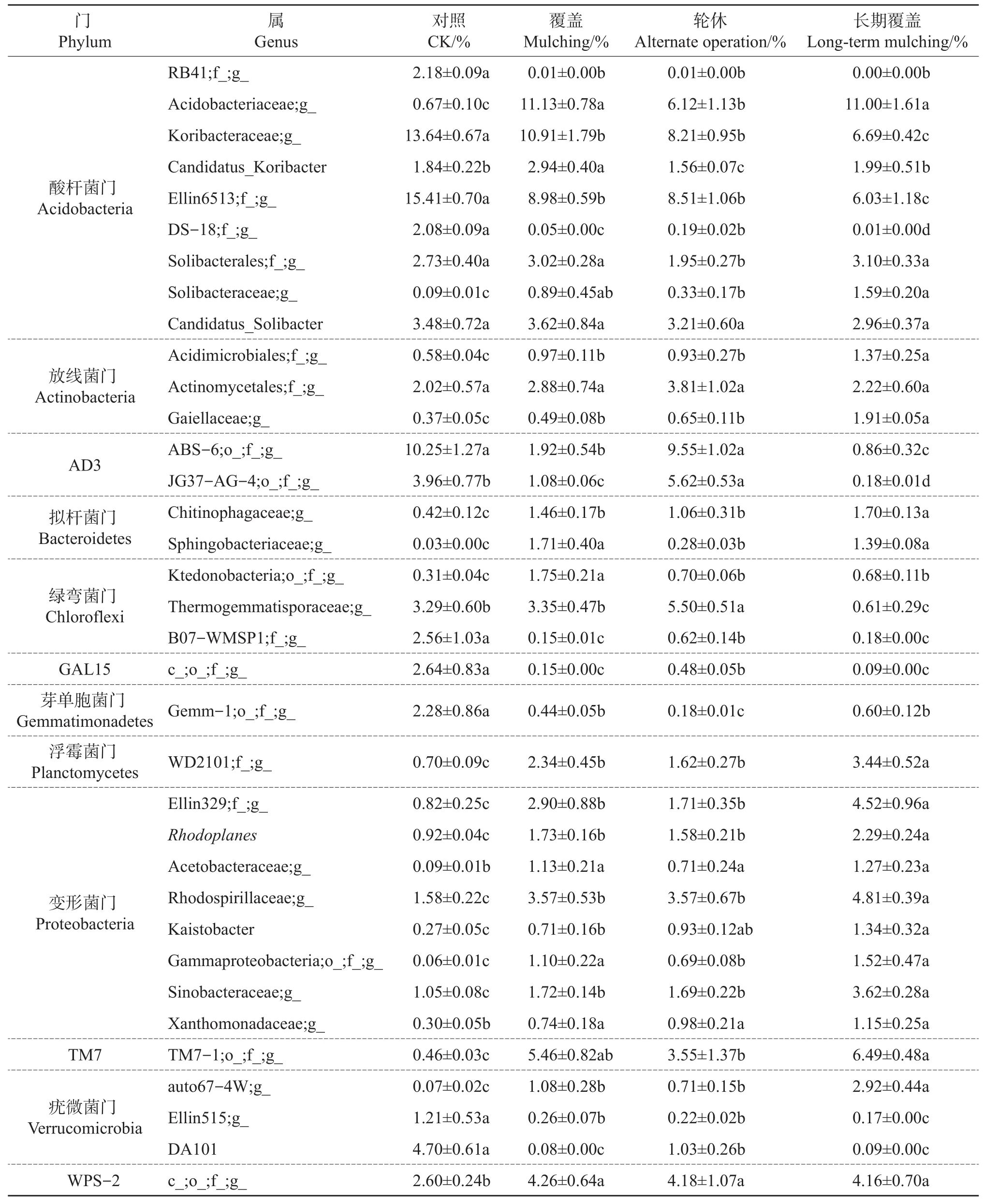
表2 4类样地细菌属分类水平的百分比(≥1.00%)Table 2 Percentage of bacterial community composition at genus level in four types of sample plots(≥1.00%)
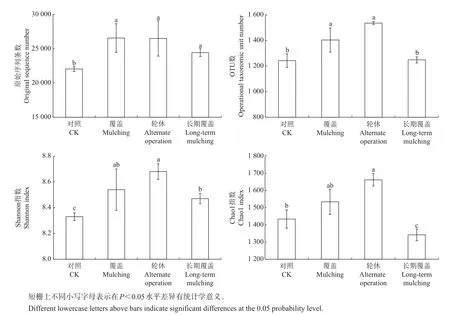
图2 4类样地物种种类复杂度Fig.2 Species complexity in four types of sample plots
3.3 土壤细菌群落的主坐标(PCoA)分析
PCoA是一种研究数据相似性或差异性的可视化方法,由物种组成的距离矩阵计算得到[16]。从图3中可以看出:PC1、PC2和PC3维度分别解释了70.69%、8.47%和7.71%的信息;供试的20个样地被分成2大部分,其中长期覆盖、覆盖和轮休样地从PC2由低向高分布,距离较近,而且各类型样地在图中的样点明显聚集,说明三者的土壤细菌群落结构组成有相似之处,且每一类型样地内部的细菌群落结构十分接近;而对照样地与前三者的距离较远,说明其与前三者的土壤细菌结构及物种组成有较大差异。
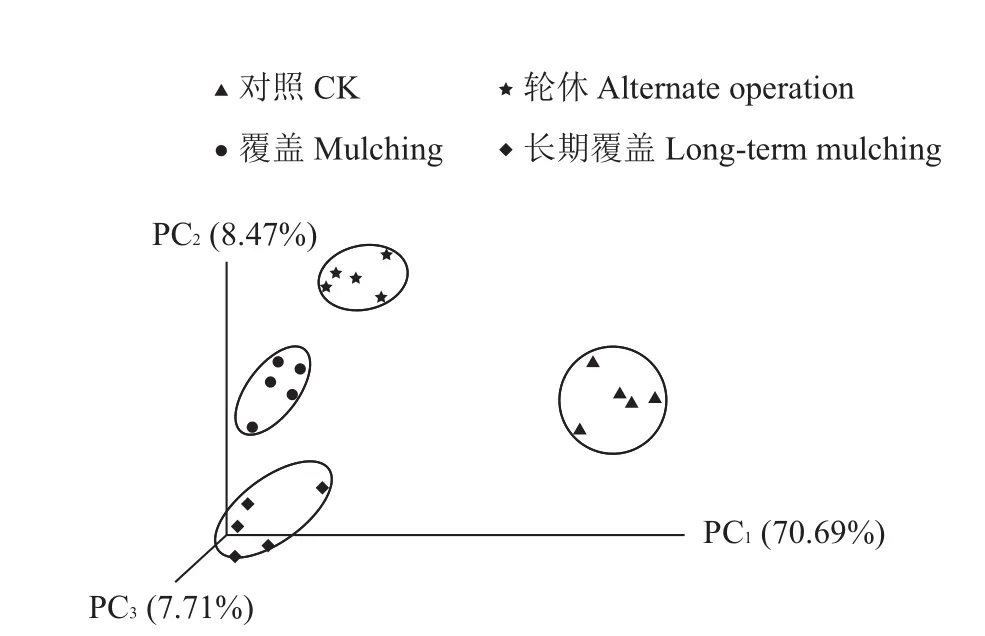
图3 4种经营类型土壤细菌群落结构的主坐标分析Fig.3 Principal co-ordinate analysis of soil bacterial community diversity in four types of sample plots
4 讨论
森林土壤微生物数量和群落结构受林地管理制度、土壤类型、土壤理化性质、植被类型等多种因素的影响[9,17],特别是不同林地管理方式对土壤的营养平衡和物质组成等产生作用,直接影响了土壤中微生物的多样性、群落组成和数量[18-20],进而对土壤中物质、能量的转化和营养物质的有效性产生影响[18-19]。本试验结果表明,在中小径级毛竹林的对照、覆盖、轮休和长期覆盖4类不同经营措施样地中,土壤细菌种群多样性覆盖了26门69纲118目197属,其中酸杆菌在4类样地中占优势(30.85%~44.22%),其次是变形菌(8.23%~25.41%)、绿弯菌(2.48%~7.91%)、疣微菌(2.39%~6.82%)、AD3(1.05%~15.18%)、放线菌(3.99%~8.39%)和TM7(0.61%~6.68%)。这与KAMLESH等[17]对不同类型耕作土壤细菌种群结构研究时发现的变形细菌居于主要地位而酸杆菌其次不同。本研究中酸杆菌占绝对优势而变形菌其次,而HANSEL等[20]在对不同地带性土壤的研究中也发现变形菌优势比酸杆菌大,造成这种差异的原因可能与毛竹林土壤原始的细菌类群组成结构有关,亦可能与森林土壤经营方式和土地利用方式不同有关[16]。本研究还发现,除变形菌和酸杆菌外,绿弯菌、疣微菌、AD3、放线菌和TM7在毛竹林土壤中占有一定优势。同时,在属的分类水平上,同一门的不同属对毛竹林覆盖技术的响应不同,如酸杆菌,这可能是由于酸杆菌门总丰度与pH值呈反比,但在不同pH值土壤中存在的酸杆菌门群组不同[21]。
土壤微生物数量巨大、种类繁多,传统分离培养的方法遗漏了土壤中绝大多数微生物,难以反映土壤微生物群落的丰度及其作用机制[12-13]。本试验对中小径级覆盖毛竹林土壤总DNA的16S rDNAv3/4高变区基因进行PCR扩增,利用Illumina Miseq高通量测序技术和生物信息学分析不同经营类型土壤细菌群落组成差异。研究发现,与其他3类样地相比,长期覆盖样地酸杆菌门3个未定属(Koribacteraceae;g_,Ellin6513;f_;g_和DS-18;f_;g_)、AD3门2个未定属(ABS-6;o_;f_;g_和JG37-AG-4;o_;f_;g_)、绿弯菌门的Thermogemmatisporaceae;g_和疣微菌门的Ellin515;g_数量显著下降,表明土壤微生物的分布与土壤环境密切相关,用土壤微生物相关指标来反映土壤肥力具有较大的应用潜力。
覆盖技术(包括重度施肥)对土壤的主要物理化学性质和微生物群落结构会产生显著影响,如造成土壤养分失衡、竹龄结构不合理、酶活性异常、重金属含量增加等一系列负面效应[22],严重影响竹林的可持续经营。本试验结果显示:与对照样地相比,其他3类样地土壤全氮和有机碳含量均提高。覆盖、轮休和长期覆盖3类样地的pH值显著下降,而且随着覆盖时间延长,土壤酸化越明显,这与多数竹林覆盖研究相同[5,22]。对照样地近自然经营状态,没有施肥,仅有采笋作业,故其土壤全氮和有机碳含量最低,覆盖和长期覆盖样地在大量使用有机覆盖物、有机肥和复合肥后,其土壤全氮和土壤有机碳含量明显增高,但长期覆盖的细菌数量、种群结构多样性却下降,这可能与土壤微生物对有机碳的利用效率较高有关[19,23];轮休样地在去除毛竹林内剩余有机质和浅层翻耕后,土壤全氮和有机碳含量较覆盖和长期覆盖都有所下降,对重度施肥后维持毛竹林土壤碳氮平衡颇有裨益。不同土壤施肥管理制度与外界环境条件的综合作用,造成了土壤理化性质的显著差异,进而影响土壤微生物群落结构和多样性[4-5,7,17]。本试验覆盖(主要为有机覆盖物、有机肥和复合肥)后的土壤pH值下降,这为酸杆菌提供了适宜的生长环境,使其多样性和相对丰度增加;同时,土壤有机质和养分含量提高,变形菌大部分类群为异养或者兼性营养菌,有机底物和养分为这部分微生物类群的生长提供了可溶性营养物质和能量[19]。此外,由于土壤有机质及矿物质颗粒共同参与土壤团聚体形成,因此,在一定经营时间内,覆盖技术改良了毛竹林土壤,为土壤微生物提供了良好的栖居环境,调控了土壤微生物群落的代谢功能和结构[3,24]。
土壤养分是土壤微生物的能量源,同时依赖土壤微生物的转化而得到补充,因此微生物和土壤质量之间存在复杂的相互作用[16,18]。张瑞等[25]认为,添加有机肥有利于土壤微生物代谢活性和微生物群落功能的多样性,单施氮磷钾复合肥和氮肥促进了少数几类微生物生长,而其他类群微生物相对丰度降低。WESSEN等[26]发现,在裸地使用化肥可提高土壤微生物群落的多样性和丰度,但长期施化肥则使细菌和古菌多样性下降。袁红朝等[19]认为,季节性林地覆盖对土壤固氮菌数量的影响不显著,对土壤细菌、真菌、放线菌及氨化菌数量的影响极显著。本试验中的α-多样性分析和PCoA分析表明,覆盖经营对土壤细菌的种群多样性和群落结构产生了较大影响。覆盖提高了细菌数量、种类和丰度,产生这种差异的原因在于大量C/N比高的有机质为细菌提供了基本的碳源和能源,有利于其数量和丰度的增加;而土壤表面浅层翻耕处理使其不受机械干扰,短时间内形成0~20 cm厚的半腐熟有机物质层,同样为细菌繁殖提供能源,这与高云超等[27]在半干旱半湿润地区石灰性土壤试验中发现的浅层翻耕土壤有利于细菌生长的结果类似。同时,有机物料和有机肥(腐熟鸡粪)自身携带的微生物也增加了覆盖后竹林土壤细菌的多样性,且土壤里残余的大量纤维素在分解过程中产生的中间产物(有机酸、糖类等)能促进细菌的增殖,说明在一定时间范围内,重度配比施化肥、氮磷钾复合肥和有机肥可以促进土壤微生物生长。生态系统生物多样性对于系统稳定性有所影响,就群落水平而言,种群多样性高的群落,系统稳定性强,抵抗干扰的能力强[16,20,24]。本试验发现,轮休样地的细菌数量、种类和丰度均为最高,说明轮休恢复土壤细菌群落多样性的效果明显,长期覆盖在细菌数量、种类和丰度上均有所下降,其Chao1指数甚至显著低于对照样地,说明长期覆盖样地对土壤细菌群落已产生抑制作用,干扰强度过大已超出微生物的恢复能力[23],不利于长期可持续经营。
[1] 李伟成,盛海燕,钟哲科.竹林生态系统及其长期定位观测研究的重要性.林业科学,2006,42(8):95-101.LI W C,SHENG H Y,ZHONG Z K.Importance of longterm location investigation for bamboo ecosystem.Scientia Silvae Sinicae,2006,42(8):95-101.(in Chinese with English abstract)
[2] 李伟成,田新立,盛海燕,等.中小径级毛竹对林地轮休覆盖模式的可塑性响应.生态与农村环境学报,2017,33(3):234-241.LI W C,TIAN X L,SHENG H Y,et al.Response of smallmedium-diametered moso bamboo(Phyllostachys edulis)to mulching and fallow alternation in plasticity.Journal of Ecology and Rural Environment,2017,33(3):234-241.(in Chinese with English abstract)
[3] 李伟成,王树东,钟哲科,等.覆膜对酒竹笋营养元素与成分的影响.林业科学研究,2009,22(5):732-735.LI W C,WANG S D,ZHONG Z K,et al.Effect of plastic film mulching on trace element and nutrition of wine bamboo shoot,Oxytenanthera braunii.Forest Research,2009,22(5):732-735.(in Chinese with English abstract)
[4] LUO S S,ZHU L,LIU J L,et al.Sensitivity of soil organic carbon stocks and fractions to soil surface mulching in semiarid farmland.European Journal of Soil Biology,2015,67:35-42.
[5] LI Y F,ZHANG J J,CHANG S X,et al.Long-term intensive management effects on soil organic carbon pools and chemical composition in moso bamboo(Phyllostachys pubescens)forests in subtropical China.Forest Ecology and Management,2013,303(5):121-130.
[6] TOSHIKO M,AININ N I,GEDE S,et al.No tillage and bagasse mulching alter fungal biomass and community structure during decomposition of sugarcane leaf litter in Lampung Province,Sumatra,Indonesia.Soil Biology and Biochemistry,2013,58(8):27-35.
[7] COOK H F,VALDES G S B,LEE H C.Mulch effects on rainfallinterception,soilphysicalcharacteristics and temperature under Zea mays L.Soil and Tillage Research,2006,91(1/2):227-235.
[8] ZRIBI W,ARAGÜÉS R,MEDINA E,et al.Efficiency of inorganic and organic mulching materials for soil evaporation control.Soil and Tillage Research,2015,148:40-45.
[9] 马军伟,孙万春,胡庆发,等.氰胺类肥料对连作土壤微生物种群结构的影响.浙江大学学报(农业与生命科学版),2013,39(3):281-290.MA J W,SUN W C,HU Q F,et al.Effects of cyanamide fertilizer on microbial community structure of continuous cropping soil.Journal of Zhejiang University(Agriculture and Life Sciences),2013,39(3):281-290.(in Chinese with English abstract)
[10]KOTEEN L E,RAZ-YASEEF N,BALDOCCHI D D.Spatial heterogeneity of fine root biomass and soil carbon in a California oak savanna illuminates plant functional strategy across periods of high and low resource supply.Ecohydrology,2015,8(2):294-308.
[11]MASELLAAP,BARTRAMAK,TRUSZKOWSKI J M,et al.PANDAseq:Paired-end assembler for Illumina sequences.BMC Bioinformatics,2012,13:31.
[12]EDGAR R C.Search and clustering orders of magnitude faster than BLAST.Bioinformatics,2010,26(19):2460-2461.
[13]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allowsanalysisofhigh-throughputcommunity sequencing data.Nature Methods,2010,7(5):335-336.
[14]BOKULICH N A,SUBRAMANIAN S,FAITH J J,et al.Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing.Nature Methods,2013,10(1):57-59.
[15]BASSIOUNI A,CIEIAND E J,PSAITIS A J,et al.Sinonasal microbiome sampling:A comparison of techniques.PLoS One,2015,10(4):e0123216.
[16]GE Y,ZHANG J B,ZHANG L M,et al.Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China.Journal of Soils and Sediments,2008,8(1):43-50.
[17]KAMLESH J,MARKA W,ALANJ F,et al.Relative impacts of land-use management intensity and fertilization upon soil microbial community structure in agricultural systems.Soil Biology and Biochemistry,2008,40(11):2843-2853.
[18]MARINARI S,MANCINELLI R,BRUNETTI P,et al.Soil quality,microbial functions and tomato yield under cover crop mulching in the Mediterranean environment.Soil and Tillage Research,2015,145:20-28.
[19]袁红朝,吴昊,葛体达,等.长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响.应用生态学报,2015,26(6):1807-1813.YUAN H Z,WU H,GE T D,et al.Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils.Chinese Journal of Applied Ecology,2015,26(6):1807-1813.(in Chinese with English abstract)
[20]HANSEL C M,FENDORF S,JARDINE P M,et al.Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile.Applied and Environmental Microbiology,2008,74(5):1620-1633.
[21]TURLAPATI S A,MINOCHA R,BHIRAVARASA P S,et al.Chronic N-amended soils exhibit an altered bacterial community structure in Harvard forest,MA,USA.FEMS Microbiology Ecology,2013,83(2):478-493.
[22]何冬华,陈俊辉,徐秋芳,等.集约经营对毛竹林土壤固氮细菌群落结构和丰度的影响.应用生态学报,2015,26(10):2961-2968.HE D H,CHEN J H,XU Q F,et al.Effects of intensive management on abundance and composition of soil N2-fixing bacteria in Phyllostachys heterocycla stands.Chinese Journal of Applied Ecology,2015,26(10):2961-2968.(in Chinese with English abstract)
[23]侯晓杰,汪景宽,李世朋.不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响.生态学报,2007,27(2):655-661.HOU X J,WANG J K,LI S P.Effects of different fertilization and plastic-mulching on functional diversity of soil microbial community.Acta Ecologica Sinica,2007,27(2):655-661.(in Chinese with English abstract)
[24]GRIFFITHS B S,PHILIPPOT L.Insights into the resistance and resilience of the soil microbial community.FEMS Microbiology Reviews,2013,37(2):112-129.
[25]张瑞,张贵龙,陈冬青,等.不同施肥对农田土壤微生物功能多样性的影响.中国农学通报,2013,29(2):133-139.ZHANG R,ZHANG G L,CHEN D Q,et al.The effects of different fertilization on the functional diversity of soil microbial community.Chinese Agricultural Science Bulletin,2013,29(2):133-139.(in Chinese with English abstract)
[26]WESSEN E,NYBERG K,JANSSON J K,et al.Responses of bacterial and archaeal ammonia oxidizers to soil organic and fertilizer amendments under long-term management.Applied Soil Ecology,2010,45(3):193-200.
[27]高云超,朱文珊,陈文新.秸秆覆盖免耕土壤细菌和真菌生物量与活性的研究.生态学杂志,2001,20(2):30-36.GAOYC,ZHU WS,CHEN WX.Bacterial and fungi biomass and activities in straw mulch no-tillage soils.Chinese Journal of Ecology,2001,20(2):30-36.(in Chinese with English abstract)

