植酸酶基因的定点突变及其在巴斯德毕赤酵母表面展示
余道兵,程学松,王群,史艳可,张昕*
(1.浙江农林大学林业与生物技术学院,杭州311300;2.浙江大学生命科学学院,杭州310058)
植酸(环己六醇-1,2,3,4,5,6-六磷酸酯)广泛存在于植物种子中,其中谷物、油菜和豆类籽实中植酸磷占总磷的60%~80%[1],而食物或植物性饲料中的钾、钙、钠、镁等矿物质一般以植酸钾镁、植酸钙镁、植酸钠镁等复合盐形式存在。单胃动物体内因为缺乏分解植酸的酶类[2-5],使得微量元素的营养有效性大大降低[6],因而必须在饲料中添加无机磷以满足动物对磷的需求,但这造成了磷源的浪费,同时形成的高磷粪便也污染了环境[7-8],造成水资源和土壤的严重污染。
植酸酶广泛存在于植物、动物和微生物中,不同来源的植酸酶具有显著不同的分子特征和催化活性。植物中的植酸酶均属于肌醇六磷酸-6-植酸酶,其最适pH范围为5.0~7.5,不适合在单胃动物体内进行催化[9]。反刍动物瘤胃中的植酸酶含量少且活性低,不能有效地降解植酸[10]。产生自微生物的植酸酶(肌醇六磷酸-3-磷酸水解酶)是目前商品化植酸酶最主要的来源。其中来源于丝状真菌黑曲霉(Aspergillus niger)、烟曲霉(Aspergillus fumigatus)的植酸酶PHYA由于具有较好的耐热性(最适温度为55℃左右),并且在很宽的pH范围内(pH 2.0~6.0)仍能表现出较高的催化活性,被认为是目前最具应用前景的饲用植酸酶之一[11]。但是植酸酶在饲料加工过程中所经受的短暂的60~90℃制粒过程,会导致植酸酶变性,因此,利用分子生物学手段构建基因工程菌,进一步提高产酶水平及酶的稳定性成为当前全世界的研究热点之一。HESAMPOUR等[12]报道了定点突变phyA后的T295S、Q296R和V43N的氢键总数比野生型有所增加,并且在80℃处理10 min后,其酶活残留比野生型高出24%;王敏[13]研究发现,二硫键Cys196-Cys446的缺失能增大植酸酶对底物的亲和力及催化效率,还可以提高酶分子的耐热性;YANG等[14]通过对黑曲霉的脂肪酶进行密码子优化后在毕赤酵母中异源表达,产生的酶活和蛋白表达水平分别提高了11.6倍和5.3倍。
展示酶技术是将外源靶蛋白基因与特定的锚定基因融合后导入酵母细胞,利用酵母细胞将该蛋白转运到膜表面,使靶蛋白固定化表达在酵母细胞表面的技术。同分泌型表达的酶相比,展示酶不仅省去了酶的分离纯化过程,有助于降低酶制剂的生产成本,而且可以提高酶的催化活性和热稳定性[15-16]。在上述背景下,本研究对黑曲霉植酸酶的关键位点进行密码子优化,替换为毕赤酵母偏爱密码子,并且定点突变了T295S、Q296R和V43N以引入氢键,还对二硫键Cys196-Cys446进行缺失突变,并将改造的植酸酶展示在巴斯德毕赤酵母(Komagataella phaffii)GS115细胞表面。本研究借助定点突变和酵母表面展示的手段,旨在获得具有良好的催化活性、热稳定性和酸碱耐受性的展示植酸酶,为解决制粒过程中植酸酶变性失活问题提供一定的参考,以使植酸酶广泛应用于动物饲料和食品加工行业。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α为本实验室保存,巴斯德毕赤酵母(Komagataella phaffii)GS115由集美大学肖安风教授馈赠,DMT化学感受态细胞购自北京全式金生物技术有限公司。pMD19T-phyA(携带有植酸酶全长基因)为本实验室构建并保存,酵母表达质粒pPICZαC购自美国Invitrogen公司。
1.1.2 分子生物学与生化试剂
DpnⅠ(美国NEB公司),PmeⅠ(美国Thermo Fisher公司),100 mg/mL Zeocin(美国Invitrogen公司),酵母基因组提取试剂盒(美国Omega公司),EcoRⅠ、XbaⅠ和PrimeSTARTMHS DNA聚合酶(大连Takara公司),无缝克隆试剂盒和细胞免疫荧光试剂(北京全式金生物技术有限公司),胶回收试剂盒及质粒提取试剂盒(上海康润生物科技有限公司)。其他试剂均为进口或国产分析纯。
1.1.3 培养基
低盐LB培养基(low salt Luria-Bertani medium,LLB)、酵母蛋白胨葡萄糖山梨醇培养基(yeast extract peptone dextrose sorbitol medium,YPDS)、缓冲甘油复合培养基(buffered glycerol-complex medium,BMGY)和缓冲甲醇复合培养基(buffered methanol-complex medium,BMMY)均按Invitrogen公司操作手册推荐方法配制。
1.2 方法
1.2.1 引物设计与合成
根据GenBank中公布的锚定基因fs序列(登录号 BK006935.2),设计引物 fs-FP和 fs-RP;以pMD19T-phyA为定点突变的对象,借助于聚合酶链式反应(polymerase chain reaction,PCR)引入突变位点。无缝克隆所需引物和黑曲霉植酸酶基因定点突变引物序列如表1所示。
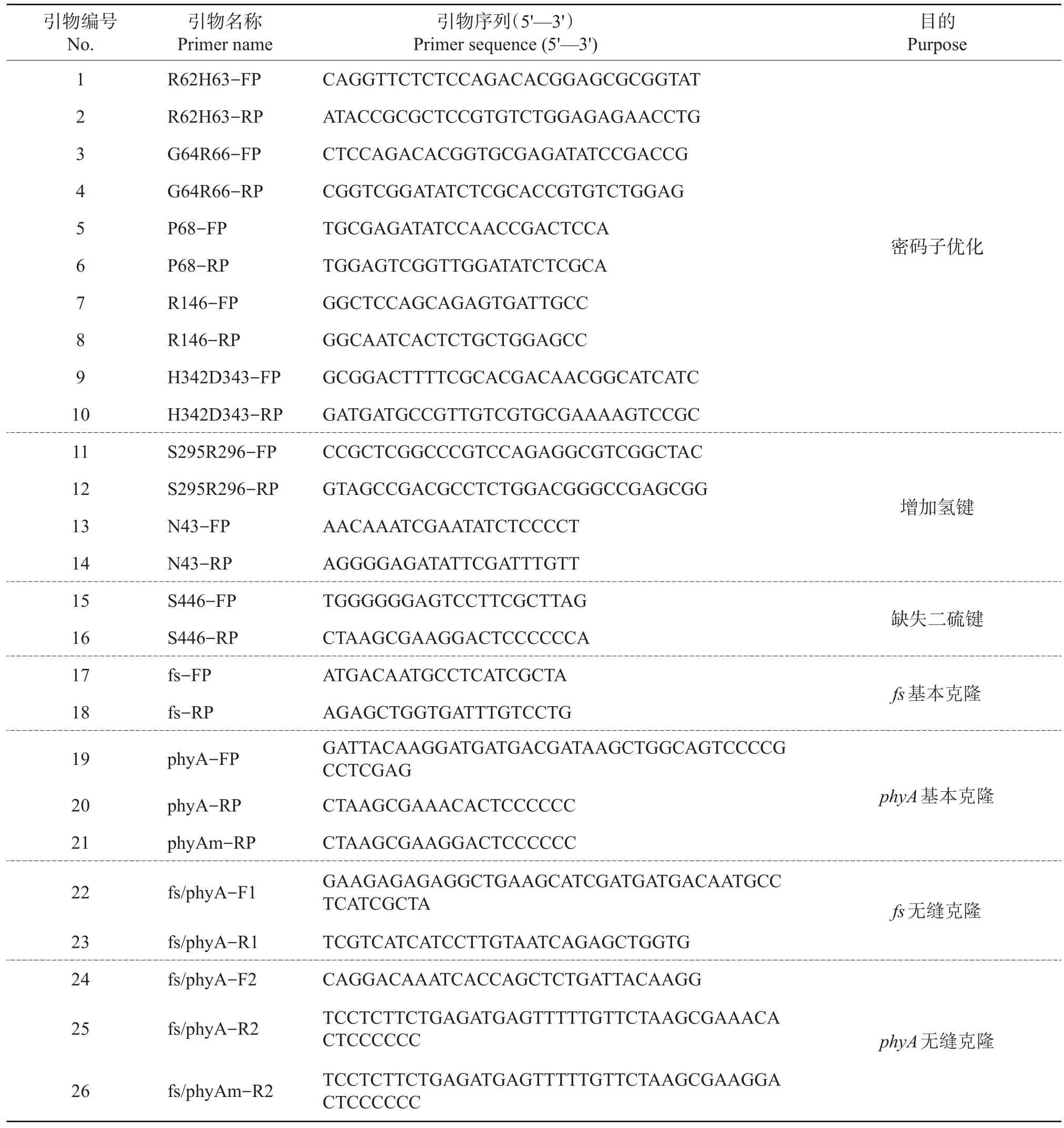
表1 PCR扩增所用引物及其序列Table 1 Primer sequences used for PCR amplification
1.2.2 植酸酶基因的定点突变及其他相关片段的扩增
以pMD19T-phyA为模板,以表1中所列引物1~16(共8对)为引物,进行PCR扩增,获得植酸酶基因的定点突变。反应条件为:98℃预变性5 min;98 ℃变性20 s,(tm-5)℃退火30 s,72 ℃延伸250 s,共17个循环;72℃延伸10 min。将PCR产物用甲基化酶DpnⅠ处理,消化待突变的质粒模板,转化DH5α感受态,以获得新的转化子(其中:菌株A1为野生型;菌株A2包含的突变位点为R62、H63、G64、R66、P68、R146、H342和D343;菌株A3包含的突变位点为R62、H63、G64、R66、P68、R146、H342、D343、S295、R296和N43;菌株A4包含的突变位点为S295、R296和N43;菌株A5包含的突变位点为R62、H63、G64、R66、P68、R146、H342、D343和S446;菌株A6 包含的突变位点为 R62、H63、G64、R66、P68、R146、H342、D343、S295、R296、N43 和 S446;菌株A7包含的突变位点为S446;菌株A8包含的突变位点为S295、R296、N43和S446)。
以酿酒酵母(Saccharomyces cerevisia)4717基因组为模板,以编号17和18序列为引物,经PCR扩增获得fs,再以此PCR产物为模板,以编号22和23序列为引物进行PCR扩增得到fs无缝克隆;以pMD19T-phyA(或含有突变位点的质粒)为模板,以编号19、20和21序列为引物进行PCR扩增得到phyA,再以此PCR产物为模板,以编号24、25和26序列为引物进行PCR扩增得到phyA无缝克隆。反应条件为:98℃预变性5 min;98℃变性20 s,(tm-5)℃退火30 s,72℃延伸4 min,共30个循环;72℃延伸10 min。
1.2.3 表达载体pPICZαC-FS/phyA的构建与鉴定
采用限制性内切酶EcoRⅠ和XbaⅠ对载体pPICZαC进行双酶切和胶回收,然后进行无缝克隆[反应体系为:5 μL 2×装配混合物(assembly mix),2.5 μL 线性化载体pPICZαC,1.4 μL fs无缝克隆,0.5 μL phyA 无缝克隆和0.6 μL ddH2O],转化DMT化学感受态细胞,涂布于含Zeocin(25 μg/mL)的LLB平板上,37℃培养过夜,次日挑取合适的单菌落于37℃液体培养,以编号22、25和26序列为引物进行菌液PCR验证,若为阳性,则提取质粒送杭州擎科梓熙生物技术有限公司测序。
1.2.4 展示植酸酶的转化表达
用限制性内切酶PmeⅠ对表达载体pPICZαCFS/phyA进行线性化处理,采用氯化锂转化K.phaffii GS115感受态细胞。取150 μL转化液涂布于YPDS(含100 μg/mL Zeocin)平板,30 ℃静置培养至菌落出现,提取转化子的基因组作为模板,以目的片段phyA对应的引物进行PCR验证,鉴定无误后将转化子转接于BMGY培养基中30℃培养至D(600 nm)=2.0,离心收集菌体,再转接于BMMY培养基中30℃培养,每隔24 h取样并补充新鲜甲醇至1%进行诱导表达,培养周期为120 h。
1.2.5 植酸酶表面展示的鉴定
诱导结束后,参考KOBORI等[17]的方法进行细胞免疫荧光染色。加入50 μL一抗抗八肽DYKDDDDK的小鼠单克隆抗体(稀释比例为1∶200,用1%BSA稀释),4℃过夜,次日用0.01 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)漂洗后,再加入50 μL荧光二抗山羊抗小鼠的AF488结合的IgG(H+L)(稀释比例为1∶200,用1%BSA稀释),室温下孵育1 h后进行漂洗,再用0.01 mol/L PBS进行重悬,使用Olympus BX51荧光显微镜观察拍照。
对细胞进行免疫荧光染色,然后用0.01 mol/L PBS将菌液稀释至单细胞菌悬液浓度约为106mL-1,采用FACSCalibur型流式细胞仪(美国Becton Dickinson公司),选择488 nm氩离子蓝色激光器进行检测。
1.2.6 展示植酸酶活性的测定
参照文献[18]的方法对所取菌液进行各个展示植酸酶活性的测定,并绘制酶活随时间的变化曲线。
1.2.7 展示植酸酶最适温度及热稳定性的测定
在pH 5.5的CH3COONa/CH3COOH缓冲液体系中,测定各展示酶分别在30、40、50、60、70、80、90℃下的植酸酶活性,以确定酶促反应的最适温度。在测定展示酶的热稳定性时,各展示酶先在70~90℃的条件下预孵育5~120 min,然后再测定酶活。每个反应设置3个重复。以温度为横坐标,展示酶的相对活性为纵坐标,绘制酶活变化曲线。
1.2.8 展示植酸酶最适pH及酸碱耐受性的测定
配置不同pH、浓度为100 mmol/L的缓冲液:pH分别为1.6、2.0、2.5、3.0、3.5、4.0的Gly-HCl缓冲液;pH 分 别 为 4.5、5.0、5.5、6.0 的 CH3COONa/CH3COOH缓冲液;pH分别为7.0、8.0的Tris-HCl缓冲液。用上述缓冲液分别配置5.0 mmol/L的植酸钠溶液,在37℃条件下测定各展示酶活性,以确定酶促反应的最适pH。在测定展示酶的酸碱耐受性时,各展示酶先在pH 1.0~6.0、25℃条件下预孵育6 h,然后再测定酶活。每个反应设置3次重复。以pH为横坐标,展示酶的相对活性为纵坐标,绘制酶活变化曲线。
2 结果与分析
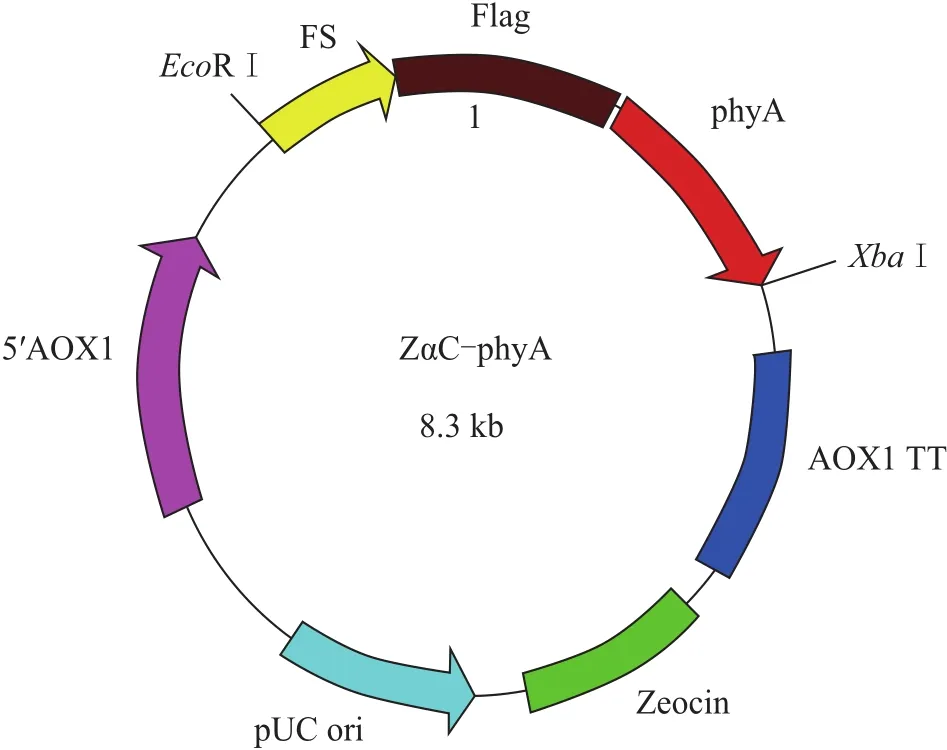
图2 表达载体ZαC-phyA示意图Fig.2 Schematic of expression vector ZαC-phyA
2.1 突变位点的引入
因突变位点较多,以突变位点R62H63为例解释突变位点的引入过程(图1)。图1A为以编号1和2序列为引物所对应的PCR产物(含有突变位点R62H63的质粒),大小约为4.1 kb,与预期大小相符。图1B为阳性转化子菌液提取的质粒条带。
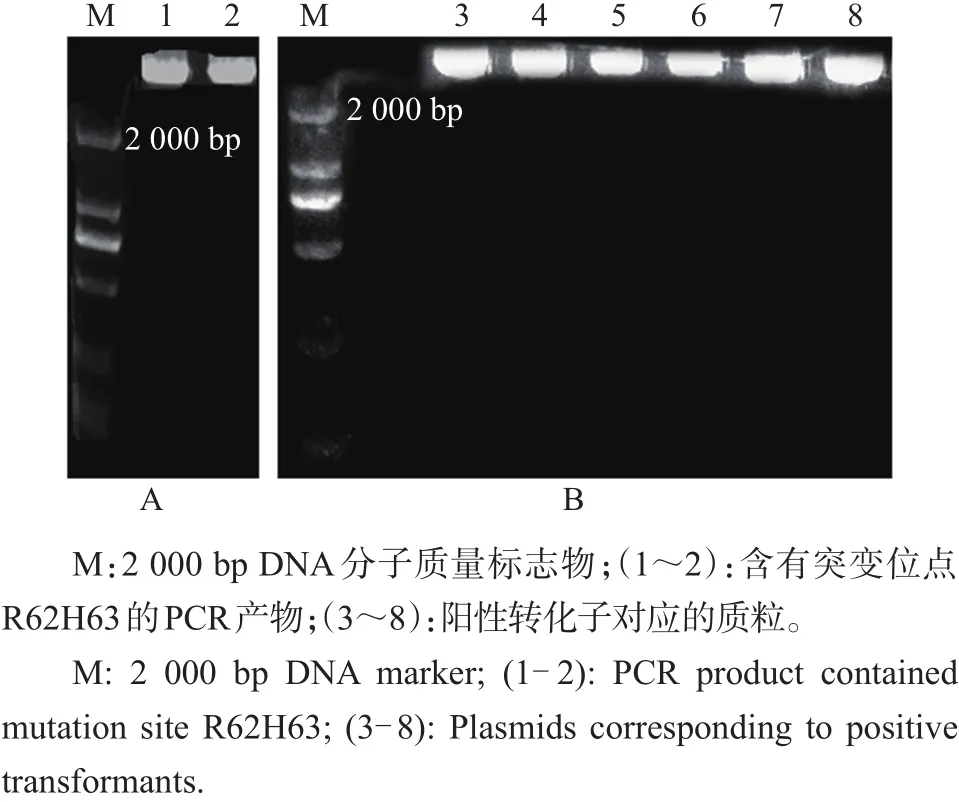
图1 PCR介导的R62H63琼脂糖凝胶电泳Fig.1 PCR-mediated agarose gel electrophoresis for R62H63
将提取的质粒送杭州擎科梓熙生物技术有限公司测序,筛选成功的突变子。以包含所有突变位点的突变株A6为例,其各突变位点的位置(下划线处标注)见附图1(http://www.zjujournals.com/agr/CN/article/showSupportInfo.do?id=10540)。
2.2 表达载体pPICZαC-FS/phyA的构建
2.2.1 表达载体pPICZαC-FS/phyA示意图
表达载体pPICZαC-FS/phyA是在空载体pPICZαC的酶切位点EcoRⅠ和XbaⅠ之间插入锚定片段FS和携带标签Flag的目的片段phyA。通过DNAMAN 8.0软件绘制的结构示意图如图2所示。
2.2.2 fs无缝克隆和phyA无缝克隆的扩增
图3A~B分别为fs无缝克隆和phyA无缝克隆(以A1为例)的扩增条带,片段大小均符合预期要求(fs为3.3 kb,phyA约为1.3 kb)。
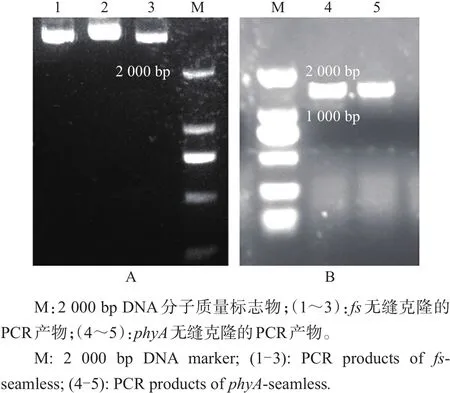
图3 fs无缝克隆(A)和phyA无缝克隆(B)的PCR产物琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis for fs-seamless(A)and phyA-seamless(B)
2.2.3 载体pPICZαC双酶切线性化
载体pPICZαC经限制性内切酶EcoRⅠ和XbaⅠ酶切3 h后的琼脂糖凝胶电泳图见图4。泳道1为线性化后的载体,片段大小约为3.6 kb,与实际相符。
2.2.4 表达载体pPICZαC-FS/phyA的测序鉴定
图4 载体pPICZαC双酶切线性化琼脂糖凝胶电泳Fig.4 Agarose gel electrophoresis for pPICZαC digested and linearized by EcoRⅠ and XbaⅠ
以phyA对应的引物进行菌液PCR验证,提取阳性转化子质粒送杭州擎科梓熙生物技术有限公司进行测序。以pPICZαC-FS/phyA1为例,测序结果见附图2(http://www.zjujournals.com/agr/CN/article/showSupportInfo.do?id=10540):下划线部分为fs的碱基序列,其余部分为phyA1的碱基序列,插入片段总长为4 668 bp。
2.3 K.phaffii GS115的氯化锂转化
2.3.1 表达载体pPICZαC-FS/phyA线性化
以表达载体pPICZαC-FS/phyA1为例,图5中泳道1为经过限制性内切酶PmeⅠ线性化处理的载体,泳道2为未经PmeⅠ线性化处理的载体。由于不经过线性化处理的载体呈现超螺旋结构,故其泳动的速度较线性化处理的载体快,说明本实验中的表达载体pPICZαC-FS/phyA1线性化彻底。
2.3.2 PCR筛选阳性转化子
提取相应的转化子基因组DNA作为模板,以目的片段phyA对应的引物为实验引物进行PCR验证,结果如图6所示。各泳道获得的基因片段大小均符合预期目标。将阳性转化子进行扩增培养,选择重组子 ZαC、A11、A25、A31、A44、A51、A61、A71、A84为后续实验发酵菌株,于20%甘油管保藏。
2.4 免疫荧光检测

图5 载体pPICZαC-FS/phyA1线性化琼脂糖凝胶电泳Fig.5 Agarose gel electrophoresis for pPICZαC-FS/phyA1 linearization
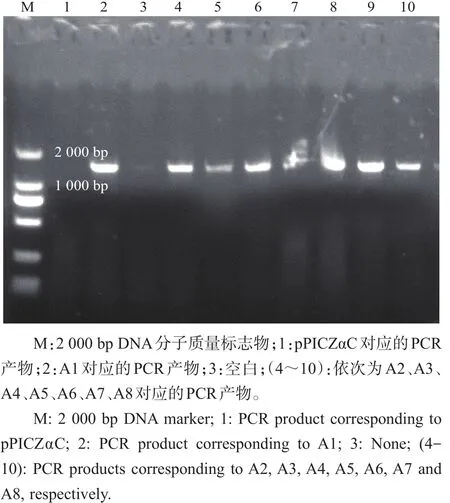
图6 PCR筛选阳性转化子电泳检测结果Fig.6 Detection result of screening positive transformants via PCR
免疫荧光检测结果(图7)表明,经过96 h的诱导,除对照ZαC以外,重组酵母菌株A11、A25、A31、A44、A51、A61、A71、A84均可以检测到荧光。根据该结果,可以推论出目的基因phyA已经在K.phaffii GS115细胞表面成功展示,达到表面展示的目的。
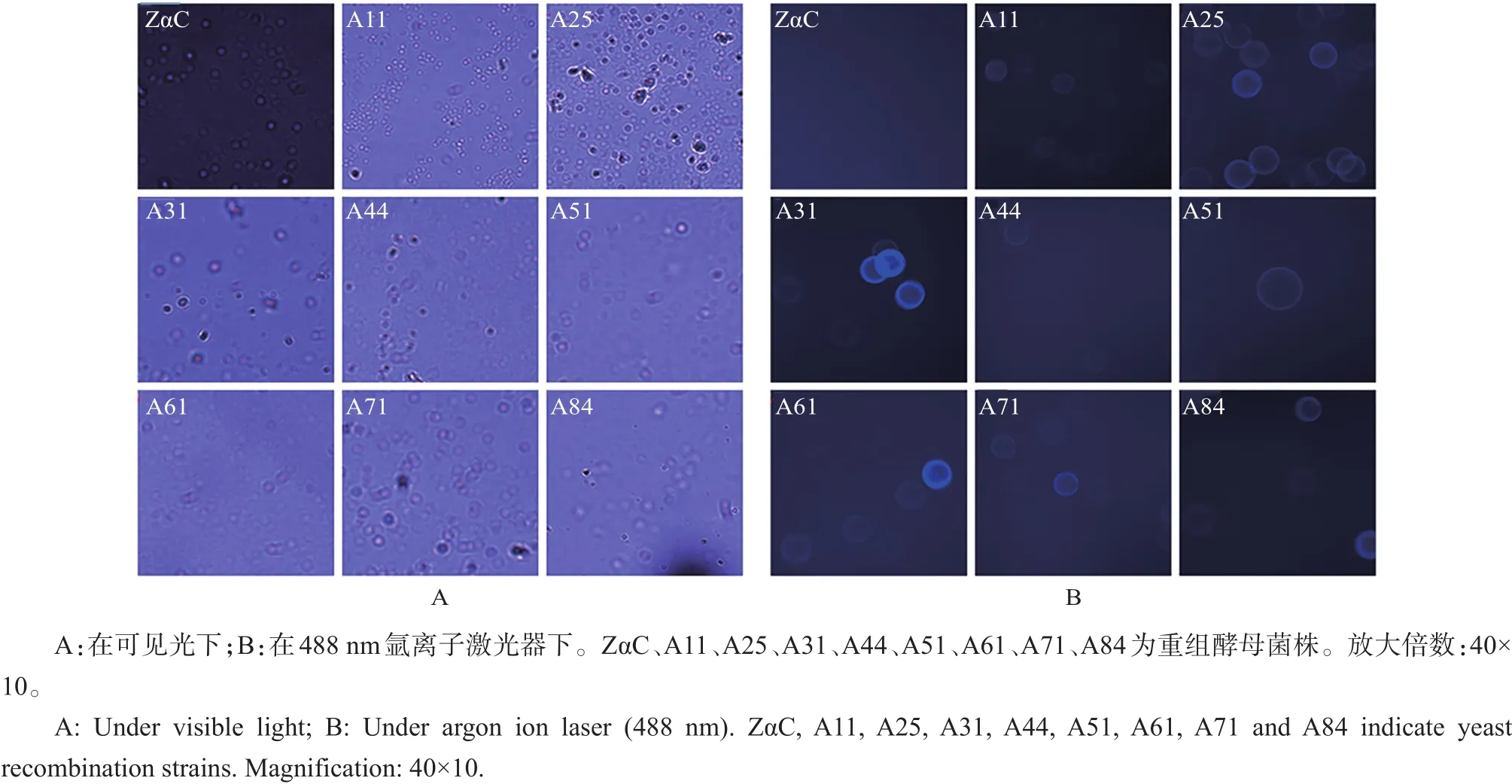
图7 荧光显微镜观察结果Fig.7 Observation result by fluorescence microscope
2.5 流式细胞仪检测
每一轮获取1×105个事件,通过BD CellQuest Pro软件(美国Becton Dickinson公司)对数据进行处理,生成检测结果(图8),图中不同颜色的曲线分别对应不同的重组菌株。当FL1-H为102时,对照ZαC(A3-1.011)所对应的曲线(绿色)比其他曲线低,A51对应的曲线(黄色)是所有转化子中最高的,这一结果与荧光显微镜观察结果一致,再次证实植酸酶在K.phaffii GS115细胞表面成功展示。
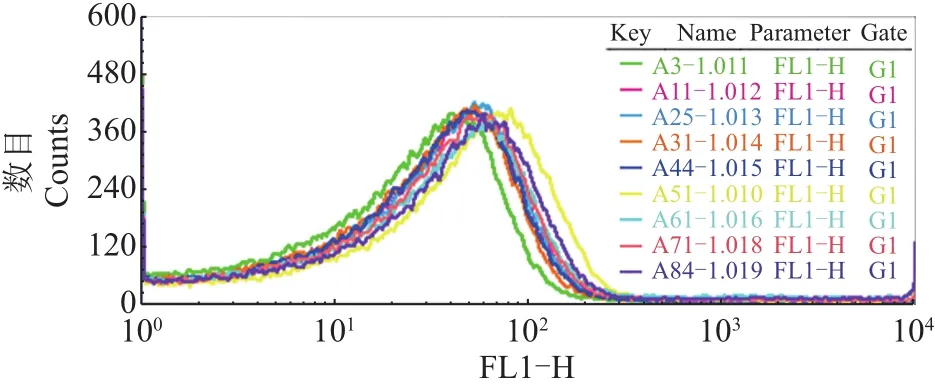
图8 流式细胞仪检测结果Fig.8 Flow cytometry result of yeast cells
2.6 展示植酸酶活性的诱导曲线
各重组菌株在BMMY培养基中振荡培养,每隔24 h添加1%的甲醇连续诱导120 h,并及时取样测定其酶活。由图9可以看出,各重组菌株的酶活随着诱导时间的延伸而增强,96 h后达到峰值,随后呈下滑趋势,该结果与LI等[18]较为一致。96 h后重组菌株A31、A61、A84的酶活相较于其他重组菌株较为突出,均超过7 000 U/g,其中A61的酶活最大(7 924 U/g),其次为A84(7 649 U/g),再次为A31(7 360 U/g)。故选取重组菌株A31、A61、A84作为后续研究对象。
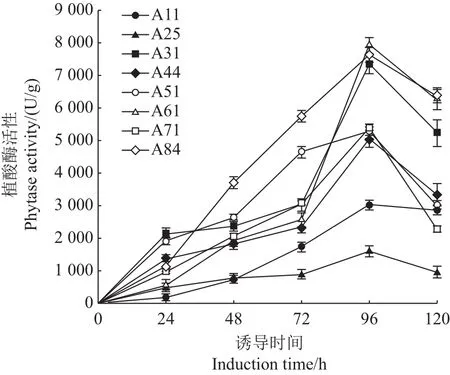
图9 展示植酸酶活性的诱导曲线Fig.9 Curve of phytase activity after induction
2.7 温度对展示植酸酶活性的影响
由图10A可知,不同温度对3株重组菌株酶活的影响不同。菌株A31和A84在50℃时的酶活达到峰值,而菌株A61的酶活极大值出现在60℃,当超过最适温度时,所有菌株的酶活均呈下降趋势,并于90℃时聚于一点。研究发现,在37℃时3株重组菌株的酶活均占最高酶活的40%左右。由于温血动物的体温大多在37℃,因此,在该温度下的酶活性具有重要意义。
植酸酶的热稳定性一直是制约其推广应用的关键因素,本研究将重组菌株A31、A61、A84分别于70、80、90 ℃水浴处理15、60、90、120 min后测定其残余酶活。结果(图10B~D)发现,菌株的植酸酶活性与高温呈现负相关趋势。各重组菌株在70℃时,其酶活随时间的丧失幅度均较80和90℃小。相比而言,菌株A61在90℃水浴处理90 min以内,其酶活的下降幅度比其余菌株更为缓慢,水浴处理1 h后,酶活残留18%,这一特性能够符合制粒过程中(60~90℃)不影响植酸酶活的技术要求。
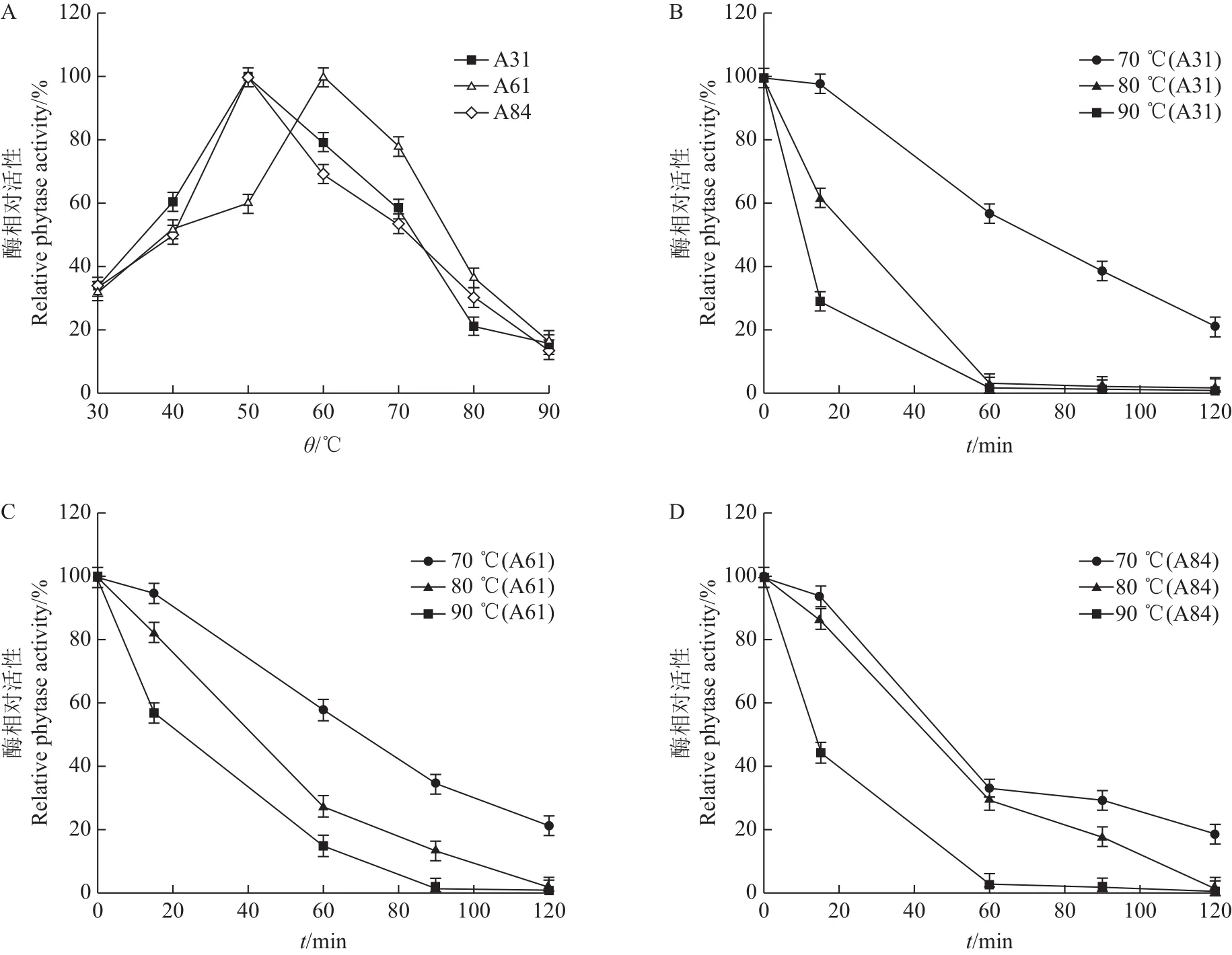
图10 温度对展示植酸酶活性的影响Fig.10 Effect of temperature on the activity of yeast cell-surface phytase
2.8 pH对展示植酸酶活性的影响
pH是影响植酸酶活性的另一个重要因子。在本研究中,重组菌株A31、A61和A84酶活最高时的pH值分别为3.0、2.5和4.0(图11A),高峰之后,随着pH值的不断升高,各菌株酶活均呈现下降趋势,并于pH 8.0时趋近于一点。
胃肠道pH是影响动物体消化系统发挥正常生理功能的重要因素之一,在动物消化、吸收营养物质过程中起着关键作用[19]。本研究将各重组菌株分别在pH为1.6~6.0的缓冲液中预孵育6 h,然后再测定其残余酶活。结果(图11B)表明,在pH 1.6~6.0的范围内,重组菌株A31、A61、A84的残余酶活均保持在40%以上。菌株A31的残余酶活在pH 2.0~4.5的范围内保持在80%以上;菌株A61的残余酶活在pH 1.6~4.0的范围内均保持在80%以上;而菌株A84的残余酶活则在pH 3.5~5.5的范围内均在80%以上。因为动物消化道在正常情况下为偏酸性(pH小于7.0)环境,故本研究的展示植酸酶能够在动物胃液中发挥有效的催化活性,可以满足动物饲料用酶的要求。
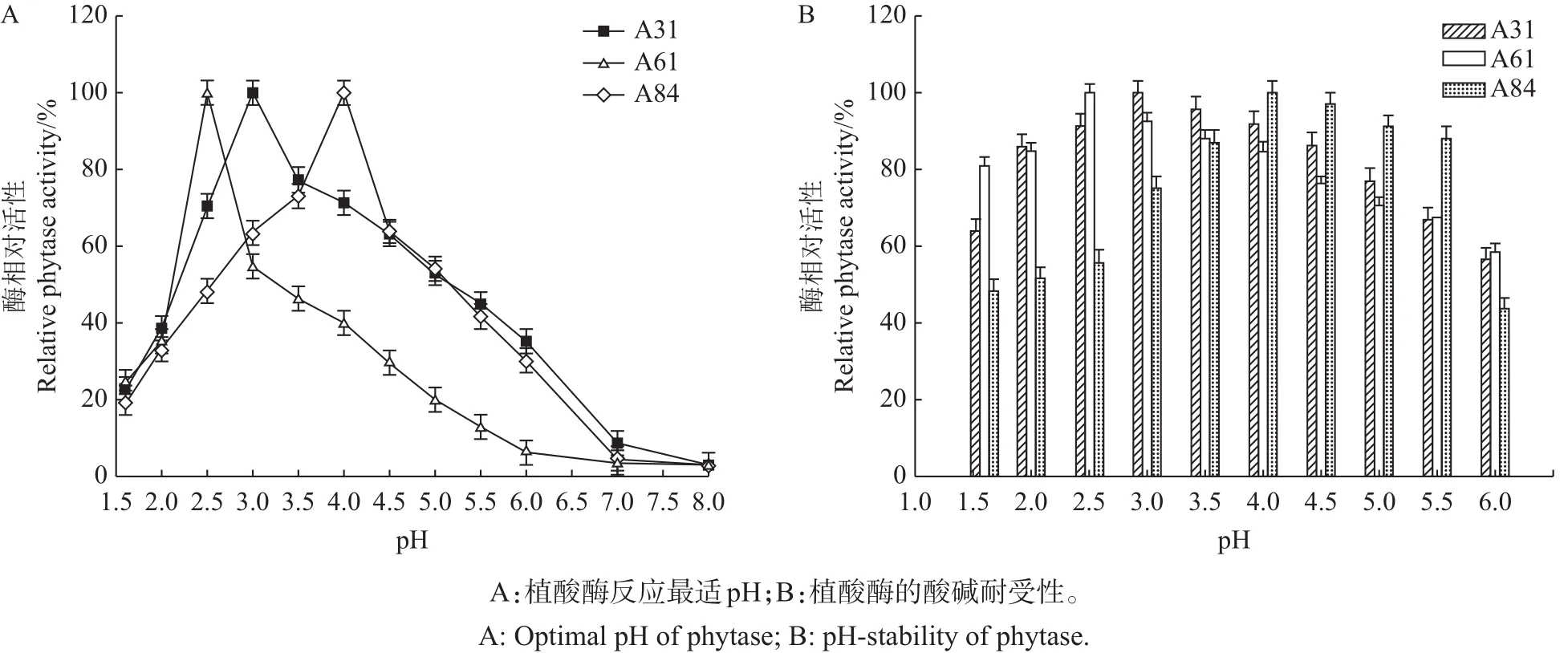
图11 pH对展示植酸酶活性的影响Fig.11 Effect of pH on the activity of yeast cell-surface phytase
3 讨论
植酸酶能分解植物体内的植酸,大大提高饲料中微量矿物质元素的营养利用率。然而,当前商品化植酸酶经短暂的60~90℃制粒加工过程会导致植酸酶变性失活。为解决该问题,一些学者从突变phyA基因位点、缺失Cys196-Cys446二硫键等技术入手进行了一系列基因改良并构建了相关的工程菌株。然而考虑到分泌型蛋白提取及纯化的繁琐工艺和高昂成本,本研究试图将改造的植酸酶基因直接展示在毕赤酵母(Komagataella phaffii)GS115细胞表面,以使植酸酶能更便捷地被加以利用。
毕赤酵母具有细胞生长快、易于培养、遗传操作简单、可高密度发酵等特点,在工业上具有很好的应用前景。然而,植酸酶基因phyA编码467个氨基酸,并且N端还有19个氨基酸信号肽[20],外源蛋白自身携带的介导蛋白分泌的信号肽有可能不被毕赤酵母所识别[21],因此本研究在构建表达载体时除去了植酸酶中的信号肽。此外,为改良植酸酶基因,本研究采取了关键位点突变和密码子优化、引入氢键、二硫键缺失等一系列措施,并首次实现将絮凝素Flo1p(FS)与黑曲霉植酸酶的N端进行锚定,最终成功将改良的植酸酶在毕赤酵母细胞表面展示。
对获得的重组菌株的植酸酶活性进行测定发现,重组菌株A31、A61、A84的酶活均超过7 000 U/g,且以菌株A61的酶活最大(7 924 U/g)。CHEN等[22]曾报道利用酵母的α-凝集素蛋白的C半末端作为锚定蛋白,将植酸酶展示在酿酒酵母表面,获得的最大酶活为6.4 U/g;LI等[18]在毕赤酵母表面展示的来源于无丙二酸柠檬酸杆菌(Citrobacter amalonaticus)的植酸酶最大酶活为6 413.5 U/g。相比之下,本研究中A31、A61、A84的酶活是CHEN等[22]结果的1 000倍,比LI等[18]的结果提高了1 000 U/g左右。由此可见,新构建的植酸酶展示酵母菌株有更优越的酶活特性。
温度对植酸酶活性有一定的影响,不同菌株对温度的响应也不尽相同。黄静等[23]研究发现,在酿酒酵母表面展示的来源于黑曲霉的野生型植酸酶的最适反应温度为55℃;彭远义等[24]研究发现,分泌型黑曲霉N14植酸酶在毕赤酵母中异源表达后的最适反应温度为55℃;而杨平平等[25]利用60Co γ射线诱变黑曲霉,筛选到1株植酸酶高产菌株,其最适酶活温度却为40℃。在本研究中,菌株A31和A84在50℃时的酶活达到峰值,而菌株A61的酶活最大值则出现在60℃。综上表明,对野生型植酸酶加以改造,而后进行分泌表达或者表面展示,植酸酶最适温度为50~60℃。
植酸酶的热稳定性是制约其推广应用的关键因素。黄静等[23]在酿酒酵母表面展示的野生型植酸酶在70℃处理1 h后,酶活为5%,在80℃处理1 h后几乎完全失活;LI等[18]在毕赤酵母表面获得的展示植酸酶在70℃处理1 h后,其酶活为62%,在80℃处理1 h后几乎完全失活。本研究中除了重组菌株A31在80℃处理1 h后几乎完全失活外,菌株A61和A84在80℃处理1 h后,其酶活分别还可以保留28%和30%,其中菌株A61在90℃水浴处理1 h后仍有18%的酶活。结合突变类型推测,菌株A61和A84中二硫键Cys196-Cys446的缺失可能提高了植酸酶的耐热能力。
pH通过影响植酸酶的活性进而影响植酸酶发挥营养效力。黄静等[23]在酿酒酵母表面展示的植酸酶的最适pH为5.0;杨平平等[24]利用60Co γ射线诱变筛选的植酸酶最适pH为5.6;冯慧玲等[26]引入易错PCR技术获得的植酸酶最适pH为4.6。相比之下,本研究获得的各重组菌株的反应最适pH均比上述报道中的结果偏低,这可能是因为植酸酶引入氢键和缺失二硫键后会造成酶促反应的最适pH发生改变。值得一提的是,3个重组菌株在动物正常的胃液pH范围内均能保持较高的酶活(80%以上),其中菌株A61在pH 1.6~6.0的范围内,其残余酶活保持在40%以上,故能够满足动物饲料用酶的需求。
密码子优化作为提高酶的异源表达水平的有效手段,毕赤酵母和黑曲霉在密码子的选择上明显不同。将获得的重组菌株A25关键位点的密码子替换为毕赤酵母所偏好的,发现其催化活性较野生型菌株A11有所降低,与YANG等[14]的结果存在差别,这可能与未对植酸酶基因的开放阅读框(open reading frame,ORF)进行全面优化有关。
借助于展示酶技术,展示植酸酶A11的酶活接近3 000 U/g,明显高出野生型黑曲霉A3214所产植酸酶活性(720 U/g)[27]。通过引入氢键,重组菌株A44的酶活相比野生型A11提高了2 000 U/g,该发现同HESAMPOUR等[12]的研究结果一致。类似的,二硫键Cys196-Cys446的缺失增强了重组菌株A71的活性,与王敏[13]的研究结果相符。
重组菌株A61在催化活性、酸碱耐受性和热稳定性方面均表现最佳,同时引入氢键和缺失二硫键,能够很好地提高展示植酸酶的催化性能,增强其对酸碱和高温的耐受性。
综上所述,对植酸酶进行基因改造并展示于毕赤酵母细胞表面,新获得的植酸酶展示型菌株具有较高的酶活性以及热和酸碱耐受性,能够满足制粒过程(60~90℃)的温度要求及动物肠道内环境的pH催化活性要求,具有广阔的开发应用前景。
4 结论
本文对来源于黑曲霉的植酸酶进行密码子优化、氢键引入以及二硫键Cys196-Cys446的缺失突变,改变其热稳定性和催化活性。将改造的植酸酶展示于毕赤酵母的细胞表面,相比于分泌型植酸酶省去了酶的分离、纯化等步骤,降低了生产成本。获得的展示酶菌株A61不仅可以规避制粒过程中酶活的大量损失,而且还可以在动物胃肠道中发挥较好的催化作用。
[1]RAVINDRAN V,KORNEGAY E T,DENBOW D M,et al.Response of turkey poults to tierd levels of natuphos phytase added to soybean meal-based semi-purified diets containing three levels of non-phytate phosphorus.Poultry Science,1995,74(11):1843-1854.
[2] 曾继蛟.植酸酶产酶菌株的体外诱变及中性植酸酶基因在WB800中的高效表达.四川,雅安:四川农业大学,2008:1-51.ZENG J J.The mutation of acid phytase and overexpression of phytase phyL and 168phyA gene in WB800.Ya’an,Sichuan:Sichuan Agricultural University,2008:1-51.(in Chinese with English abstract)
[3] 赵冬敏.植酸酶基因phyA的克隆及在毕赤酵母中的高效表达.山东,泰安:山东农业大学,2007:1-65.ZHAO D M.Cloning and overexpression of phytase phyA gene in Pichia pastoris.Tai’an,Shandong:Shandong Agricultural University,2007:1-65.(in Chinese with English abstract)
[4] 张桂敏,张晚鸣,何国帮,等.烟曲霉中耐高温植酸酶基因的克隆及其在毕赤酵母中的高效表达.中国生物工程学会第三次全国会员代表大会暨学术讨论会论文摘要集,2001.ZHANG G M,ZHANG W M,HE G B,et al.Cloning of phytase gene with high temperature resistance fromAspergillus fumigatus and its high-efficiency expression in Pichia pastoris.Abstract Books of the Third National Member Representatives Meeting of Chinese Society of Biological Engineering and Academic Seminar,2001.(in Chinese)
[5] 李晰亮,李晓薇,赵竟男,等.植酸酶研究进展.黑龙江农业科学,2015(8):149-152.LI X L,LI X W,ZHAO J N,et al.Research progress on phytase.Heilongjiang Agricultural Sciences,2015(8):149-153.(in Chinese)
[6] 王修启.植酸酶在养猪生产中的应用.全国饲料营养学术研讨会,1998.WANG X Q.Application of phytase in pig production.National Conference on Feed Nutrition,1998.(in Chinese)
[7] 楼洪兴,许尧兴.植酸酶在饲料中的应用.中国饲料,1994(8):16-18.LOU H X,XU Y X.Application of phytase in feed.China Feed,1994(8):16-18.(in Chinese)
[8] 吴灵英.植酸酶的应用.中国饲料,1994(1):16-18.WU L Y.The application of phytase.China Feed,1994(1):16-18.(in Chinese)
[9] 张剑英.酸性植酸酶基因的克隆及其在大肠杆菌和毕赤酵母中的表达.长沙:湖南农业大学,2004:1-50.ZHANG J Y.Molecular cloning and expression of acid phosphotase gene in E.coli and Pichia pastoris.Changsha:Hunan Agricultural University,2004:1-50.(in Chinese with English abstract)
[10]张梦晗.转植酸酶基因玉米的稳定性及对植酸磷降解效果的研究.长春:吉林大学,2012:1-43.ZHANG M H.The study of stability of phytase maize and the degradation effect of phytic acid phosphorus.Changchun:Jilin University,2012:1-43.(in Chinese with English abstract)
[11]黄敏,易秀莉,马根,等.植酸酶基因工程的研究进展.中国饲料,2008(5):3-7.HUANG M,YI X L,MA G,et al.Research advances of phytase gene engineering.China Feed,2008(5):3-7.(in Chinese)
[12]HESAMPOUR A,SIADAT S E R,MALBOOBI M A,et al.Enhancement of thermostability and kinetic efficiency of Aspergillus niger PhyA phytase by site-directed mutagenesis.Applied Biochemistry and Biotechnology,2015,175(5):2528-2541.
[13]王敏.植酸酶PHYA的高效表达及二硫键的功能分析.山东,泰安:山东农业大学,2008:1-82.WANG M.Overexpression of PHYA and functional analysis of disulfide bond.Tai’an,Shandong:Shandong Agricultural University,2008:1-82.(in Chinese with English abstract)
[14]YANG J K,LIU LY.Codon optimization through a two-step gene synthesis leads to a high-level expression of Aspergillus niger lip2 gene in Pichia pastoris.Journal of Molecular Catalysis B:Enzymatic,2010,63(3/4):164-169.
[15]SUG D,ZHANG X,LIN Y.Surface display of active lipase in Pichia pastoris using Sed1 as an anchor protein.Biotechnology Letters,2010,32(8):1131-1136.
[16]CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylotrophic yeast Pichia pastoris.FEMS Microbiology Reviews,2000,24(1):45-66.
[17]KOBORI H,SATO M,OSUMI M.Relationship of actin or ganization to growth in the two forms of the dimorphic yeast Candida tropicalis.Protoplasma,1992,167(3):193-204.
[18]LI C,LIN Y,HUANG Y Y,et al.Citrobacter amalonaticus phytase on the cell surface of Pichia pastoris exhibits high pH stability as a promising potential feed supplement.PLoS One,2014,9(12):e114728.
[19]刘金阳,王在贵,张宏福,等.益生菌与饲粮组合效应对苏淮猪生长性能、胃肠道pH和肉品质的影响.畜牧兽医学报,2014,45(10):1648-1655.LIU J Y,WANG Z G,ZHANG H F,et al.Effects of diets supplemented with probiotic on growth performance,gastrointestinal pH and meat quality of Suhuai pigs.Chinese Journal of Animal and Veterinary Science,2014,45(10):1648-1655.(in Chinese with English abstract)
[20]VANHARTINGSVELDTW,VAN ZEIJLCM J,HARTEVELD G M,et al.Cloning,characterization and overexpression of the phytase-encoding gene(phyA)of Aspergillus niger.Gene,1993,127(1):87-94.
[21]姚清侠,黄勤锋,曹毅,等.猪γ-干扰素在毕赤酵母中的分泌表达及其抗病毒作用.中国兽医学报,2008,28(4):451-455.YAO Q X,HUANG Q F,CAO Y,et al.Secreting expression of procine interferon-gamma in Pichia pastoris and its antiviral activity.Chinese Journal of Veterinary Science,2008,28(4):451-455.(in Chinese with English abstract)
[22]CHEN X Z,XIAOY,SHEN W,et al.Display of phytase on the cell surface of Saccharomyces cerevisiae to degrade phytate phosphorus and improve bioethanol production.Applied Microbiology and Biotechnology,2016,100(5):2449-2458.
[23]黄静,姚淑敏,徐朝阳,等.植酸酶在酿酒酵母细胞表面上的展示及其活性测定.聊城大学学报(自然科学版),2010,23(2):47-50.HUANG J,YAO S M,XU Z Y,et al.Yeast surface display of phytase and activity assay of the displayed protein.Journal of Liaocheng University(Natural Science Edition),2010,23(2):47-50.(in Chinese with English abstract)
[24]彭远义,刘生峰,李春明,等.黑曲霉N14植酸酶基因在巴斯德毕赤酵母中的高效表达.生物工程学报,2004,20(6):967-971.PENG Y Y,LIU S F,LI C M,et al.Over-expression of Aspergillus niger N14 phytase gene in Pichia pastoris.Chinese Journal of Biotechnology,2004,20(6):967-971.(in Chinese with English abstract)
[25]杨平平,王燕,陶文沂.60Co γ射线诱变黑曲霉菌株产植酸酶的研究.核农学报,2004,18(3):193-196.YANG P P,WANG Y,TAO W Y.Screening of mutant strains production phytase from Aspergillus niger by60Co γray irradiation.Acta Agriculturae Nucleatae Sinica,2004,18(3):193-196.(in Chinese with English abstract)
[26]冯慧玲,李春梅,吴振芳,等.易错PCR技术提高黑曲霉N25植酸酶活力的研究.生物技术通报,2010(10):226-230.FENG H L,LI C M,WU Z F,et al.Increasing activity of phytase from Aspergillus niger N25 by error-prone PCR.Biotechnology Bulletin,2010(10):226-230.(in Chinese with English abstract)
[27]李春明,彭远义.2株黑曲霉植酸酶的分离纯化及其酶学特性的研究.西南农业大学学报(自然科学版),2006,28(4):643-647.LI C M,PENG Y Y.Purification and characterization of phytase fromAspergills niger A3214 andA.niger N14.Journal of Southwest Agricultural University(Natural Science),2006,28(4):643-647.(in Chinese with English abstract)

