王浆主蛋白作为胎牛血清替代物培养中国仓鼠卵巢细胞CHO-K1的效果及作用机制
钱浩诚,蒋晨旻,陈华才,沈立荣*
(1.浙江大学生物系统工程与食品科学学院,馥莉食品科学研究院,浙江省农产品加工技术研究重点实验室,杭州310058;2.中国计量大学光学与电子科技学院,杭州310018)
蜂王浆是由工蜂头部舌腺和颚腺分泌[1],专供给蜂王和3 d内工蜂幼虫食用的浆状物质[2]。仅仅因为摄入的食物不同,出生时基因组相同的蜂王和工蜂的命运完全不同,蜂王的体型、寿命远超工蜂,工蜂的系统也随之退化[3]。由于蜂王浆对蜜蜂级型分化的神奇作用,人们对它的研究日益深入,期望蜂王浆的功效能够在人体再现。蜂王浆的成分包括水(50%~60%)、蛋白质(18%)、糖类(15%)、脂类(3%~6%)、矿物盐(1.5%)和维生素,蛋白质约占蜂王浆干物质的50%[4],其中水溶性部分——王浆主蛋白(major royal jelly proteins,MRJPs)与蜂王浆的生物活性密切相关,是决定蜜蜂雌性幼虫发育成为蜂王或工蜂的关键活性物质[3]。
以往的报道和我们的研究表明,MRJPs对多种动物和人体细胞有促增殖作用,具有部分替代胎牛血清(fetal bovine serum,FBS)培养细胞的潜力[5-8]。KAMAKURA等[5]用分子质量为57 kDa的MRJP1蛋白培养小鼠肝细胞,发现该蛋白具有延长细胞寿命的作用,其促细胞分裂能力与蛋白浓度呈正相关;SALAZAR-OLIVO等[6]发现,王浆粗蛋白能促进昆虫细胞Tn-5B1-4增殖,且其促增殖效果强于FBS;WATANABE 等[7]发 现 ,添 加 1.0 mg/mL 的MRJP1无血清培养基能显著促进人骨髓细胞U-937生长;本课题组的研究证实,MRJPs能够部分代替FBS培养293T、HFL-Ⅰ、HCT116及张氏肝细胞等人体细胞[8],且MRJPs对张氏肝细胞增殖作用可能与促进DNA、RNA和蛋白质的合成相关[9]。我国蜂王浆产量及出口量占全球的90%[10],用MRJPs部分替代FBS培养细胞,对降低细胞培养成本,促进蜂王浆深加工具有重要意义。
中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)是在抗体生产、生物制药及病毒疫苗领域广泛使用的生物反应器之一[11]。CHO细胞是一种永生细胞系,由美国科罗拉多大学学者PUCK从一成年雌性中国仓鼠卵巢中分离建株,后来陆续有研究人员筛选出多种不同表型的CHO细胞株,如DUKX-B11、DG-44和CHO-K1等[11]。CHO细胞作为生物反应器具有多项优势,例如:培养及基因修饰难度低;重组基因扩增及表达效率高;内源蛋白分泌较少,利于外源蛋白产物的纯化与分离;细胞具有准确的转录后修饰功能,所表达的糖基化蛋白在分子结构、理化特性和生物学功能等方面接近于天然蛋白分子;细胞既可贴壁生长,也可悬浮培养,其耐受剪切力和渗透压能力良好[12-13]。目前,7成以上动物细胞表达药物产品通过CHO细胞生产[14]。然而,与大肠杆菌和酵母表达系统相比,CHO细胞还存在生长较慢、培养周期较长、产量较低等缺陷,其细胞培养所需的FBS价格昂贵。因此,研究开发符合工业化生产要求、应用成本低、高密度的CHO细胞培养新技术很有必要[15]。为此,我们在已有研究基础上,进一步开展了用MRJPs部分替代FBS培养CHO-K1细胞的系统性研究,旨在降低细胞培养成本,为蜂王浆深加工提供新的途径。
1 材料与方法
1.1 材料
1.1.1 蜂王浆
鲜蜂王浆由杭州碧于天保健品公司提供,于-80℃下保存。
1.1.2 细胞株
CHO-K1细胞,购自中国科学院上海细胞库,培养条件为含10%FBS的F12K培养基,培养环境为37 ℃、5%CO2。
1.1.3 试剂
胎牛血清,购自Hyclone公司;F12K细胞培养基、0.25%胰蛋白酶,购自吉诺生物医药技术有限公司;细胞增殖指数(proliferation index,PI)染液(无RNA酶),购自Sigma公司;四唑盐(methyl thiazolyl tetrazolium,MTT)细胞增殖毒性检测试剂盒,购自南京凯基生物科技发展有限公司;牛血清白蛋白(bovine serum albumin,BSA),购自生工生物工程(上海)股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)和常规化学试剂(均为分析纯),购自国药集团化学试剂有限公司。
1.1.4 仪器与设备
IL-161/169型气套式CO2培养箱[施都凯仪器设备(上海)有限公司];SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司);DSZ5000X型倒置显微镜(重庆澳浦光电技术有限公司);Multiskan MK3型酶标仪[赛默飞世尔(上海)仪器有限公司];紫外可见分光光度计(北京普析通用仪器有限责任公司);BS124S型分析电子天平[赛多利斯科学仪器(北京)有限公司];FACSCalibur型流式细胞仪(美国BD公司);LabRAM HR Evolution拉曼光谱仪(日本HORIBA公司);Countstar IC1000细胞成像仪(上海睿钰生物技术有限公司)。
1.2 方法
1.2.1 MRJPs的制备及浓度测定
取50 g鲜蜂王浆溶于350 mL、pH 7.4的磷酸盐缓冲液(phosphate buffer solution,PBS)中,4℃下搅拌24 h,1.2万r/min离心30 min,取上清液于透析袋(截留相对分子质量3 500~14 000)中,于4℃下在双蒸水(double distilled H2O,ddH2O)中透析24 h后得到MRJPs溶液,保存于-20℃备用[6]。使用Bradford法绘制标准曲线并测定MRJPs浓度[16],用F12K培养基将MRJPs溶液稀释至5 mg/mL母液备用。
1.2.2 不同MRJPs/FBS(M/F)比例培养基对CHOK1细胞形态学的影响
取对数生长期CHO-K1细胞,以2×103mL-1的密度接种到96孔板中,用5 mg/mL的MRJPs(M)母液或5 mg/mL的BSA(B)母液代替部分FBS(F),其代替的体积比例分别为:M/F 0/100(CK)、M/F 25/75、M/F 50/50、M/F 75/25、B/F 50/50。连续培养2 d后用倒置显微镜对CHO-K1细胞进行拍照,根据细胞形状、大小、密度和折光率等指标对细胞状态进行统计分析。
1.2.3 不同M/F比例培养基对CHO-K1细胞增殖速率的影响
取对数生长期的CHO-K1细胞,以2×103mL-1的密度接种到96孔板中,各组培养基中混合血清比例同1.2.2节,分别在培养24、48、72 h时用MTT法于490 nm检测各孔吸光度。
1.2.4 不同M/F比例培养基对CHO-K1细胞状态的影响
取对数生长期CHO-K1细胞,以2×104mL-1的密度接种于6孔板中,各组培养基中混合血清比例同1.2.2节,连续培养至细胞融合度约90%时,消化并收集细胞,用PBS溶液将细胞稀释至合适浓度,将细胞悬液置于专用容器中,用细胞成像仪进行检测。
1.2.5 MRJPs部分代替FBS对CHO-K1细胞周期的影响
将处于对数生长期CHO-K1细胞接种至25 mL细胞培养瓶中,分别采用CK、M/F 50/50和B/F 50/50培养基培养。待细胞融合率达到90%时,用胰酶消化并收集CHO-K1细胞于离心管中,控制每管细胞数量约1×106个。用PBS溶液轻柔地清洗细胞2次,离心去除上清液后,加入100 μL PBS溶液并吹打均匀,制成细胞重悬液。用1 mL注射器将细胞重悬液慢慢注入1 mL、经-20℃预冷的75%乙醇中,在4℃下放置过夜,固定细胞。然后于1 200 r/min下离心8 min得细胞沉淀,用500 μL PI染液重悬细胞,并将细胞悬液转移至流式管中,轻轻吹打均匀后避光放置15 min,用流式细胞仪进行细胞周期检测。细胞增殖指数(PI)计算公式如下:PI=(S期细胞+G2期细胞)/(G1期细胞+S期细胞+G2期细胞)。
1.2.6 拉曼光谱法探究MRJPs部分代替FBS对CHO-K1细胞的影响
取CK、M/F 50/50和B/F 50/50培养基中对数生长期CHO-K1细胞,以2×103mL-1的密度接种到96孔板中连续培养,待细胞融合率达到90%左右时吸出培养液,加入PBS溶液轻柔吹打清洗数次后吸除溶液,然后于拉曼光谱仪下进行扫描。拉曼扫描条件如下:激光功率50 mW,激光波长785 nm,物镜倍数10×,光栅600条/mm,照射时间3 s。
1.2.7 数据分析
所有样品至少3次重复,所得数据用SPSS 14.0和Excel 2016软件进行处理。各组间差异采用单因素方差分析(one-way analysis of variance,one-way ANOVA)。结果用平均值±标准差表示,P<0.05表示数据间具有统计学上的显著差异。
2 结果与分析
2.1 不同M/F比例培养基对CHO-K1细胞形态学的影响
细胞形态受各种内外因素影响,表现为细胞大小、形状、核仁、边界变化等。用不同M/F比例的培养基培养CHO-K1细胞2 d后在倒置显微镜下观察,结果(图1)显示:CK培养基(图1A)、M/F 25/75培养基(图1B)、M/F 50/50培养基(图1C)、B/F 50/50培养基(图1E)中的细胞形态相似,呈短梭状或不规则铺路卵石状,细胞边界清晰,属于典型的正常CHO-K1细胞形态;而M/F 75/25培养基(图1D)中的细胞形态则发生了明显的变化,具体表现为细胞体积明显增大,细胞边界模糊不清,细胞密度下降。用M/F 50/50培养基培养的细胞密度明显大于其他培养基组。以上结果说明,适宜的M/F比例能在不影响CHO-K1细胞正常生长状态的情况下提高细胞密度,显示出促细胞增殖作用。
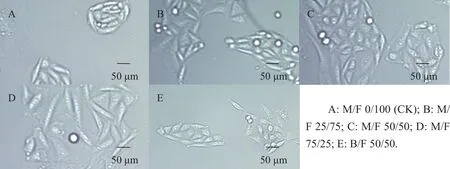
图1 不同M/F比例对CHO-K1细胞形态的影响Fig.1 Effect of different M/F ratios on CHO-K1 morphology
2.2 不同M/F比例培养基对CHO-K1细胞增殖的影响
由于MTT吸光度与活细胞数目在一定范围内呈正相关,因此可根据吸光度大小得出相对活细胞数。图2为CHO-K1细胞在不同M/F比例培养基中培养24、48、72 h时的相对活细胞数。从接种48 h开始,相比于CK培养基,在M/F 25/75及M/F 50/50培养基中的相对活细胞数分别增加了23.8%和25.1%,两者的活细胞数显著高于CK;在接种72 h时,两者的相对活细胞数比CK分别增加了9.9%和13.6%。同时发现,M/F 75/25培养基中的相对活细胞数均显著低于CK,说明MRJPs替代FBS的比例不可过高。而B/F 50/50培养基的相对活细胞数显著低于CK及M/F 50/50培养基,显示MRJPs对该细胞的促增殖能力优于BSA。以上结果表明,M/F 25/75和M/F 50/50这2种比例的培养基能够显著促进CHO-K1细胞增殖,其促增殖能力优于CK培养基及添加BSA的培养基。考虑到添加MRJPs量高更有利于降低成本,因此采用MRJPs代替50%的FBS作为后续研究的实验对象。
2.3 不同M/F比例培养基对CHO-K1细胞状态的影响
将经消化后悬浮于PBS溶液中的CHO-K1细胞置于细胞成像仪中的状态作进一步分析。结果(表1)显示:与CK组相比,M/F 50/50培养基的细胞密度上升了23.7%,上升幅度与48 h时MTT测定结果相符;M/F 50/50培养基中的细胞直径显著高于CK组,其余各处理间细胞不存在显著差异;此外,各处理组间细胞圆度在统计学上无显著性差异(P>0.05)。
2.4 MRJPs部分代替FBS对CHO-K1细胞周期的影响
基于上述结果,我们采用流式细胞仪测定了M/F 0/100(CK)、M/F 50/50和B/F 50/50培养基对CHOK1细胞周期的影响,以分析MRJPs对该细胞的作用机制。结果(图3)显示,M/F 50/50培养基中的细胞增殖指数分别高于CK及B/F 50/50培养基19.4%和29.5%。S期和G2期正是细胞大量合成DNA及蛋白质的时期,与CK培养基相比,用MRJPs替代50%的FBS培养细胞使得处于S期与G2期的细胞总数比例上升,推测MRJPs可促进细胞中DNA、蛋白质及酶的合成,从而促进细胞增殖。
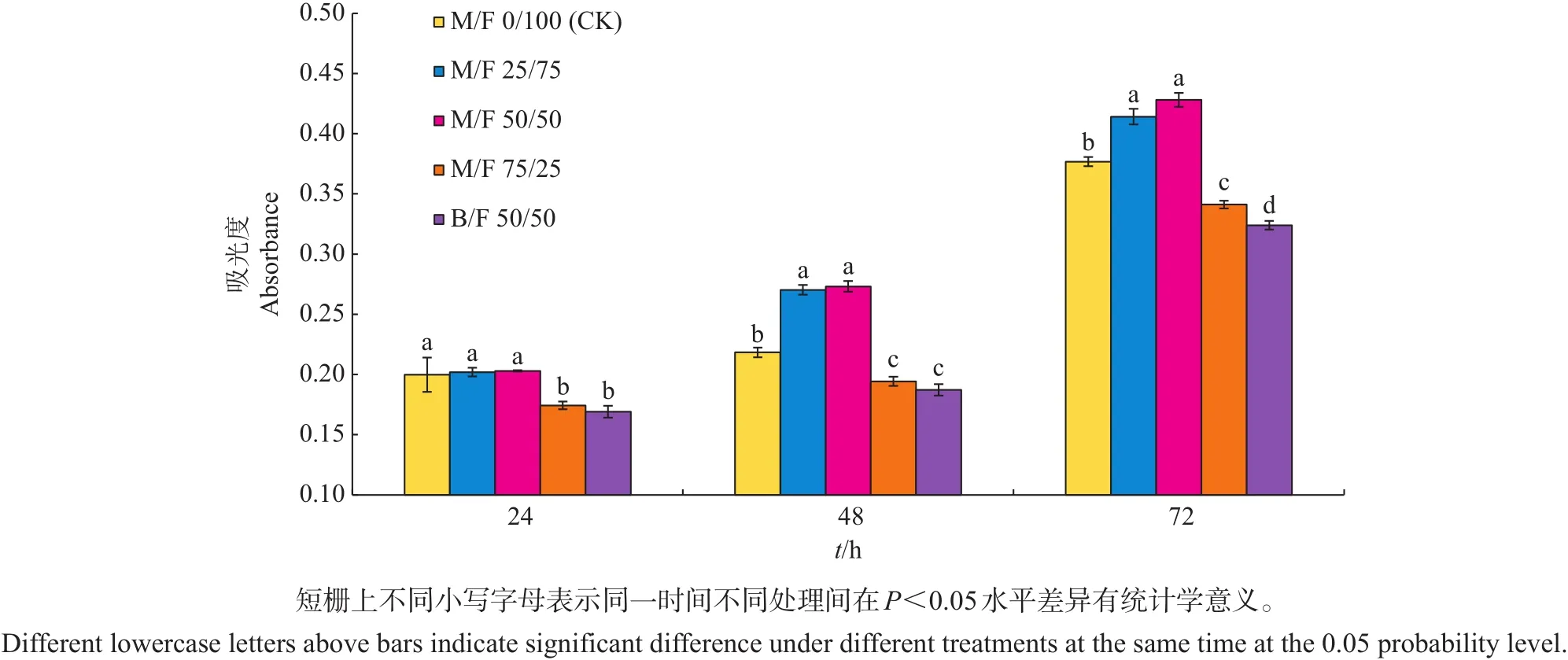
图2 不同M/F比例对CHO-K1细胞增殖的影响Fig.2 Effect of different M/F ratios on proliferation of CHO-K1 cells
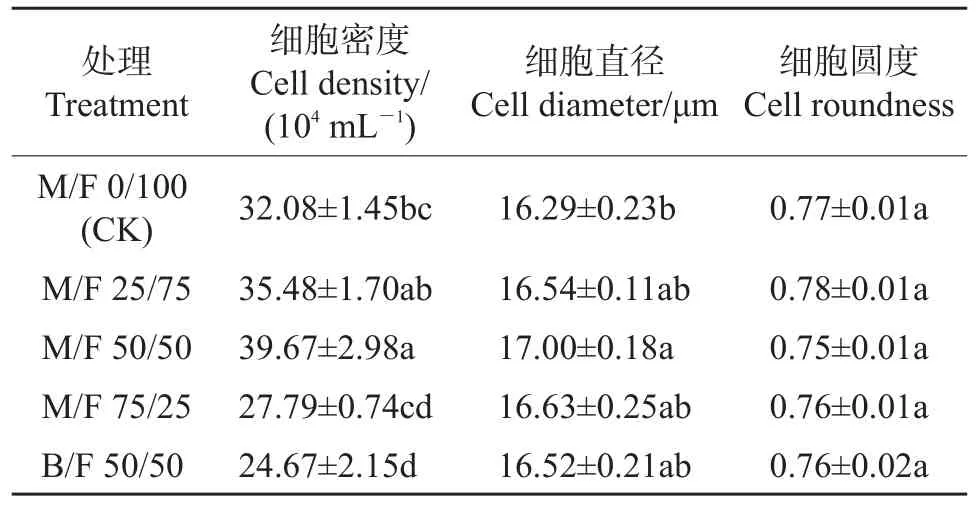
表1 不同M/F比例培养基对细胞状态的影响Table 1 Effect of different M/F ratios on CHO-K1 cell state
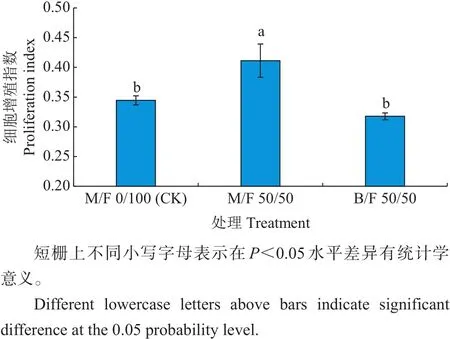
图3 MRJPs部分代替FBS对细胞周期的影响Fig.3 Effect of MRJPs as an alternative to FBS on CHO-K1 cell cycle
2.5 拉曼光谱法测定部分代替FBS对CHO-K1细胞的影响
拉曼光谱法是一种检测细胞及组织的快速无损方法[17-18],该方法通过不同频率的激光散射分析目标物的分子振动,以解析体系产物的结构与含量[18]。表2为分别测定CK、M/F 50/50和B/F 50/50培养基中CHO-K1细胞的拉曼光谱结果[19]。平均光谱图以1 002 cm-1处的苯基丙氨酸对应峰为基准作归一化处理。结果显示,大部分峰归属于蛋白质及氨基酸基团的振动、拉伸或变形等[19-20]。由图4可见,各组细胞拉曼光谱图中的峰强度几乎相同,峰位置也没有发生明显位移。以上结果说明,用MRJPs部分代替FBS在促进CHO-K1细胞增殖的同时,没有大幅度改变细胞内物质的结构及含量,也没有诱导细胞产生突变,保证了细胞的稳定状态,利于MRJPs在工业化生产上的应用。
3 讨论
在细胞或组织培养过程中,除无血清培养基外,通常需要加入能促进细胞贴壁、体外生长和增殖的动物源性血清,其中FBS是最常用的添加物。由于FBS含有丰富的细胞生长因子及促增殖因子,已成为细胞完全培养基的标准补充配方[21]。但FBS的生产使用涉及动物福利、技术及质量控制等诸多问题,不同批次的FBS会存在质量差异,在生产过程中还可能受到支原体和朊病毒污染[21-24],因此生产成本越来越高。由于我国FBS长期依赖进口,开发生产适合培养CHO细胞的无血清培养基深受关注。但目前无血清培养基还难以达到有血清的完全培养基的效果。为了提高无血清培养基的培养效果,在实际应用中往往需要添加生长因子、激素、促贴壁物质、酶抑制剂、结合蛋白及微量元素等多种补充物[25-26]。此外,目前无血清培养基往往价格昂贵,配方保密,使用者无法通过调整培养基组成及组分浓度来控制培养过程,优化培养条件。由于这些问题的存在,寻找能替代FBS培养CHO细胞的新的补充物很有必要。

表2 拉曼光谱峰归属[19]Table 2 Raman spectrum contributions[19]
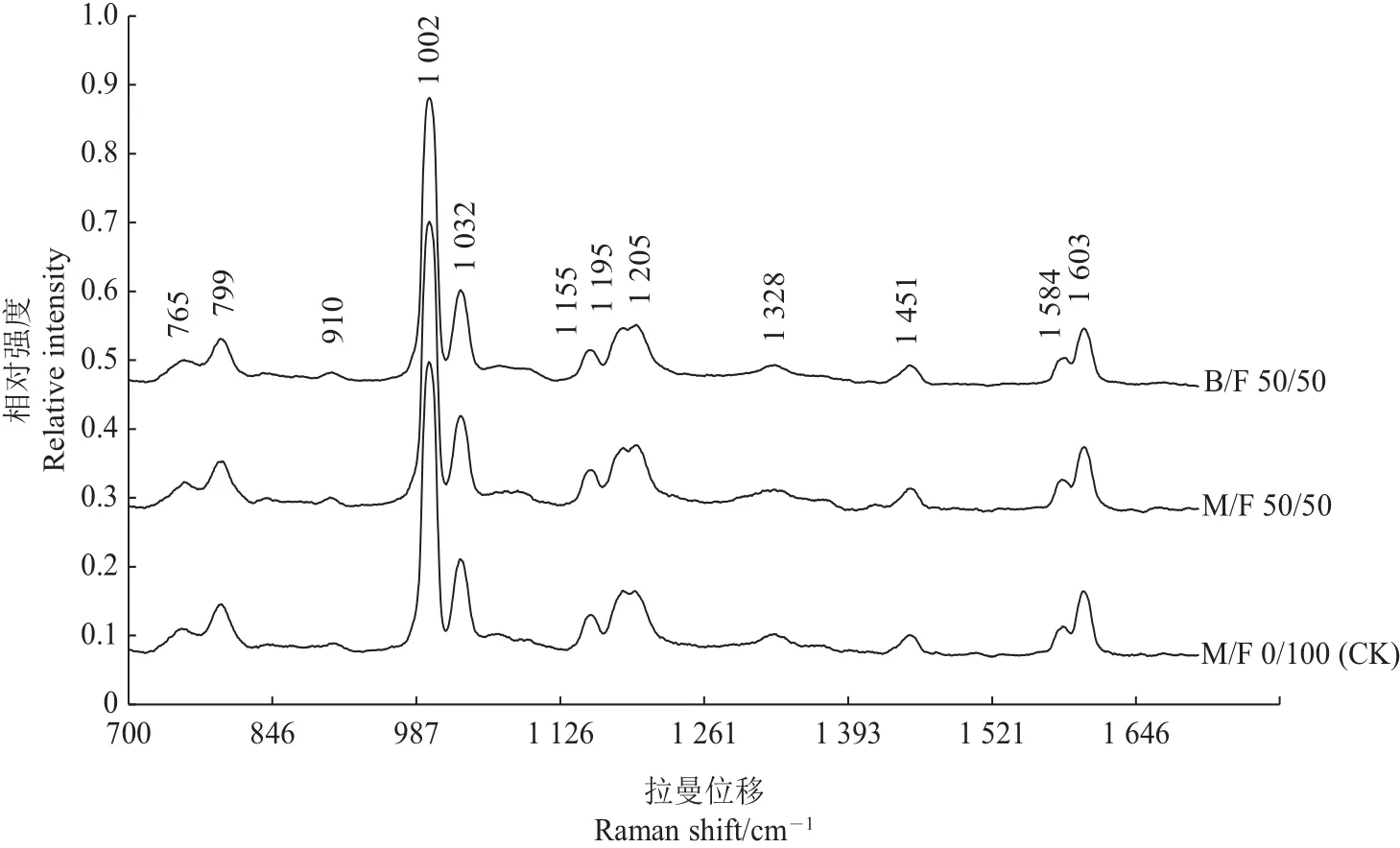
图4 CHO-K1细胞拉曼光谱图Fig.4 Raman spectra of CHO-K1 cells
我们之前的研究和相关报道已证明,MRJPs对大鼠肝细胞、昆虫Tn-5B-4细胞、鱼EPC细胞、Hepli4细胞[27-29]、张氏肝细胞[9]、293T细胞、HCT116及HFL-Ⅰ等多种细胞[8]具有促增殖作用。KAMAKURA等[5,27]研究发现,MRJPs能够促进肝细胞DNA及白细胞蛋白的合成,促进细胞有丝分裂。本研究结果表明,虽然各组细胞圆度之间没有显著性差异,但M/F 50/50培养基中的细胞直径显著大于CK,这可能与MRJPs促进细胞中蛋白质的分泌有关。根据相关文献报道,细胞形态在一定程度上反映了细胞生长情况[30],通常情况下,折光率越高、形状越圆、体积越大的悬浮状态细胞会越有活力。李俊俊等[31]发现,直径>13 μm的大鼠牙胚细胞增殖活性高于直径<13 μm的细胞;据WANG等[32]报道,伴随着大鼠前脂肪细胞直径的增大,G2与S期细胞比例相应增多,脂质含量相应增加。已有研究证明,培养基中的血清浓度可极大地影响细胞的增殖能力[33]及细胞倍增时间[34],降低血清浓度会导致细胞贴壁及生长困难[35]。在培养基中用其他物质代替FBS会导致FBS浓度降低,而MRJPs因具有促进细胞增殖的能力,恰好能够弥补低浓度FBS所造成的影响,具有成为FBS理想替代品的潜力。
拉曼光谱法由于对样品要求较低、损伤小、检测速度快等优势,在分子生物学与医学等领域受到极大关注,常被用于细胞鉴定、药物分析、细胞筛选、肿瘤及病变细胞鉴别等[36-37]。肿瘤细胞的形态、组织结构与正常细胞均有不同程度的差异,这种差异被称为细胞异型性。肿瘤细胞的异型性主要表现在细胞核变异、体积增大、DNA含量增多,且随着癌基因及抑癌基因突变的发生,细胞中—C=C—、—CH2与双链上不饱和基团或电负性基团的数量会随之增多[38]。此外,细胞癌变经常伴随着染色体缺失、错位和细胞增殖失控,进而导致细胞内蛋白质、糖类等关键物质发生改变,而拉曼光谱能够从分子层面检测到这些细微变化。杨文沛等[39]对肝癌细胞与正常肝细胞的拉曼光谱比较发现,肝癌细胞的谱线强度整体偏弱,其核酸、蛋白质与脂类等重要分子在结构和含量上都发生了不同程度的改变。韦芳等[40]曾尝试利用拉曼光谱区分胰岛α细胞和β细胞,他们根据不同种类的胰岛细胞所含激素各不相同这一理论基础,发现拉曼光谱既有共同的特征峰,也有差异明显的波峰,因而成功利用拉曼光谱法区分了这2种细胞。
以往大量研究报道已证明,拉曼光谱法能够从分子层面上发现细胞内物质含量及结构的变化,不失为一种探索CHO细胞在MRJPs影响下是否发生结构性变化的新检测方法。我们通过用拉曼光谱法研究M/F复合培养基对CHO-K1的影响,结果发现不同处理组谱图间峰强度及峰位移几乎没有发生变化,证明MRJPs在促进细胞增殖的同时,还维持了细胞内主要物质的含量及结构的稳定性,为今后将该方法应用于正常细胞评价提供了科学依据。
此外,特别需要指出的是,MRJPs的促增殖作用具有一定的选择性。我们发现,HFL-Ⅰ细胞在MRJPs完全代替FBS的培养基(M/F 100/0)中不能正常贴壁,因此取消了M/F 100/0这一实验组。我们之前的研究也已经证实,用MRJPs完全代替FBS无法保证张氏肝细胞的正常存活[9],MRJPs对231细胞不具有促增殖作用[8];而MUSA等[41]发现,采用MRJPs完全代替FBS培养MRC-5细胞后,细胞的倍增时间远远高于正常培养基组细胞,说明FBS中的一些特殊生长因子是MRJPs所不具备的。因此,在今后研究中需要进一步明确MRJPs具有促增殖作用的组分,为MRJPs作为FBS代替物的研究提供更加充分的依据。
4 结论
在培养基中用MRJPs部分代替FBS具有促进CHO-K1细胞增殖的作用,其最适M/F比例为50/50,用该比例培养基培养的细胞直径显著大于FBS。MRJPs与FBS配合使用能够增大细胞增殖指数,由此推测,MRJPs对该细胞的促增殖作用可能与其促进细胞DNA、蛋白质及酶合成有关。拉曼光谱分析显示,MRJPs既未大幅度改变细胞内物质的结构及含量,也未诱导细胞产生突变,证明MRJPs具有部分代替FBS应用的产业化前景。由于我国为蜂王浆生产和出口大国,本研究为蜂王浆深加工提供了一个新的途径。
致谢 浙江大学农生环测试中心李金辉老师协助用流式细胞仪检测细胞周期,谨致谢意!
[1]BUTTSTEDT A,MORITZ R F A,ERLER S.Origin and function of the major royal jelly proteins of the honeybee(Apis mellifera)as members of the yellow gene family.Biological Reviews,2014,89(2):255-269.
[2] SHEN L R,ZHANG W,JIN F,et al.Expression of recombinant AccMRJP1 protein from royal jelly of Chinese honeybee in Pichia pastoris and its proliferation activity in an insect cell line.Journal of Agricultural and Food Chemistry,2010,58(16):9190-9197.
[3] KAMAKURA M.Royalactin induces queen differentiation in honeybees.Nature,2011,473:478-483.
[4] NAGAI T,INOUE R.Preparation and the functional properties of water extract and alkaline extract of royal jelly.Food Chemistry,2004,84(2):181-186.
[5]KAMAKURA M,SUENOBU N,FUKUSHIMA M.Fiftyseven-kDa protein in royal jelly enhances proliferation of primary cultured rat hepatocytes and increases albumin production in the absence of serum.Biochemical and Biophysical Research Communications,2001,282(4):865-874.
[6]SALAZAR-OLIVO L A,PAZ-GONZÁLEZ V.Screening of biological activities present in honeybee(Apis mellifera)royal jelly.Toxicology in Vitro,2005,19(5):645-651.
[7]WATANABE K,SHINMOTO H,KOBORI M,et al.Stimulation of cell growth in the U-937 human myeloid cell line by honey royal jelly protein.Cytotechnology,1998,26(1):23-27.
[8] CHEN D,XIN X X,QIAN H C,et al.Evaluation of the major royal jelly proteins as an alternative to fetal bovine serum in culturing human cell lines.Journal of Zhejiang University:SCIENCE B,2016,17(6):476-483.
[9] 于张颖,谌迪,王一然,等.王浆主蛋白(MRJPs)对张氏肝细胞的促增殖作用及其机制.浙江大学学报(农业与生命科学版),2015,41(1):7-14.YU Z Y,CHEN D,WANG Y R,et al.Effect of major royal jelly proteins(MRJPs)on proliferation activity of Chang’s liver cell line and their mechanism of action.Journal of Zhejiang University(Agriculture and Life Sciences),2015,41(1):7-14.(in Chinese with English abstract)
[10]沈立荣,张瓅文,丁美会,等.蜂王浆的营养保健功能及分子机制研究进展.中国农业科技导报,2009,11(4):41-47.SHEN L R,ZHANG LW,DING M H,et al.Research progress on nutritional and health-care functions and molecular mechanism of royal jelly.Journal of Agricultural Science and Technology,2009,11(4):41-47.(in Chinese with English abstract)
[11]LEE J H,KIMYG,LEE G M.Effect of Bcl-xLoverexpression on sialylation of Fc-fusion protein in recombinant Chinese hamster ovary cell cultures.Biotechnology Progress,2015,31(4):1133-1136.
[12]BALLEZ J S,MOLS J,BURTEAU C,et al.Plant protein hydrolysates support CHO-320 cells proliferation and recombinant IFN-γ production in suspension and inside microcarriers in protein-free media.Cytotechnology,2004,44(3):103-114.
[13]BETANSKA K,CZOGALLA S,SPINDLER-BARTH M,et al.Influence of cell cycle on ecdysteroid receptor in CHOK1 cells.Archives of Insect Biochemistry and Physiology,2009,72(3):142-153.
[14]JAYAPAL K P,WLASCHIN K F,HU W S,et al.Recombinant protein therapeutics from CHO cells:20 years and counting.Chemical Engineering Progress,2007,103(10):40-47.
[15]郑惠惠,江洪.CHO细胞表达系统研究进展.生物技术进展,2016,6(4):239-243.ZHENG H H,JIANG H.Progress of CHO expression system.Current Biotechnology,2016,6(4):239-243.(in Chinese with English abstract)
[16]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,1976,72(1/2):248-254.
[17]BUSCHMAN H P,MARPLE E T,WACH M L,et al.In vivo determination of the molecular composition of artery wallby intravascularRaman spectroscopy.Analytical Chemistry,2000,72(16):3771-3775.
[18]SWAIN R J,JELL G,STEVENS M M.Non-invasive analysis of cell cycle dynamics in single living cells with Raman microspectroscopy.Journal of Cellular Biochemistry,2008,104(4):1427-1438.
[19]MOVASAGHI Z,REHMAN S,REHMAN I U.Raman spectroscopy of biological tissues.Applied Spectroscopy Reviews,2007,42(5):493-541.
[20]HAMADA K,FUJITA K,SMITH N I,et al.Raman microscopy for dynamic molecular imaging of living cells.Journal of Biomedical Optics,2008,13(4):044027.
[21]GSTRAUNTHALER G.Alternatives to the use of fetal bovine serum:Serum-free cell culture.Altex,2003,20(4):275-281.
[22]ELIOT M.Risks of virus transmission associated with animalsera or substitutes and methods of control.Developments in Biological Standardization,1999,99:9-16.
[23]SHAH G.Why do we still use serum in the production of biopharmaceuticals? Developments in Biological Standardization,1999,99:17-22.
[24]WESSMAN S J,LEVINGS R L.Benefits and risks due to animal serum used in cell culture production.Developments in Biological Standardization,1999,99:3-8.
[25]董慧君,曽宪卓,鲁菲.无血清培养CHO细胞的研究进展.科技视界,2015(32):71-72.DONG H J,ZENG X Z,LU F.Research progress of serumfree medium for CHO cells.Science&Technology Vision,2015(32):71-72.(in Chinese with English abstract)
[26]宗超,黄磊,蔡谨,等.无血清培养基中蛋白类补充因子重组生产研究进展.药物生物技术,2014,21(2):162-165.ZONG C,HUANG L,CAI J,et al.Research progress of bioproduction of recombinant protein supplements for serumfree medium formulation.Pharmaceutical Biotechnology,2014,21(2):162-165.(in Chinese with English abstract)
[27]KAMAKURA M.Signal transduction mechanism leading to enhanced proliferation ofprimary cultured adultrat hepatocytes treated with royal jelly 57-kDa protein.The Journal of Biochemistry,2002,132(6):911-919.
[28]KAMAKURAM,SAKAKI T.Ahypopharyngeal gland protein of the worker honeybeeApis mellifera L.enhances proliferation of primary-cultured rat hepatocytes and suppresses apoptosis in the absence of serum.Protein Expression and Purification,2006,45(2):307-314.
[29]MATAŠIN Ž,GAJGER I T,BEDRICA L.Cultivation of the EPC fish cell line in serum free media supplemented with honeybee royal jelly.Tierärztliche Umschau,2008,63(8):446-448.
[30]HWANG E S,YOON G,KANG H T.A comparative analysis of the cell biology of senescence and aging.Cellular and Molecular Life Sciences,2009,66(15):2503-2524.
[31]李俊俊,闫明,吴锦涛,等.不同直径牙胚细胞增殖和骨向分化能力的评估.牙体牙髓牙周病学杂志,2014,24(12):687-691.LI J J,YAN M,WU J T,et al.Proliferation and osteogenic differentiation of tooth germ cells with different diameters.Chinese Journal of Conservative Dentistry,2014,24(12):687-691.(in Chinese with English abstract)
[32]WANG Y H,ZHENG H Y,QIN N L,et al.Involvement of ATP-sensitive potassium channels in proliferation and differentiation ofratpreadipocytes.Acta Physiologica Sinica,2007,59(1):8-12.
[33]SCHNEIDER E L,BRAUNSCHWEIGER K,MITSUI Y.The effect of serum batch on the in vitro lifespans of cell cultures derived from old and young human donors.Experimental Cell Research,1978,115(1):47-52.
[34]BURGENER A,PATRICK M,COOMBS K,et al.The modification of a serum-free media formulation for the production of reovirus and the growth of Vero,MRC-5,MDCK and BHK cell lines//Animal Cell Technology:From Target to Market.Netherlands:Springer,2001:200-203.
[35]WISTROM C,VILLEPONTEAU B.Long-term growth of diploid human fibroblasts in low serum media.Experimental Gerontology,1990,25(2):97-105.
[36]YAN X L,DONG R X,ZHANG L,et al.Raman spectra of single cell from gastrointestinal cancer patients.World Journal of Gastroenterology,2005,11(21):3290-3292.
[37]LI Z F,CHEN Y,LI Y Z,et al.Raman microspectroscopy as a diagnostic tool to study single living nasopharyngeal carcinoma cell lines.Biochemistry and Cell Biology,2013,91(3):182-186.
[38]唐伟跃,王杰芳,徐平.胃癌组织拉曼光谱的研究.激光杂志,2004,25(1):82-83.TANG W Y,WANG J F,XU P.Research of stomach cancer tissue by Raman spectroscopy.Laser Journal,2004,25(1):82-83.(in Chinese with English abstract)
[39]杨文沛,姚辉璐,朱淼,等.单个肝癌细胞的拉曼光谱分析研究.激光与红外,2007,37(9):824-827.YANG W P,YAO H L,ZHU M,et al.Raman spectrums of mono-hepatocellular carcinoma.Laser&Infrared,2007,37(9):824-827.(in Chinese with English abstract)
[40]韦芳,岳惠芬,罗瑞琼,等.激光拉曼光谱系统无损鉴别大鼠原代胰岛α、β细胞.广西医科大学学报,2016,33(2):212-216.WEI F,YUE H F,LUO R Q,et al.A laser Raman spectroscopy system for non-destructive identification of rat primary pancreatic islet α and β cells.Journal of Guangxi Medical University,2016,33(2):212-216.(in Chinese with English abstract)
[41]MUSA M,NASIR N F M,THIRUMULU K P.Evaluation of royal jelly as an alternative to fetal bovine serum in cell culture using cell proliferation assays and live cell imaging.African Journal of Traditional Complementary and Alternative Medicines,2014,11(1):148-155.

