培美曲塞联合顺铂治疗老年肺腺癌疗效
田应选,刘凌华,余蕾,尚文丽,任小平,朱建飞,孙莉,,余敏
(陕西省人民医院:1老年呼吸科,2肿瘤内科,4胸外科,西安 710068;3西安医学院附属省医院老年科,西安 710068)
肺癌已成为全球首要的恶性肿瘤,尤其老年患者多见,年龄越大死亡率越高[1,2]。腺癌是肺癌的主要病理类型之一,其早期诊断困难,易发生血行转移,大部分患者确诊时已失去手术机会,因此具有高治疗指数或安全性的药物对实施化学治疗(简称化疗)尤为重要[3]。培美曲塞(pemetrexed)是一种新型的多靶点抗叶酸制剂,对非小细胞肺癌(non-small cell lung cancer,NSCLC)尤其腺癌的治疗效果好,而且不良反应少[4]。Scagliotti等[5]的研究证实对于表皮生长因子受体(epidermal growth factor receptor,EGFR)野生型非鳞癌患者,相比吉西他滨+顺铂(gemcitabine+cisplatin,GP)方案,培美曲塞+顺铂(pemetrexed+cisplatin,PP)一线治疗方案可显著降低患者死亡风险19%,延长总生存期(overall survival,OS)1.4个月,该研究也是针对NSCLC组织学分型治疗的开始,但该研究对象是西方人群且未进行年龄分层;另外对一线治疗后的同药序贯治疗获益问题没有给出结果。因此,本研究通过收集应用PP方案一线治疗EGFR野生型NSCLC患者的资料,分析患者化疗期间的收益和不良反应,并随访观察远期疗效。
1 对象与方法
1.1研究对象
回顾性分析陕西省人民医院2010年1月至2016年6月老年呼吸科、胸外科和肿瘤内科采用PP方案的肺腺癌住院患者76例,其中男性35例,女性41例,年龄65~81岁,中位年龄67岁。 对照组为同期采用GP方案和多西他赛+顺铂(docetaxel+cisplatin,DP)方案的肺腺癌住院患者31例,男性14例,女性17例,年龄65~79岁,中位年龄68.1岁。纳入标准:年龄>65岁;美国东部肿瘤协作组/活动状态(Eastern Cooperative Oncology Group/performance status, ECOG/PS)评分0~2分;无化疗禁忌证;国际TNM分期ⅢB~Ⅳ期;分期为早期但有手术禁忌证;主观拒绝手术治疗患者;胸部CT检查至少有1个可测量病灶;预计生存期>3个月。排除标准:ECOG/PS评分 < 2分;预计生存期<3个月;严重肝肾功能障碍及骨髓抑制(白细胞计数<4×109/L,血小板计数<100×109/L);大咯血、发热提示感染者;对化疗药物过敏患者;主观拒绝化疗患者。
1.2方法
培美曲塞组治疗方案:培美曲塞(美国礼来公司,H20140662)500 mg/m2+顺铂(齐鲁制药有限公司,H20023461)90~100 mg,静脉滴注,每21 d为1个治疗给药周期,连续4周期。培美曲塞给药前1周,辅助用叶酸400 μg,多元维生素1000 mg,1次/d,同时肌肉注射维生素B121000 μg,每2个月1次。化疗期间连续服用地塞米松4 mg,2次/d。每例患者化疗2个周期后评价疗效。根据患者毒副反应给予止吐、补液、保护胃黏膜等对症支持治疗;≥Ⅱ°骨髓抑制者给予重组人粒细胞集落刺激因子 (granulocyte-colony stimulating factor,G-CSF)50 μg/m2治疗,1次/d,皮下注射。患者接受4周期化疗后采用培美曲塞维持治疗,800 mg/次,28 d为1个周期,直至肿瘤进展或患者放弃化疗。对照组治疗方案:吉西他滨(美国礼来公司,H20110535)1000 mg/m2+顺铂60 mg/m2;多西他赛(恒瑞医药,H20020534)75 mg/m2+顺铂,分1~3次静脉滴注,每21 d为1个治疗给药周期,连续4周期。
1.3疗效评价
采用世界卫生组织(World Health Organization,WHO)实体瘤客观疗效标准:完全缓解(complete remission,CR);部分缓解(partial remission,PR);稳定(stable disease,SD);病变进展(progress disease,PD)。如果化疗2个周期后患者疗效评价为CR、PR、SD,则进行下一周期。客观有效率(response rate, RR)的计算公式:(CR+PR)/总例数×100%。疾病控制率(disease control rate, DCR)的计算公式:(CR+PR+SD)/总例数×100%。中位生存期(median survival time,MST):50%个体存活的时间。总生存期(overall survival,OS):从随机化开始到任何原因引起的死亡时间。疾病进展时间(time to progress,TTP):从随机化开始到肿瘤客观进展的时间。
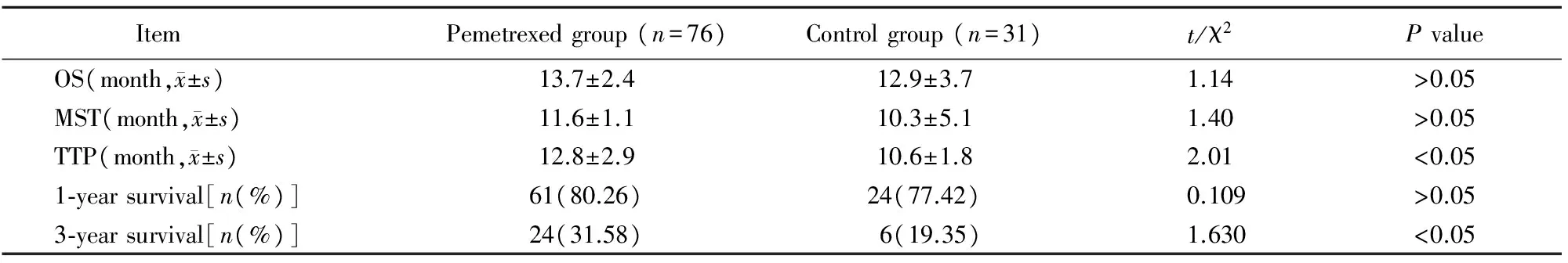
表3 两组患者远期疗效比较
OS: overall survival; MST: median survival time; TTP: time to progress
1.4随访
查阅患者的门诊、复诊记录及住院病历,登录病历系统查阅死亡记录单信息,并对资料不完整患者通过电话及门诊复诊进行随访,记录患者PS状况及OS。
1.5统计学处理
2 结 果
2.1两组患者基线资料比较
两组患者吸烟指数均>400支/年,为重度吸烟患者。两组患者性别、年龄、体质量指数、基础疾病、PS评分差异无统计学意义(P>0.05;表1)
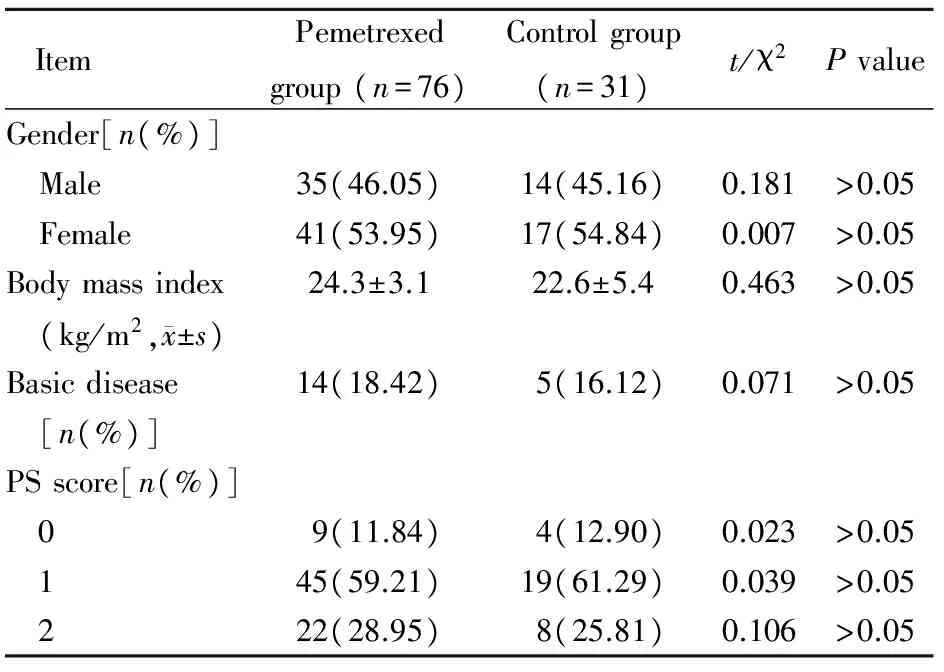
表1 两组患者基线资料比较
PS: performance status
2.2两组患者近期疗效比较
两组均无CR患者,PR患者比例差异无统计学意义(P>0.05)。相比对照组患者,培美曲塞组患者DCR较高,PD患者比例低,差异有统计学意义(P<0.05;表2)。
表2两组患者近期疗效比较
Table 2 Comparison of short-term curative effect between two groups [n(%)]
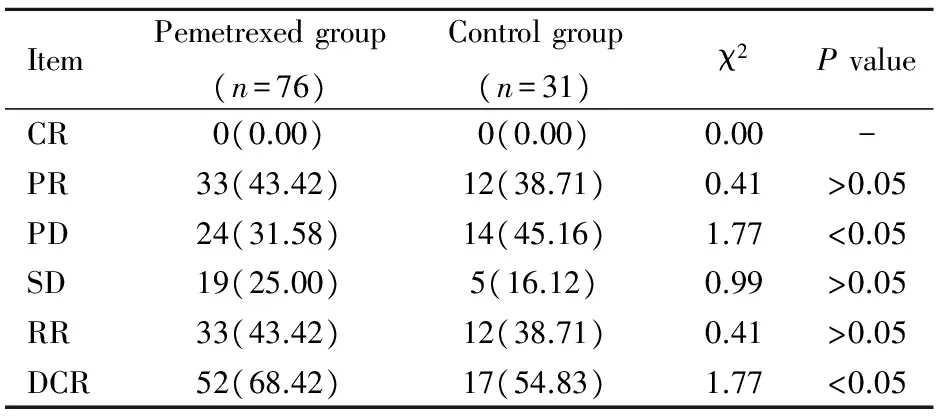
Item Pemetrexedgroup(n=76)Controlgroup(n=31)χ2PvalueCR0(0.00)0(0.00)0.00-PR33(43.42)12(38.71)0.41>0.05PD24(31.58)14(45.16)1.77<0.05SD19(25.00)5(16.12)0.99>0.05RR33(43.42)12(38.71)0.41>0.05DCR52(68.42)17(54.83)1.77<0.05
CR: complete remission; PR: partial remission; PD: progress disease; SD: stable disease; RR: response rate; DCR: disease control rate
2.3两组患者远期疗效比较
两组患者MST、OS差异无统计学意义(P>0.05)。相比对照组患者,培美曲塞组患者TTP、3年生存率优于对照组,差异具有统计学意义(P<0.05;表3)。
2.4两组患者的Kaplan-Meier生存曲线
Kaplan-Meier生存曲线结果表明,培美曲塞组患者中位OS为13.7个月,对照组患者为12.9个月,Log Rank检验结果表明培美曲塞组患者远期生存率略优于对照组,差异具有统计学意义(χ2=3.97,P<0.05),具体见图1。
3 讨 论
老年晚期NSCLC的化疗是临床常见问题,尤其是EGFR野生型患者,顺铂两联化疗方案仍是标准的一线治疗方案[6]。但患者在得到化疗收益的同时也经受着广泛而明显的化疗相关毒性。培美曲塞可通过阻遏细胞内叶酸的正常代谢过程,抑制肿瘤细胞复制,诱导凋亡,已经成为NSCLC患者的一线选择[7,8]。本研究结果表明培美曲塞组患者的RR是43.42%(33/76),DCR是68.42%(52/76),患者通过化疗获得了收益。
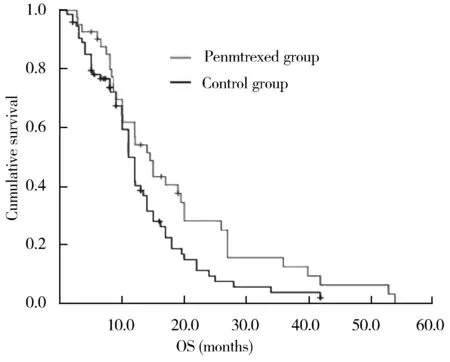
图1 两组患者Kaplan-Meier生存曲线
PP方案相关不良反应最常见的是骨髓抑制、疲乏、无力、恶心和呕吐,多为Ⅰ~Ⅱ度,耐受性和安全性良好[9,10],临床用于老年患者是较好的选择。本研究结果表明培美曲塞组患者相比对照组PD人数比例低,提示PP方案有较高的疾病稳定率,Kaplan-Meier生存曲线也表明培美曲塞组患者OS优于对照组,中位OS达13.7个月,随访时间达56个月,远期结果与其他研究基本相似[11]。
另外,一线治疗后的维持治疗也是培美曲塞的优势,相关研究表明患者能够接受的维持治疗周期越长,越能够获得可能长的OS,维持治疗是具有临床价值的持续治疗策略[12]。但由于尚缺乏大样本、多中心关于老年患者维持治疗的研究结果,因此维持治疗仅作为可供选择的方案,并非标准治疗方案,并不能在老年患者中广泛得以应用。 总之,PP治疗方案是一个可接受的老年NSCLC尤其是腺癌患者的标准治疗方案;部分PS评分较好的患者可接受一线治疗后的维持治疗,并能够获得较好的生存质量和较理想的生存期。本研究也存在不足,样本量偏小,维持治疗的数据较少,因此数据的局限性也较明显,后期期望获取多中心数据进行分析和研究。
[1] Miller KD, Siegel RL, Lin CC,etal. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66 (4): 271-289. DOI: 10.3322/caac.21349.
[2] 张玉萍, 杨拴盈. 老年肺癌早期诊断进展[J]. 中华老年多器官疾病杂志, 2012, 11(8): 580-583.
Zhang YP, Yang SY. Early diagnosis for geriatric lung cancer:a review[J]. Chin J Mult Organ Dis Elderly, 2012, 11(8): 580-583.
[3] Bareschino MA, Schettino C, Rossi A,etal. Treatment of advanced non-small cell lung cancer[J]. J Thorac Dis, 2011, 3(2):122-133. DOI: 10.3978/j.issn.2072-1439.2010.12.08.
[4] 汪斌超, 吴一龙. 晚期老年人非小细胞肺癌化疗的循证医学证据及思考[J]. 中华老年多器官疾病杂志, 2012, 11(8): 577-579.
Wang BC, Wu YL. Food for thought based on the evidence of chemotherapy for elderly patients with advanced non-small cell lung cancer[J]. Chin J Mult Organ Dis Elderly, 2012, 11(8): 577-579.
[5] Scagliotti GV, Parikla P, von Pswel J,etal. Phase Ⅲ study comparing cisflatin plus gemcitabine with cisplain plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol, 2008, 26(21): 3543-3551. DOI: 10.1200/JCO.2007.15.0375.
[6] Nsclc Meta-Aanlyses Collaborative Group. Chemotherapy in addition to supportive care improves survival in advanced non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data from 16 randomized controlled trials[J]. J Clin Oncol, 2008, 26(28): 4617-4625. DOI: 10.1200/JCO.2008.17.7162.
[7] Pallis AG, Gridelli C, Wedding U,etal. Management of elderly patients with NSCLC; updated expert’s opinion paper: EORTC Elderly Task Force, Lung Cancer Group and International Society for Geriatric Oncology[J]. Ann Oncol, 2014, 25(7): 1270-1283. DOI: 10.1093/annonc/mdu022.
[8] Aarts MJ, van den Borne BE, Biesma B,etal. Improvement in population-based survival of stage Ⅳ NSCLC due to increased use of chemotherapy[J]. Int J Cancer, 2015, 136(5): 387-395. DOI: 10.1002/ijc.29216.
[9] 施勋, 余新民, 张沂平, 等. 培美曲塞或吉西他滨联合卡铂一线治疗老年晚期非小细胞肺癌的疗效和安全性[J].中华肿瘤杂志, 2013, 35(3): 221-225. DOI: 10.3760/cma.j.issn.0253-3766.2013.03.013.
Shi X, Yu XM, Zhang YP,etal. Efficacy and safety of pemetrexed or gemcitabine combined with carboplatin as the first-line therapy in elderly patients with advanced non-small cell lung cancer[J]. Chin J Oncol, 2013, 35(3): 221-225. DOI: 10.3760/cma.j.issn.0253-3766.2013.03.013.
[10] 段建春, 吴梅娜, 赵军, 等. 培美曲塞联合铂类药物一线治疗晚期非小细胞肺癌的疗效及预测因素分析[J].中华结核和呼吸杂志, 2012, 2(35): 97-101. DOI: 10.3760/cma.j.issn.1001-0939.2012.02.008.
Duan JC, Wu MN, Zhao J,etal. Effect of pemetrexed plus platinum for chemotherapy-naive advanced non-small cell lung cancer[J]. Chin J Tuberc Respir Dis, 2012, 2(35): 97-101. DOI: 10.3760/cma.j.issn.1001-0939.2012.02.008.
[11] Abe T, Takeda K, Ohe Y,etal. Randomized phase Ⅲ trial comparing weekly docetaxel plus cisplatinversusdocetaxel monotherapy every 3 weeks in elderly patients with advanced non-small-cell lung cancer: the intergroup trial JCOG0803/WJOG4307L[J]. J Clin Oncol, 2015, 33 (6): 575-581. DOI: 10.1200/JCO.2014.55.8627.
[12] Scagliotti G, Brodowicz T, Shepherd FA,etal. Treatment-by-histology interaction analyses in three phase Ⅲtrials show superio-rity of pemetrexed in non-squamous non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(1): 64-70. DOI: 10.1097/JTO.0b013e3181f7c6d4.

