非结核分枝杆菌肺病的MSCT表现
陈露, 史河水, 曲世林, 李本美, 李发洲, 张方园
【Kye words】 Nontuberculous mycobacteria pulmonary disease; Bronchiectasis; Cavity; Bronchiolitis; Tomography,X-ray computed
结核分枝杆菌复合群包括结核分枝杆菌、非洲分枝杆菌、牛分枝杆菌和田鼠分枝杆菌。非结核分枝杆菌(non-tuberculous mycobacteria,NTM)是指除结核分枝杆菌复合群及麻风分枝杆菌以外的分枝杆菌。近年来,随着医疗技术的迅猛发展,NTM肺病的检出率不断升高,但由于该病的临床表现无明显特异性,且抗酸杆菌的培养与菌型鉴定需时较长、费用较高,导致误诊率、漏诊率较高。笔者搜集60例经实验室检查证实的NTM肺病,分析、总结其CT影像表现,旨在提高对该病的认识。
材料与方法
1.研究对象及一般资料
搜集我院2012年1月-2016年10月经实验室检查确诊、行1次或1次以上多层螺旋CT扫描、有完整CT影像资料的60例NTM肺病。NTM肺病的诊断参照文献[1,2]的标准。痰或支气管灌洗液通过罗氏培养基初步鉴定分枝杆菌菌种提示NTM,即PNB(对苯甲酸)和TCH(噻吩二羧酸胫)选择性培养基接种均阳性。
为排除合并结核与其它感染的可能,对于早期经诊断性抗结核或抗炎治疗后病灶吸收好转的病例(17例),舍弃其治疗期间的CT图像(41次)。
60例NTM肺病患者中,男24例,女36例,年龄34~75岁,平均(57.9±9.2)岁。临床症状与体征:咳嗽、咳痰42例;发热18例;咯血12例;痰血8例;胸痛6例;盗汗、气喘、纳差、消瘦各4例;5例体检无任何症状和体征。合并症:伴Ⅱ型糖尿病4例;糖耐量减低1例;血吸虫病肝2例;食管癌化疗术后1例。52例痰标本实验室检查结果:PNB(+),TCH(+)10例;PNB(),TCH(+)18例;PNB(+),TCH()13例;PNB(),TCH()11例。8例支气管灌洗液标本罗氏培养结果:PNB(+),TCH(+)1例、PNB(),TCH(+)各1例,PNB(),TCH()6例。
2.检查方法及扫描参数
60例患者共进行112次CT检查。采用美国GE公司Light Speed 16层螺旋CT扫描仪,机架转速0.5 s/r,准直器宽度16×1.25 mm,螺距1.375:1,管电压120 kV,管电流250 mA。扫描前对患者进行屏气训练,扫描时嘱患者在平静呼吸下屏气,扫描范围自肺尖到肋膈角下缘,方向从上至下。将原始数据重建为1.25 mm层厚、1.25 mm层间距的图像,并传入ADW 4.5工作站,以肺窗(窗宽1000~1500 HU,窗位-500~-600 HU)和纵隔窗(窗宽300~350 HU,窗位 35~50 HU)进行观察。
3.图像分析
由3位有经验的主治及以上职称的放射科医师分别阅片,意见不一致时经过讨论达成一致。将全肺分为6叶(左舌叶列为单独一叶),记录病灶形态、大小、分布特征,主要观察征象包括:支气管扩张、空洞、细支气管炎、肺不张、纵隔淋巴结肿大(气管隆突下淋巴结直径≥1.5 cm,其它纵隔内淋巴结直径≥1.0 cm)、胸腔积液及胸膜增厚等。
结 果
NTM肺病的CT表现复杂多样,主要有斑片状影、片状影、索条状影、支气管扩张、空洞、树芽征、肺不张等,以1~2种征象为主,多种表现混合存在。分析本组60例的CT图像,大致分为以下三类:
1.支气管扩张合并细支气管炎型
主要CT表现为支气管扩张合并细支气管炎(图1),本型共35例(35/60,占58.3%),具体分布情况见表1。支气管扩张均呈柱状,同一肺叶均可见细支气管炎。细支气管炎CT表现为小结节(直径<1 cm)和分支性小叶中心结节(树芽征)[3],均呈多肺叶分布,具体分布情况见表2,其中23例(23/35,占65.7%)细支气管炎从肺门侧至胸膜侧均匀散在分布,12例(12/35,占34.3%)主要分布于肺外围。
8例(8/35)患者合并空洞,空洞数共18个,其中仅合并1个空洞4例,合并3个、4个空洞各2例。各肺叶空洞数量见表3,最常见部位为右肺上叶(8个);空洞分布位置、形态及周围卫星病灶情况见表4。
10例(10/35)患者见全小叶肺不张,均伴支气管气象,且其内支气管扩张呈柱状、串珠状。1例肺不张位于右肺中叶和左舌叶,9例呈单叶分布(右肺中叶7例,左肺下叶2例)。
本型未见胸膜增厚、胸腔积液、纵隔淋巴结肿大征象。
2.结核相似型
主要病灶呈渗出、增殖及纤维化改变,CT表现为片状、斑片状、索条状影等,与继发性肺结核CT表现相似(图2)。与支气管扩张合并细支气管炎型相比,本型病灶分布较集中,主要位于肺中内带。本型共23例(23/60,占38.3%),仅2例(2/23)呈单叶分布(均位于左肺上叶),其余21例(21/23)呈多肺叶分布,依次为:左肺上叶20例;右肺上叶、下叶各18例;左舌叶、右肺中叶各16例;左肺下叶10例。
16例(16/23)患者合并空洞,空洞数共44个,其中仅合并1个空洞6例,3个空洞6例、4个和6个空洞均2例。各肺叶空洞数量见表3。空洞最常见部位为左肺上叶。空洞分布位置、形态及周围卫星病灶情况见表4。
合并支气管扩张者8例(8/23),其中1例为单肺叶分布(位于右肺上叶),7例为多肺叶分布,具体分布情况见表1,支气管扩张均为柱状。
4例(4/23)患者细支气管炎的CT表现均呈树芽征,且均多叶分布,依次为:双肺下叶4例、左肺上叶3例;左肺舌叶、右肺上叶各2例;右中叶1例。2例呈均匀散在分布,2例主要分布于肺外带。
4例(4/23)伴肺不张,均表现为右肺上叶全小叶不张,其内均可见柱状支气管扩张;2例伴左侧胸膜增厚;左侧、右侧少量胸腔积液各1例;未见纵隔淋巴结肿大征象。
3.混合型
合并肺囊肿患者1例,CT表现为右肺见大片状实变影,内可见支气管气象,右肺下叶后基底段见一巨大肺大泡,内可见液平,抗炎2周,液平面消失,提示合并感染(图3)。左下叶见少许结节状、斑点状影,右侧见少量胸腔积液。
主要CT表现为结节灶者1例,患者右肺中叶、下叶及左肺见多发大小不等小结节状影,最大者直径约0.6 cm,边缘清楚,病灶从肺门至胸膜分布均匀(图4),右肺上叶不张伴柱状支气管扩张,可见截面大小约2.4 cm×2.1 cm的不规则空洞。
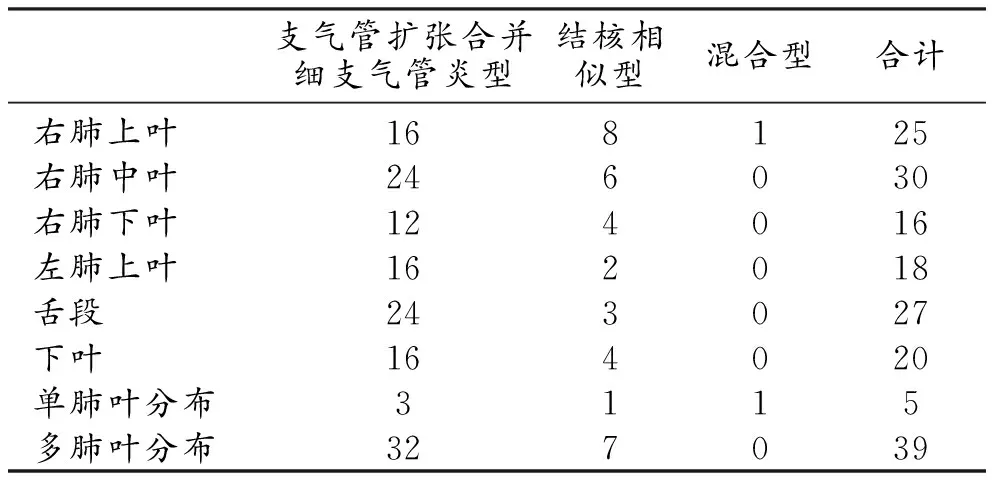
表1 各型NTM肺病的支气管扩张分布情况 (例)
表2 支气管扩张合并细支气管炎型NTM肺病的细支气管炎分布情况 [例(%)]

小结节树芽征右肺上叶30(85.7)22(62.9)右肺中叶27(77.1)13(37.1)右肺下叶33(94.3)30(85.7)左肺上叶30(85.7)18(51.4)舌叶27(77.1)11(31.4)左肺下叶33(94.3)27(77.1)
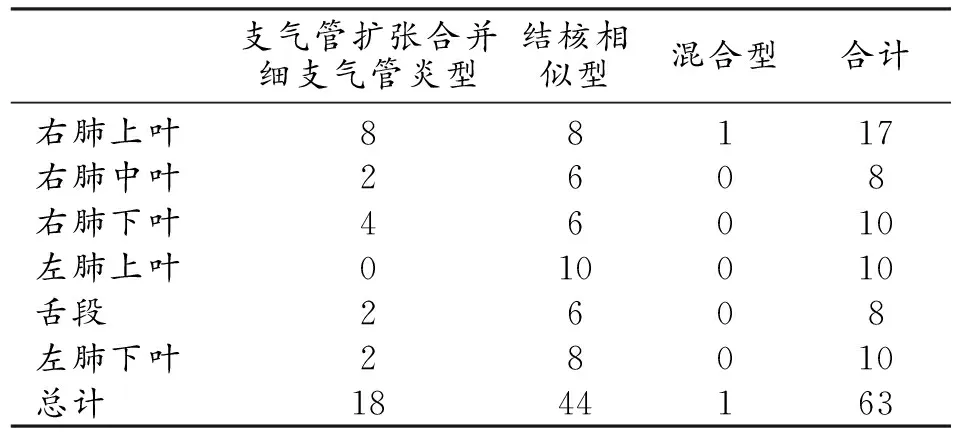
表3 各型NTM肺病的空洞分布情况 (个)

表4 各型NTM肺病的空洞表现总结 (个)
讨 论
NTM广泛存在于土壤、河流、湖泊等自然环境中,牛奶、鸟类、动物以及下水道均可受到NTM的污染[4,5]。NTM有百余种,只有部分是致病菌或条件致病菌,既往被称为环境分枝杆菌、非典型分枝杆菌等。仅20余种与临床相关的NTM可通过呼吸道、胃肠道、皮肤黏膜等途径侵入人体,引起肺、消化道、皮肤软组织、骨关节、淋巴结等疾病或无症状的感染(通过血清相应抗体检测及NTM特异性抗原的皮肤试验而推断)[6]。侵犯肺部者称为NTM肺病,发生在无明确易感因素的老年妇女者,称为温德米尔综合征[7]。机体免疫功能低下者(如AIDS患者)可引起全身播散性非结核分枝杆菌病。
本文根据CT表现将NTM肺病分为三类:支气管扩张合并细支气管炎型、结核相似型、混合型。常见征象有支气管扩张、细支气管炎和空洞。支气管扩张均为柱状,与继发性肺结核的支气管扩张表现不同,后者多为局限性轻度支气管扩张,由邻近纤维组织牵拉所致或为毁损肺内代偿性支气管扩张,CT表现为柱状、囊状、静脉曲张状透亮影。许多学者[8,9]认为NTM肺病最常见、最典型的MSCT表现是柱状扩张支气管、双侧小结节影及树芽征,尤其是病灶分布于右中叶及左肺上叶舌段,与本文结论一致。

图1 女,55岁,咳嗽2月,痰血1个月。支气管灌洗液PNB(+),TCH(+)。a) CT平扫示右肺下叶后段见不规则小空洞(箭)及柱状支气管扩张(箭头); b) CT平扫示右肺中叶、左肺上叶舌段、左肺下叶柱状支气管扩张(箭),右中叶不张(箭头); c) CT平扫示双肺散在树芽征(箭)。 图2 女,47岁,咳嗽、咳痰2月,加重1周。痰培养PNB(),TCH(+)。a) CT平扫示右肺上叶见数个不规则空洞(箭)及柱状支气管扩张(箭头),空洞位于肺外围; b) CT平扫示右肺中叶、下叶见增殖灶、渗出灶,表现与继发性肺结核相似。 图3 女,68岁,间断发热、咳嗽2月余,加重5天,呕吐、腹泻1天。2型糖尿病2年,痰培养PNB(+),TCH(+)。a) CT平扫示右肺中叶、下叶大片状高密度影,部分呈磨玻璃样改变; b) CT平扫示右下叶见囊状透亮影,内见液平(箭); c) 抗感染2周后CT平扫复查示右肺中叶、下叶多个小结节灶(箭); d) 抗感染2周后CT平扫复查示右下叶液平完全吸收。 图4 男,57岁,间断咳嗽、发热1年,加重伴气喘1月余。支气管灌洗液PNB(+),TCH(+)。右中叶、下叶见多个大小不等小结节灶,边缘清晰(箭)。
支气管扩张与NTM肺病的因果关系目前尚无定论。多数学者认为支气管扩张是导致NTM感染的重要原因,但也有研究显示NTM感染是引起支气管扩张的重要原因[10,11]。国外学者分析鸟胞内分枝杆菌复合群(mycobacterium avium-intracellulare complex,MAC)肺病的病理标本发现,MAC肺病的主要病理特征为肉芽肿侵犯大气道和细支气管使其管腔狭窄,侵犯气道肌肉层使其肌层断裂,导致支气管扩张。而肺小叶树芽征的形成则是由细支气管腔内存在坏死组织及(或)小叶内散在肉芽肿所致。组织病理学检查可见细支气管扩张和细支气管周围炎症伴或不伴有肉芽肿[12],进一步佐证了NTM感染是引起支气管扩张的原因。广州市胸科医院的宋敏等[13]追踪8例确诊为NTM肺病的患者,通过对比患者先后多次的MSCT扫描结果发现:随着NTM肺病病情的加重,病变的支气管扩张程度会加重,扩张支气管、填充支气管征(沿支气管走行的索状密度增高影)及树芽征会逐渐增多。另外,8例中仅1例经过治疗,少部分树芽征和填充支气管征吸收消失,从而提示早期的树芽征和填充支气管征属于可逆性病变。
NTM肺病的空洞周围卫星灶较少见,而邻近扩张的支气管较常见,这点与继发性肺结核明显不同。空洞多位于肺外带,这与部分学者的观点(胸膜下空洞是NTM肺病的特征性表现之一)相吻合。肺外带空洞,特别是空洞周围伴支气管扩张者应高度怀疑NTM肺病的可能。
本文所有病例均无纵隔、双肺门区淋巴结肿大的征象,这是因为本文讨论的是单纯的NTM肺病,当NTM肺病合并其它的基础疾病,如AIDS时,常见纵隔、肺门淋巴结肿大,肿大淋巴结呈环形强化,且肺内病灶具有明显播散性,实变和弥漫分布性病变更常见[14]。
诊断和鉴别诊断直接影响NTM肺病的治疗和预后,而NTM肺病的误诊具有广泛性、长期性。NTM肺病的误诊原因很多。首先,该病的临床症状、体征及CT表现无特异性,特别是在发病、临床表现、影像学、涂片和培养、结核菌素试验、病理学检查等方面均与继发性肺结核十分相似。其次,NTM肺病的CT表现分型并不是绝对的,每个病例都不是单一的表现形式。另外,NTM肺病可合并其它疾病,如非特殊感染、肺结核、曲霉菌感染等。本文中28例患者误诊为肺结核,且接受至少6个月的规范药物化疗,病情反复,其中6例病灶稍吸收,其余病灶吸收不明显或增多,最后通过罗氏培养基初步鉴定为分枝杆菌菌种才确诊为NTM 肺病, 因此,是NTM肺病合并结核分枝杆菌感染,还是继发性肺结核经过药物化疗,结核分枝杆菌转阴后感染上非结核分枝杆菌尚无法区分。有实验证明NTM感染和曲霉菌肺病之间存在相关性,两者间是否存在因果关系还有待进一步证实;曲霉菌肺病可能会被误导为抗NTM肺病或肺结核治疗失败或治疗后复发[15]。在实际工作中,NTM肺病属于排它性诊断,确诊依赖于实验室检查。
本文的不足之处在于,所有NTM肺病的确诊均依靠实验室检查,即PNB(对苯甲酸)和TCH(噻吩二羧酸胫)选择性培养基接种阳性,无纤支镜及肺活检确诊患者。有些专家认为,痰培养不足以诊断该病,必须进行侵入性检查,如支气管肺泡灌洗和活体组织检查,只有从标本中分离出分枝杆菌作菌型鉴定才能确诊。
近年来,NTM肺病的发病机制、流行病等相关方面的研究数量空前,其诊断水平大幅度提高,但该病的治疗,特别是MAC感染,仍然是疑难问题。体外药物敏感试验显示,NTM特别是MAC普遍对抗生素不敏感,不像治疗肺结核那样可以用体外细菌学的敏感试验有效指导抗生素的治疗。体内快速增长的分枝杆菌耐药过程复杂,且耐药分子生物学的机制尚不明确[16,17]。希望随着NTM相关研究的深入,这些难题可以得到圆满的解决。
[1] 中华医学会结核病学分会, 《中华结核和呼吸杂志》编辑委员会.非结核分枝杆菌病诊断与治疗专家共识[J].中华结核和呼吸杂志,2012,35(8):572-580.
[2] 中华医学会结核病学分会.非结核分支杆菌病诊断与处理指南[J].中华结核和呼吸杂志,2000,23(11):650-653.
[3] 王青乐,张志勇,施裕新,等.活动性肺结核的HRCT诊断[J].放射学实践,2013,28(12):1294-1295.
[4] Crago B,Ferrato C,Drews SJ,et al.Surveillance and molecular characterization of non-tuberculous mycobacteria in a hospital water distribution system over a three-year period[J].J Hosp Infect,2014,87(1):59-62.
[5] Cafri U,Aslan G,Direkel S,et al.Identification and isolation of non-tuberculous mycobacteria from environmental samples[J].Mikrobiyol Bul,2010,44(3):395-403.
[6] Parrish SC,Myers J,Lazarus A.Nontuberculous mycobacterial pulmonary infections in Non-HIV patients[J].Postgrad Med,2008,120(4):78-86.
[7] Prince DS,Peterson DD,Steiner RM,et al.Infection with mycobacterium avium complex in patients without predisposing conditions[J].N Engl J Med,1989,321(13):863-868.
[8] 贺伟,潘纪戍,周新华.非结核分枝杆菌肺病的影像学表现[J].中华结核和呼吸杂志,2004,27(8):553-556.
[9] Jeong YJ,Lee KS,Koh WJ,et al.Nontuberculous mycobacterial pulmonary infection in immunocompetent patients:comparison of thin-section CT and histopathologic findings[J].Radiology,2004,231(3):880-886.
[10] Koh WJ,Lee KS,Kwon OJ,et al.Bilateral bronchiectasis and bronchiolitis at thin-section CT:diagnostic implications in nontuberculous mycobacterial pulmonary infection[J].Radiology,2005,235(1):282-288.
[11] Wickremasinghe M,Ozerovitch LJ,Davies G,et al.Non-tuberculous mycobacteria in patients with bronchiectasis[J].Thorax,2005,60(12):1045-1051.
[12] Kim TS,Koh WJ,Han J,et al.Hypothesis on the evolution of cavitary lesions in nontuberculous mycobacterial pulmonary infection:Thin-Section CT and histopathologic correlation[J].AJR,2005,184(4):1247-1252.
[13] 宋敏,刘文,方伟军,等.非结核分枝杆菌肺病的MSCT表现特点分析[J].实用放射学杂志,2012,9(28):1345-1349.
[14] 刘晋新,唐小平,张烈光,等.艾滋病合并非结核分枝杆菌肺病的胸部影像表现[J].中华放射学杂志,2010,44(9):937-939.
[15] Kunst H,Wickremasinghe M,Wells A,et al.Nontuberculous mycobacterial disease and aspergillus-related lung disease in bronchiectasis[J].Eur Respir J,2006,28(2):352-357.
[16] 刘国标,罗春明,陈燕珍,等.非结核分枝杆菌与结核分枝杆菌皆培养阳性病例的分析[J].中华结核和呼吸杂志,2012,35(8):617-618.
[17] 王维勇,何间红,陈华,等.88例非结核分枝杆菌的药敏实验分析[J].当代医学杂志,2010,16(32):54-55.

