多层螺旋CT对胰腺癌周围血管侵犯及肿瘤可切除性的术前评估
陈威,曾燕
胰腺导管上皮来源性恶性肿瘤(胰腺癌)是一种恶性程度极高、预后极差的消化系统肿瘤。由于胰腺癌早期易转移、且缺乏特异性症状及体征,故绝大多数患者就诊时已处于晚期;文献报道仅20%的胰腺癌可经手术切除为主的综合性治疗而治愈[1,2]。近年来,潜在可切除胰腺癌成为研究热点,由于其合并周围大血管受累,多需联合血管切除并重建的术式,因此,胰周血管的影像学评价在其术前分期中具有重要的地位[3-6]。本文回顾性总结多层螺旋CT术前对胰腺癌(包括可切除组、潜在可切除组和不可切除组)周围血管的显示情况及可切除性评估,并将结果与手术病理进行对照,以评估其诊断符合率及临床应用价值。
材料与方法
1.一般资料
回顾性分析2014年5月-2016年10月在我院进行多层螺旋CT多期扫描的、经病理证实的98例胰腺癌患者的临床及影像资料。98例患者中,男62例,女36例;年龄35~75岁,平均57岁。9例为体检时偶然发现,无明显不适症状;其余病例均有腹胀、不同程度上腹部或背部隐痛、食欲减退;部分患者伴消瘦、黄疸等症状。
2.多层螺旋CT扫描方案
所有患者均进行多层螺旋CT扫描。扫描前禁食4~6 h,扫描前30 min口服800 mL温开水充盈胃腔。采用东芝Aquilion One 320排CT扫描机。扫描参数:管电压120 kV,管电流350 mA,层厚5 mm,层距5 mm,重建层厚1 mm,扫描范围从右膈顶至左肾下极水平。行上腹部CT平扫后,通过高压注射器经前壁静脉注入对比剂碘海醇(300 mg I/mL),剂量1.5 mL/kg,注射流率3~3.5 mL/s。延迟扫描时间:动脉期20~30 s,胰腺期35~40 s,门脉期60~80 s。
3.图像后处理及图像分析
将扫描所得图像传入后处理工作站,进行容积再现(VR)、最大密度投影(MIP)、多平面重组(MPR)及曲面重组(CPR)等图像后处理。
所有图像由2名10年以上CT诊断工作经验医师进行独立分析,意见不一致时,通过协商达成一致。分析内容:通过观察肿瘤对胰周血管(主要包括腹腔干、肠系膜上动脉、脾动脉、肝总动脉、门静脉、肠系膜上静脉、脾静脉)的侵犯情况,对肿瘤的可切除性进行术前评价。
本研究参考2014年美国国立综合癌症网络(national comprehensive cancer network,NCCN)发布的胰腺癌手术标准指南,CT评估胰周血管受侵、胰腺癌是否可切除标准如下:
肠系膜上静脉(SMV)、门静脉(PV)受侵标准[5]: 1级,肿瘤与静脉无直接接触面;2级,肿瘤与静脉接触面小于静脉周径1/2,无静脉管壁及管腔改变;3级,肿瘤与静脉接触面小于静脉周径1/2,且静脉管壁毛糙或管腔狭窄;4级,肿瘤与静脉接触面大于静脉周径1/2,无静脉管壁及管腔改变;5级,肿瘤与静脉接触面大于静脉周径1/2,且静脉管壁毛糙或管腔狭窄;6级,肿瘤完全包绕静脉或静脉管腔内无对比剂。1~2级认为静脉无受侵,3~6级认为静脉受侵。1~4级可行保留静脉的根治性切除术或静脉切除术,5~6级表面肿瘤完全不能切除。
胰周动脉受侵标准[7]:1级,肿瘤与动脉无直接接触面;2级,肿瘤与动脉接触面小于动脉周径1/2;3级,肿瘤与动脉接触面大于动脉周径1/2,无动脉管壁及管腔改变;4级,肿瘤与动脉接触面大于动脉周径1/2,且动脉管壁毛糙或管腔狭窄;5级,肿瘤完全包绕动脉或动脉管腔内无对比剂。1~3级认为无动脉受侵,血管可切除;4~5级认为动脉受侵,血管不可切除。
胰腺癌可切除标准:①无远处转移;②未侵犯SMV和PV;③与腹腔干、肝动脉起始段、肠系膜上动脉(SMA)的脂肪间隙清晰。
胰腺癌潜在性可切除标准:①无远处转移;②侵犯SMV或PV或两者交界处,但能进行血管切除和重建;③局限性侵犯胃十二指肠动脉或肝总动脉,但未浸润至腹腔动脉干;④累及SMA但不超过血管壁周径的1/2。
胰腺癌不可切除标准:①远处转移;②侵犯SMV和PV且不能进行血管重建;③包绕SMA超过180°或累及腹腔干和下腔静脉的胰头癌;④累及SMA或包绕腹腔干超过180°的胰体尾癌。
结 果
1.病理结果及手术情况
98例胰腺癌分布情况:胰头颈56例(57.1%),胰体32例(32.7%),胰尾10例(10.2%)。所有病例通过手术或细针穿刺获得病理结果。组织学分类:乳头状腺癌23例、管状腺癌46例、囊腺癌17例、腺泡细胞癌3例、胰岛细胞癌6例、其他少见类型3例。可切除性胰腺癌(含潜在可切除)71例,其中行胰十二指肠切除47例,胰体尾切除22例,全胰切除2例。不可切除胰腺癌27例,通过细针穿刺获取病理诊断。
2.CT对胰腺癌周围血管的评价
共评价胰腺癌(98例)周围血管共588支,其中动、静脉各294支。胰周动、静脉受侵的CT和手术结果对照见表1、2,胰周动、静脉受侵的CT诊断效能见表3。
3.CT多期扫描对胰腺癌可切除性的判断
CT术前评估可切除性胰腺癌(含潜在可切除)75例(其中6例手术认为不可切除),不可切除胰腺癌23例(其中2例手术认为可切除)。CT评价胰腺癌的可切除性诊断符合率为91.8%,敏感度为97.2%,特异度为77.8%,阳性预测值为92.0%,阴性预测值为91.3%。
术前CT诊断可切除胰腺癌37例,而手术实际切除36例(图1),1例因术中发现大网膜上小结节状转移癌而未行手术切除,CT评价胰腺癌可切除的诊断符合率为97.3%。37例术中均未发现血管侵犯,故CT对可切除胰腺癌周围血管侵犯的诊断符合率为100%。

图1 男,61岁,病理证实为胰颈部管状腺癌,CT诊断为可切除胰腺癌,手术成功根治性切除。a) 增强CT显示胰颈部低密度肿块(箭),与脾静脉(△)之间间隔正常胰腺组织,无静脉累及; b) 腹腔干及分支三维重建显示腹腔干(△)、肝总动脉(▲)未见侵犯; c) 腹腔干三维重建显示管壁光滑。 图2 女,49岁,病理证实为胰腺体部管状腺癌。a) 增强CT显示位于胰腺体部肿块(箭),包绕腹腔干(△)、肝总动脉(▲)及脾动脉(★)超过180度,CT诊断为不可切除胰腺癌; b) VR显示肝总动脉壁轻度狭窄(箭); c) 肝总动脉MPR显示管壁浸润、管腔狭窄,其远端轻度扩张。
术前CT诊断的23例不可切除胰腺癌中,血管受侵13例,肝转移4例,腹膜后区淋巴结转移3例,网膜转移2例,脾脏浸润1例。2例误诊者均被CT发现肿瘤包绕肝总动脉和SMA超过180°,而手术探查发现肿瘤与动脉壁可完整剥离(图2)。
术前CT诊断潜在性可切除胰腺癌38例(图3、4),术后证实其中5例不可切除,CT评价潜在性可切除胰腺癌的诊断符合率为86.8%。5例误诊病例中,术中发现网膜小结节状转移癌1例;肝脏表面小结节状转移灶1例;肿瘤包绕SMA且未超过血管周径一半,但已浸润管壁至管腔内2例;肿瘤浸润PV且无法进行血管重建1例。33例手术成功切除的病例中,25例行联合SMV或PV切除;8例由于腹腔干可疑受侵,先行辅助放疗,后行根治性切除。
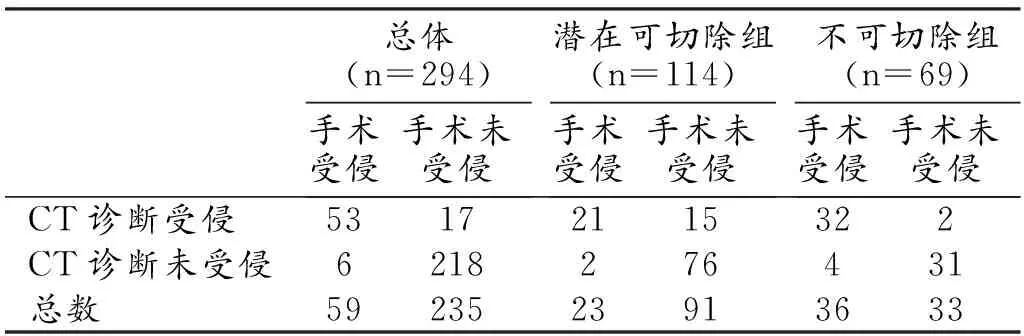
表1 胰周动脉受侵的CT和手术结果对照 (支)

表2 胰周静脉受侵的CT和手术结果对照 (支)
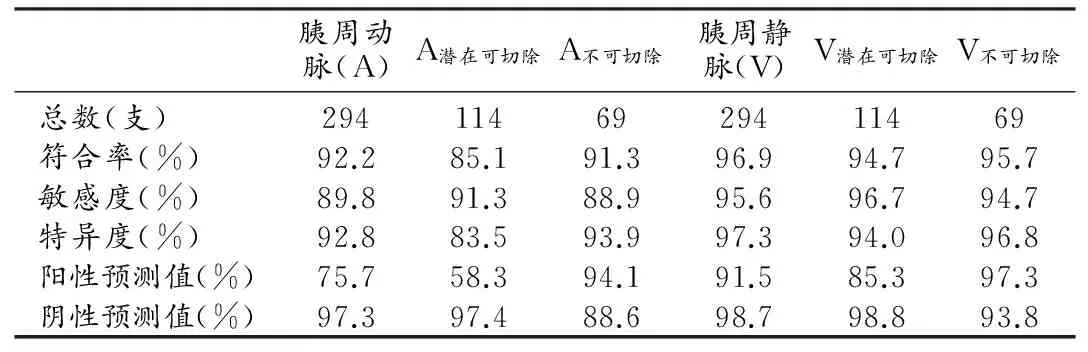
表3 CT对胰腺癌周围血管浸润的诊断效能
讨 论
胰腺MSCT扫描能很好的评估肿瘤与周围血管的关系,且受操作者水平影响小,其对不可切除的局部进展期胰腺癌的评估预测值可达100%,对可切除胰腺癌的评估预测值仅为54%[8]。既往文献将CT对胰腺癌可切除性评估分为可切除(respectable)和不可切除(unrespectable)[9,10],将不可切除定义为合并远处转移及合并/可疑合并周围血管浸润者。近年来,随着手术水平的提高及对胰腺癌认识的不断深入,传统认为不可切除的胰腺癌可切除甚至可得到根治性切除,美国安德森肿瘤中心由此提出“潜在可切除”的概念[11]。胰腺癌的CT多期增强扫描可准确判断病灶部位及其与周围血管的关系,为术前准确的可切除性评估提供了判断基础。本研究利用术前CT诊断结果将胰腺癌分为可切除组、潜在可切除组和不可切除组三组,观察各组胰周血管侵犯及肿瘤可切除性的CT评估情况。
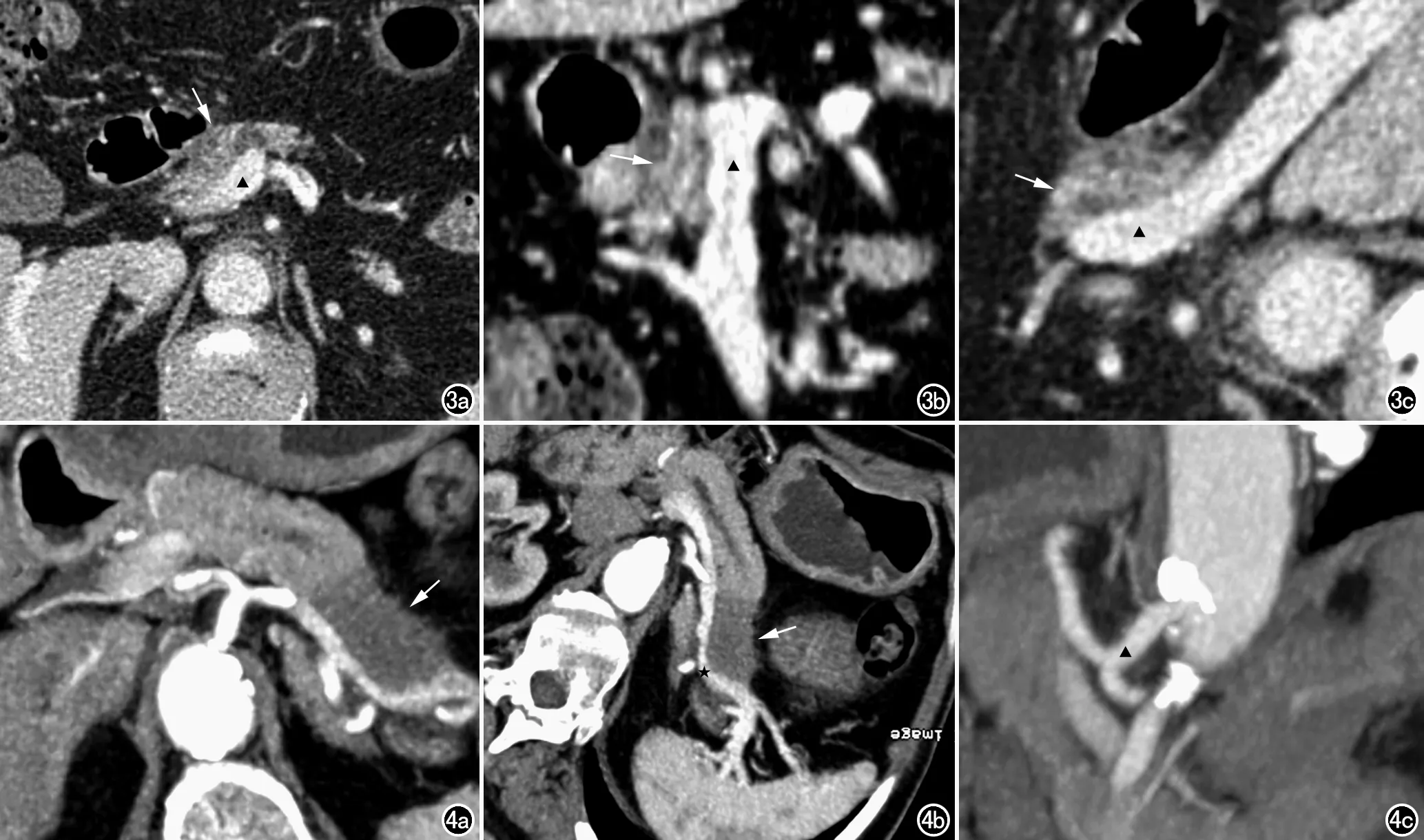
图3 男,57岁,病理证实为胰腺头颈部乳头状腺癌,CT诊断为潜在可切除胰腺癌,根治性切除术后成功行血管重建。a) 增强CT显示胰腺头颈部肿块(箭),与门静脉(▲)脂肪间隙消失; b) 门静脉MPR显示肿块(箭)包绕门静脉(▲)小于180°,靠近肿块局部管壁毛糙; c) 以肿块为中心MPR显示门静脉(▲)尚未累及。图4 男,54岁,病理证实为胰体尾部乳头状腺癌。a) 增强CT显示胰体尾部低密度肿块(箭); b) 以脾静脉为中心CPR显示肿块(箭)包绕脾静脉(★)约180°,管壁毛糙、凹凸不平; c) MPR显示腹腔干(▲)及分支未见肿块累及,属于潜在可切除胰腺癌,手术成功行根治性切除。
不伴有血管侵犯的胰腺肿瘤,尤其是体尾部肿瘤,大部分能得到较好的治疗,在本研究中归为可切除组,CT评估胰腺癌可切除的诊断符合率为97.3%,对肿瘤未累及血管的诊断符合率为100%。本组37例可切除胰腺癌中,1例于术中发现网膜转移结节,回顾该患者的CT资料,发现大网膜区2枚直径2~3 mm粟粒状结节影,因该结节体积太小,无法判断其强化程度,术前CT未能作出网膜转移的诊断。House等[12]学者认为CT评估胰腺癌不可切除的诊断符合率为70%~96%,本研究结果的诊断符合率为91.3%,2例误判者(误诊为不可切除)均为术前CT发现肿瘤包绕肝总动脉和SMA超过180°,然而术中发现,肿瘤包绕段管腔内面光滑,局部管腔未见狭窄,究其原因,Mazzeo等[13]认为由于胰腺癌常继发慢性胰腺炎,故表现为血管受侵的CT征象也可能是胰腺癌继发的慢性胰腺炎及胰腺癌周围纤维组织增生包绕动脉外膜产生的假象。另外,大多数胰腺癌呈浸润性生长且伴周围纤维组织增生,所以在CT图像上很难明确肿瘤边界;有的肿瘤包绕动脉周径超过3/4,可能是血管周围的炎性浸润表现而非肿瘤侵犯所致。
胰腺癌伴血管侵犯曾被列为手术禁忌证,而近来文献报道[2]联合SMV或PV的胰十二指肠切除术并未增加围手术期并发症的发生率及死亡率,联合血管切除并重建可获得和无血管侵犯患者同样的预后;特别是当胰腺癌发生SMV和PV侵犯时,该血管浸润征象并不能提示肿瘤的恶劣生物学行为,而是与肿瘤发生的位置(靠近这些血管)有关[14,15]。Zhou 等[16]比较661 例因静脉受累采用联合血管切除并重建术式的胰腺癌患者及2247 例无血管受累行标准术式患者发现,两者的总体预后差异无统计学意义(P>0.05),因此认为部分不可切除胰腺癌患者可分离到潜在可切除组中。本研究中,CT评价潜在性可切除胰腺癌的诊断符合率为86.8%,低于House等[12]的报道,笔者推测可能与本组将无任何血管侵犯的胰腺癌和伴远处转移及明显血管侵犯的不可切除胰腺癌病例剔除,从而使交界性血管侵犯的病例相对增多有关;也可能与潜在性可切除组相对于可切除组更易发生隐匿性远处转移有关。本组潜在性可切除胰腺癌术后证实误判5例,其中2例伴远处转移,直径均<5 mm,术前CT难以判定为转移癌;另3例低估了血管浸润的程度,其中2例肿瘤包绕SMA未超过管径1/2,但术中发现肿瘤已浸润管壁至管腔内面,无法将肿瘤剥离,术后回顾CT资料发现,该2例肿瘤浸润部分管腔内面欠光滑或管腔略狭窄。据此,笔者认为,评估动脉浸润时,肿瘤包绕部分管壁僵硬、毛糙、呈锯齿状、管腔狭窄应考虑不可切除的可能,当然,本文样本量有限,仍需大样本进一步探讨。
本研究中,CT对胰腺癌可切除组的诊断符合率高(97.3%),其原因可能为大部分可切除胰腺癌在CT上显示为局限于胰腺轮廓内或略凸出于轮廓外,且增强扫描图像上呈相对低密度,从而能较好的与正常胰腺组织及脂肪间隙相区别。本研究结果显示,术前CT对胰周静脉侵犯的诊断效能均高于胰周动脉,笔者分析原因如下:①静脉管壁相对较薄、韧性较差、且静脉血流速度较慢,易出现管壁及管腔改变;②静脉受侵犯时易形成胰周小静脉扩张及侧支循环等间接征象,也利于CT做出诊断;③动脉管壁相对较厚,有弹性, 且动脉血流速度较快,可出现即便肿瘤包绕管径超过180°,也可能未发生管壁侵犯,或肿瘤包绕管径不到一半,却合并管壁侵犯,故CT在判断动脉是否受侵时易出现假阳性和假阴性结果,进而影响诊断符合率。
[1] Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2] Winter JM,Cameron JL,Campbell KA,et al.1423 pancreaticoduodenectomies for pancreatic cancer:a single-institution experience[J].J Gastrointest Surg,2006,10(9):1199- 1211.
[3] Al-Hawary M.Role of imaging in diagnosing and staging pancreatic cancer[J].J Natl Compr Canc Netw,2016,14(suppl 5):678-680.
[4] Noto M,Miwa K,Kitagawa I,et al.Pancreas head carcinoma:frequency of invasion to soft tissue adherent to the superior mesenteric artery[J].Am J Surg Pathol,2005,29(8):1056-1061.
[5] 尚建敏,夏进东,赵年,等.多层螺旋CT血管成像对胰腺癌侵犯胰周血管的表现及可切除性评价[J].放射学实践,2010,25(6):662-665.
[6] 王慧慧,王霄英.胰腺癌患者的糖尿病患病率及影像表现[J].放射学实践,2016,31(2):126-128.
[7] Loyer EM,David CL,Dubrow RA,et al.Vascular involvement in pancreatic adenocarcinoma:reassessment by thinsection CT[J].Abdom Imaging,1996,21(3):202-206.
[8] Freeny PC,MarksWM,Ryan JA,et al.Pancreatic ductal adenocarcinoma:diagnosis and staging with dynamic CT[J].Radiology,1988,166(1 Pt 1):125-133.
[9] Ravikumar R,Sabin C,Abu Hilal M,et al.Portal vein resection in borderline resectable pancreatic cancer:a United Kingdom multicenter study[J].J Am CollSurg,2014,218(3):401-411.
[10] Tempero MA,Arnoletti JP,Behrman SW,et al.Pancreatic Adenocarcinoma,version 2.2012:featured updates to the NCCN Guidelines[J].J Natl ComprCancNetw,2012,10(6):703-713.
[11] Varadhachary GR,Tamm EP,Abbruzzese JL,et al.Borderline respectable pancreatic cancer:definitions,management,and role of preoperative therapy[J].Ann Surg Oncol,2006,13(8):1035-1046.
[12] House MG,Yeo CJ,Cameron JL,et al. Predicting resectability of periampullary cancer with three dimensional computed tomography[J].Gas tlointest Surg,2004,8(3):280-288.
[13] Mazzeo S,Cappelli C,Caramella D,et al.Evaluation of vascular infiltration in resected patients for pancreatic cancer:comparison among multidetector CT,intraoperative findings and histopathology[J].Abdom Imaging,2007,32(6):737-742.
[14] Varadhachary GR,Tamm EP,Abbruzzese JL,et al.Borderline respectable pancreatic cancer:Definitions,management,and role of preoperative therapy[J].Ann Surg Oncol,2006,13(8):1035-1046.
[15] Kelly KJ,Winslow E,Kooby D,et al.Vein involvement during pancreaticoduodenectomy:is there a need for redefinition of borderline resectable disease?[J].J Gastrointest Surg,2013,17(7):1209-1217.
[16] Zhou Y,Zhang Z,Liu Y,et al.Pancreatectomy combined with superior mesenteric vein-portal vein resection for pancreatic cancer:a meta-analysis[J].World J Surg,2012,36(4):884-891.

