32例多系统萎缩患者的头部磁共振及神经电生理特点研究
徐天阳, 刘恒方, 张 敏, 石 磊, 李明磊
多系统萎缩(multiple system atrophy,MSA)是一种成年起病的散发性进行性侵犯锥体系、锥体外系、小脑、自主神经系统的神经变性疾病[1],主要以帕金森综合征为突出表现的MSA-P(multiple system atrophy-parkinsonian)型和以小脑共济失调为突出表现的MSA-C(multiple system atrophy-cerebellar)型。
目前临床对于MSA的诊断主要依靠询问病史及详细的神经系统检查。在疾病早期,MSA-P型常表现间歇性震颤,MSA-C型常表现小脑性共济失调,与帕金森病(PD)、脊髓小脑性共济失调(SCA)等疾病的临床表现有相当多的重叠,极易混淆,头部MRI检查在MSA鉴别诊断中具有重要意义[2]。但在疾病早期,头部MRI的表现常常不典型,神经电生理的检查就显得尤为重要。
目前国内关于MSA的神经电生理检查以及交感神经皮肤反应(Sympathetic skin reaction,SSR)对于MSA患者自主神经功能的研究较少,肛门括约肌肌电图(Perianal sphincter electromyography,EAS-EMG)结果异常往往提示神经源性损害,交感神经皮肤反应结果异常提示自主神经功能损害,对于疾病早期诊断的阳性率较高[3,4],为此研究了32例MSA患者的头部MRI及神经电生理特点,旨在探讨EAS-EMG、SSR在MSA早期诊断中的作用,为临床诊断MSA提供依据和帮助。
1 资料和方法
1.1 一般资料 选择2015年1月-2017年6月于郑州大学第五附属医院门诊及住院治疗的32例MSA患者为研究对象,患者符合2008年修订的Gilman诊断标准[5]。经医院伦理委员会批准,与患者签订知情同意后纳入试验。其中男性26例,女性6例,起病年龄46~70岁,平均52岁,病程1~3 y。就诊年龄47~75岁,平均55岁。其中MSA-P型20例,MSA-C型12例。发病形式均为隐匿起病,缓慢进展。所有患者均无明显家族史,均通过临床表现、病史、影像或电生理排除了后颅窝病变及有关先天性畸形,严重的腰椎疾病及腰骶神经根病变,均无直肠及肛门疾病、盆底手术史、阴道分娩史[6]。
1.2 研究方法 收集患者头部MRI检查结果,MRI的报告由2名影像学主任医师审阅。EAS-EMG、SSR检查采用丹麦维迪公司生产的Keypoint肌电图仪,由2名经验丰富的技师进行操作及记录,保证检查环境安静、光线偏暗,室内温度控制在28 ℃~30 ℃,患者平卧放松,皮肤温度保持在32 ℃~36 ℃。
1.2.1 EAS-EMG检测 取左侧卧截石位,在肛门括约肌皮肤黏膜交界处靠黏膜侧3点钟、9点钟方向垂直于黏膜锐角进针,进针部位距肛门口10 mm,深度为2~5 mm,调整针电极位置直至出现持续性张力性电活动。每例患者收集20个波,记录放松时(嘱患者模仿排便动作)的自发电位,轻微收缩时的运动单位动作电位的时程、波幅,多相波的百分比和有无卫星电位以及出现率。卫星电位出现率定义为:(含有卫星电位的运动单位数/采集的运动单位总数)×100%;记录大力收缩时(嘱患者缩肛)运动单位电位的相型[3]。
1.2.2 SSR检测 常规清洁皮肤,将盘状记录电极分别置于受试者一侧手掌心和足心,参考电极放置于同侧手背和足背处,地线置于腕横纹处,刺激器置于对侧腕部正中神经、内踝后下方胫神经,给予患者无规律连续3次刺激,间隔1 min/次,测量起始潜伏期平均值和波形。
1.3 异常标准 EAS-EMG异常标准:(1)平均时限超过10 ms,伴或不伴卫星电位;(2)多相波增多(>40.0%);(3)MUP的波幅升高(>1000 Uv)。满足至少一项可提示神经源性损害。SSR异常标准:(1)起始潜伏时平均值上肢>1600 ms,下肢>2000 ms;(2)波形缺失。满足至少一项可提示自主神经功能损害。
1.4 统计学分析 采用SPSS 18.0软件进行数据处理,计数资料以率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 MSA亚型的临床表现 MSA-P型及MSA-C型行走不稳、指鼻试验异常、轮替试验异常、运动迟缓、齿轮样肌僵直差异有统计学意义(P<0.05),MSA-C型更多表现为行走不稳、指鼻试验异常、轮替试验异常,MSA-P型更多表现为运动迟缓、齿轮样肌僵直(见表1)。
2.2 MSA亚型异常MRI表现 32例MSA患者中,28例患者存在头部MRI异常。MSA-P型及MSA-C型小脑萎缩、壳核外缘T2WI高信号、十字征MRI异常变现差异有统计学意义(P<0.05),MSA-C型的MRI异常变现主要表现为小脑萎缩、十字征;MSA-P型的MRI异常变现主要表现壳核外缘T2WI高信号(裂隙征)(见表2、图1)。
2.3 神经电生理检查 30例MSA患者完成EAS-EMG检查(MSA-P型19例,MSA-C型11例),28例结果异常。3例出现自发电位,轻收缩MUP平均时限为(13.55±3.21)ms,超过10 ms者22例(78.57%),平均波幅(465.22±218.46)μV,多相波16例(57.14%),13例(46.43%)卫星电位出现率(22.5±14.7)%。22例行大力收缩,5例(22.73%)呈现单纯相。31例MSA患者完成SSR检查(MSA-P型20例,MSA-C型11例),其中27例患者呈自主神经功能损害,起始潜伏时平均值超出正常值者25例(92.59%),波形缺失者2例(7.41%),提示MSA患者存在广泛的自主神经系统受累(见图2)。

表1 MSA两种分型间临床表现比较
MSA-P型与MSA-C型比较*P<0.05
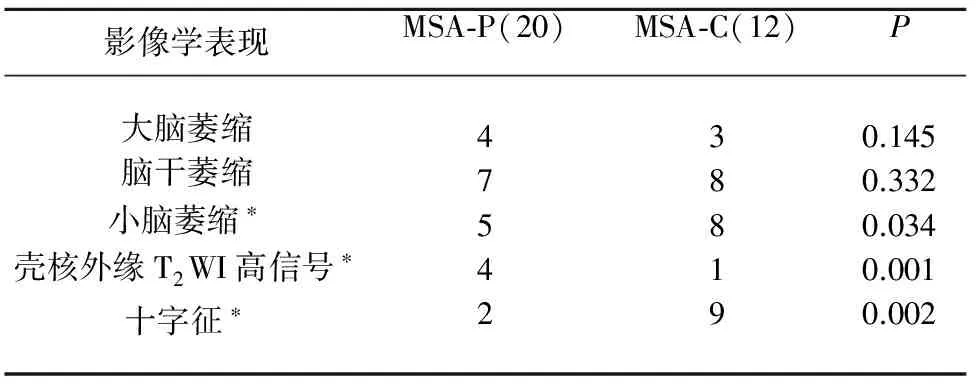
表2 MSA亚型异常MRI表现比较
MSA-P型与MSA-C型比较*P<0.05

图1 MSA亚型异常MRI表现。a:矢状位可见脑桥小脑萎缩(箭头);b:脑桥“十字征”,T2WI可见垂直高信号(箭头);c:“壳核外缘T2WI高信号(裂隙征)”,右侧壳核可见裂隙状高信号(箭头)

图2 神经电生理检查的异常表现。a:EAS-EMG卫星电位;
b:SSR起始潜伏时异常
3 讨 论
MSA是一种成年起病的、散发的、发病原因不明的神经变性疾病,首发症状多为自主神经功能障碍、帕金森综合征、小脑性共济失调或锥体系损害征。MSA患者早期临床表现无特异性,常与帕金森病、脊髓小脑性共济失调等疾病的症状重叠,鉴别诊断以及明确其亚型较为困难。因此早期MSA正确而及时的诊断,对于提高患者的生活质量,降低患者的致残率尤为重要。
常规MRI检查对MSA有很高的阳性预测值及较高的敏感性,MSA患者具有特异性的头部MRI改变[7]。本研究结果显示,MSA-P型及MSA-C型行走不稳、指鼻试验异常、轮替试验异常、运动迟缓、齿轮样肌僵直差异有统计学意义,20例MSA-P型患者中5例患者壳核外缘呈T2WI高信号(裂隙征),与Mahlknecht等[8]研究一致,但本研究中“壳核裂隙征”患者较少,原因可能是患者发病时间相对较短(均小于2 y),壳核的异常改变未能在形态学上有所表现,有待于以后患者的随访以及复查MRI。1990年Savoiardo等首次报道MSA-C型患者头部MRI的T2WI上脑桥有十字形异常高信号影,将“十字征”定为OPCA的特征性改变。在本研究中12例MSA-C型患者9例出现脑桥“十字征”,且伴有不同程度的脑桥、小脑萎缩,符合OPCA的影像学诊断。头部MRI对于MSA的诊断具有无创、有效的特点,能很好地发现病变及部位,对其分型具有重要意义。
在MSA早期,EAS-EMG检查可存在不同程度的异常。王含等[3]研究显示,PD患者骶髓Onuf’s核受累可能存在时间差异性,随着病程的延长,逐渐开始受累,因此EAS-EMG用于病程5 y以内的MSA和PD的鉴别。在本研究中,28例患者的EAS-EMG结果异常,且病程均在5 y以内,主要表现为平均时限延长,波幅增高,多相波比例增多、出现卫星电位,大力收缩时可见募集电位减少,呈现单纯相,与王含等[3]研究一致。本研究样本量较小,可能导致一定的抽样误差,故尚待扩大样本量进一步研究。本研究仅3例患者出现自发电位,可能由于肛门括约肌在正常情况下不易放松,存在运动单位的张力性发放而不易被检测到,且既往有报道[9]研究显示自发电位的出现率极低。自主神经功能障碍是MSA较为突出的表现,但对于其判断多依赖于临床表现,缺乏具体的量化指标,而SSR检查能为其提供具体参考数据。本研究中25例MSA患者双侧上、下肢的SSR起始潜伏时均明显延长,2例存在波形缺失,提示其自主神经系统广泛受累,通常累及双侧,这与既往研究结果相符[10]。本研究中EAS-EMG、SSR检查结果异常的患者其影像学表现也存在特异性的改变,提示神经电生理检查在MSA的诊断中具有可靠的参考依据。
综上,本研究发现电生理检查结果异常通常较影像学改变表现的更早,是MSA临床诊断的一种较为特异的辅助检查手段,结合临床表现、神经影像学检查结果,可大大提高临床医生对MSA的早期诊断率。同时本研究发现当EAS-EMG检查受到限制时,SSR检查可以提供补充诊断及可靠的参考依据。
[1]Graham JG,Oppenheimer DR.Orthostatic hypotension and nicotine sensitivity in a case of multiple system atrophy[J].J Neurol Neurosurg Psychiatry,1969,32:28-34.
[2]Ramli N,Nair SR,Ramli NM,et al.Differentiating multiple system atrophy from Parkinson’s disease[J].Clin Radiol,2015,70(5):555-564.
[3]王 含,崔丽英,杜 华,等.帕金森病、P型多系统萎缩及进行性核上性麻痹的肛门括约肌肌电图及相关自主神经损害特点[J].中华神经科杂志,2011,44(1):52-55.
[4]Maetzler W,Karam M,Berger MF,et al.Time-and frequency-domain parameters of heart rate variability and sympathetic skin response in Parkinson’s disease[J].Journal of Neural Transmission,2015,122(3):419-425.
[5]Gilman S,Wenning GK,Low PA,et al.Second consensus statement on the diagnosis of multiple system atrophy[J].Neurology,2008,71(9):670-676.
[6]赵 蕾,崔丽英,杜 华,等.健康人肛门括约肌肌电图参考值及影响因素[J].中华神经科杂志,2016,49(12):942-946.
[7]郑奎宏,戚晓昆,刘建国,等.壳核背外侧异常信号在鉴别P型多系统萎缩与帕金森病中的诊断价值[J].中国临床医学影像杂志,2017,28(5):305-308.
[8]Mahlknecht P,Hotter A,Hussl A,et al.Significance of MRI in diagnosis and differential diagnosis of Parkinson’s disease[J].Neurodegener Dis,2010,7(5):300-318.
[9]Schwarz J,Kornhuber M,Bischoff C,et al.Electromyography of the extemal anal sphincter in patients with Parkinson’s disease and multiple system atrophy frequency of abnonnal spontaneous acitivity and polyphasic motor unit potentials[J].Muscle Never,1997,20(9):1167.
[10]彭丽君,毛琳玲,毕崇凤,等.多系统萎缩患者交感神经皮肤反应特点分析[J].中华医学杂志,2016,96(33):2620-2624.

