原发性肝脏淋巴瘤的CT、MRI表现及病理分析
1.四川省绵阳市中心医院放射科(四川 绵阳 621000)
2.四川省绵阳市中心医院病理科(四川 绵阳 621000)
管 彬1 钟唐力1 刘启榆1林 华1 何川东1 谢 刚2谢春燕2
原发性肝脏淋巴瘤(primary hepatic lymphoma,PHL)是指淋巴瘤局限在肝脏,而脾脏、淋巴结、骨髓或全身其他淋巴组织无淋巴瘤累及证据[1]。尽管肝脏是晚期非霍奇金淋巴瘤(NHL)病人常见的结外受累部位,但PHL却是一种罕见疾病[2]。由于发病率低,无特异性临床表现、实验室和影像学特点,术前容易误诊。本研究回顾性分析本院收治的8例PHL,探讨其CT及MRI表现,以提高对该病的认识。
1 材料与方法
1.1 研究对象回顾性分析2007年7月至2017年4月我院经手术、CT或超声引导下穿刺后病理证实的PHL 8例,男7例,女1例,年龄44~78岁,平均年龄63岁。主要临床表现为上腹部胀痛或不适,发热、全身乏力等症状,体检发现1例。5例有乙肝病史,但无明显肝硬化征象。实验室检查5例血清乳酸脱氢酶(LDH)升高,而癌胚抗原(CEA)、甲胎蛋白(AFP)、CA199结果阴性。所有纳入病例均为首诊发现,未予放、化疗,且符合Lei定义的PHL的诊断标准[3],发现时无脾、全身其他器官及远处淋巴结浸润,外周血涂片无幼稚细胞。
1.2 检查方法7例行CT检查,5例行MRI检查,其中4例同时进行了CT及MRI检查,全部病例行CT和/或MRI平扫及双期增强检查。
CT检查:采用美国GE16层螺旋CT机(Light Speed 16)和宝石能谱CT(Discovery CT750HD),扫描范围自膈肌顶部至肝脏右下缘,扫描参数:管电压120kV,重建层厚1.25mm、0.625mm。增强扫描对比剂为碘海醇350mgI/ml,剂量3ml/kg,高压注射器经肘静脉注射,注射速率3~4ml/s。
MRI检查:采用GE Signa HDxt 1.5T及西门子3.0T Skyra FREEDOM磁共振行上腹部检查,对比剂为钆喷酸葡胺注射液(Gd-DTPA),注射剂量为0.1mmol/kg,注射速率为2.0~2.5ml/s。
1.3 图像分析所有CT及MRI图像由两位在腹部影像方面有经验的副主任医师共同分析并达成一致。CT图像主要分析病灶的密度改变、强化方式及程度,MR图像主要分析病灶的信号改变以及增强后的强化方式和程度。
2 结 果
2.1 CT及MRI表现肝内单发病灶7例,大小约2.6~12.5cm,位于肝右叶4例,左叶3例;7例CT表现:平扫所有病变均呈低密度,大多数密度均匀,边界清楚,增强扫描动脉期病灶无明显强化,门脉期呈轻度强化。病变形态大多数呈圆形或类圆形,其中1例位于肝左叶内侧段病变呈肝段分布(图1),CT增强后呈轻度强化(图2),误诊为脂肪肝。5例MRI表现:T1WI所有病变均呈低信号,T2WI呈稍高/高信号,DWI呈特征性的高信号(图3),大多数信号均匀,边界清楚,增强扫描动脉期病灶无明显强化,门脉期呈轻~中度强化(图4)。其中1例(最大径约12.8cm)出现明显不规则坏死(图6、图7)。本组病例中有4例显示病灶内可见血管穿行,而血管本身无明显狭窄、包绕等受侵表现(图2、图4、图7)。肝内多发病灶1例,大小约1.2~4.5cm,CT增强后呈轻度强化,误诊为转移瘤(图10)。
2.2 病理结果手术切除1例,CT及超声引导下穿刺活检分别为2例、5例。全部病例均做病理学检查HE染色及免疫组化检测。病理诊断1例为小淋巴细胞性淋巴瘤(属小B类)(图5),7例为弥漫大B细胞型淋巴瘤(图8),免疫组化:CD20(+),CD79a(+),Ki-67(+,>60%~90%)(图9)。
3 讨 论
肝脏淋巴瘤是起源于肝脏淋巴组织和残留造血组织的罕见恶性肿瘤[4],分原发性和继发性两种类型,以继发性淋巴瘤比较常见,为恶性淋巴瘤晚期累及肝脏所致,而PHL相对少见。PHL是一种罕见的疾病,其发病率仅占肝恶性肿瘤的0.1%,占结外淋巴瘤的0.4%,以中老年男性常见,本组病例中7例为男性,仅1例为女性,平均年龄63岁,与文献报道一致[5]。主要临床表现为上腹部胀痛或不适,发热、全身乏力等症状,本组1例为体检发现,无任何临床症状及体征。
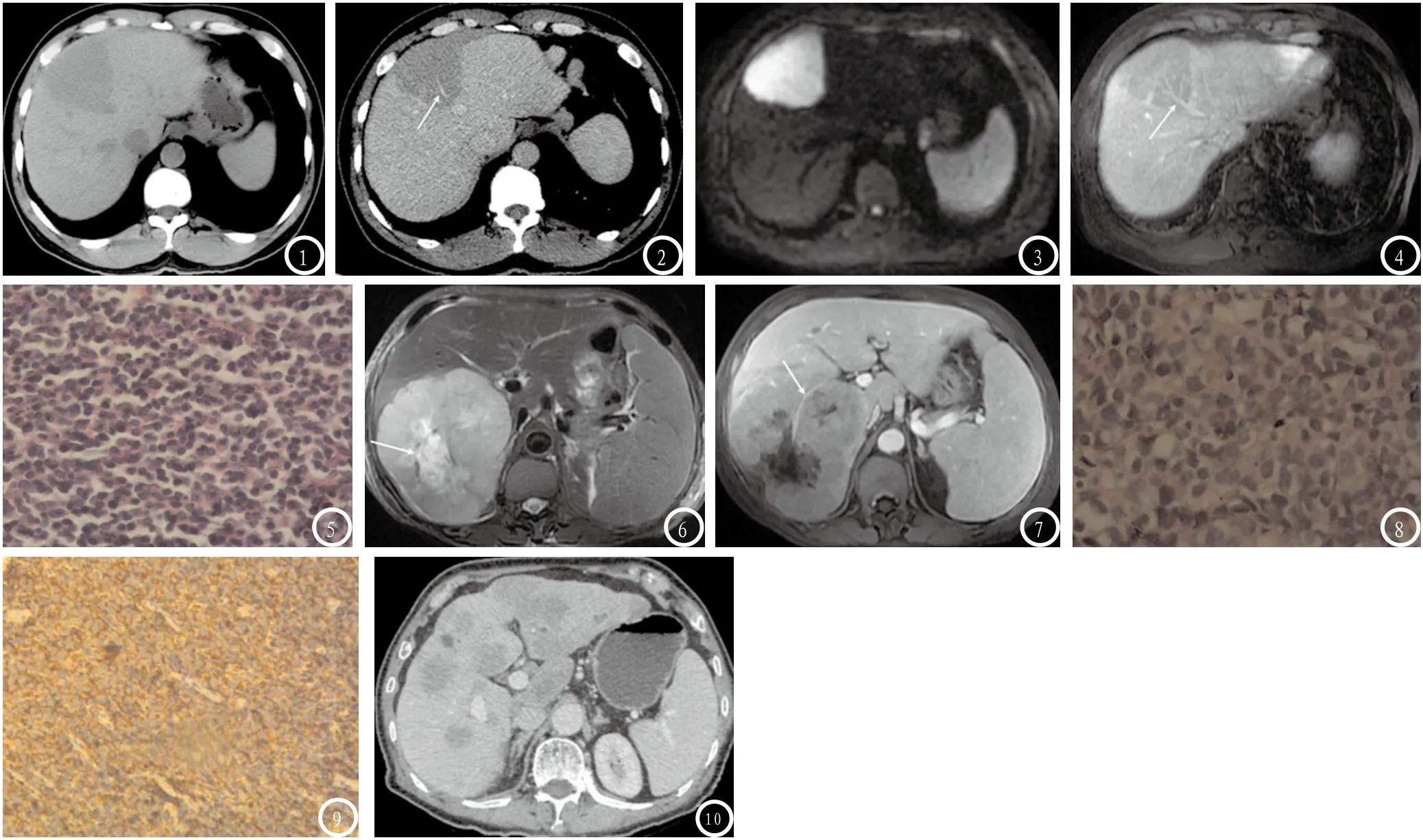
图1-5 小淋巴细胞性淋巴瘤病例。图1 CT平扫示肝左叶内侧段低密度病变,呈肝段分布,边界清楚。图2 增强CT门脉期示肝左叶内侧段病变呈轻度强化,其内可见血管穿过,而血管本身无明显狭窄、包绕等受侵表现。图3 MRIDWI示肝左叶内侧段病变呈明显高信号。图4 增强MRI门脉期示肝左叶内侧段病变呈轻度强化,其内可见血管穿过(箭头示),而血管本身无明显狭窄、包绕等受侵表现。图5 病理HE染色示小淋巴细胞性淋巴瘤。图6-9 弥漫大B细胞型淋巴瘤病例。图6 T2WI示肝右叶巨大肿块呈高信号,其内不规则坏死区呈更高信号(箭头示)。图7 增强MRI门脉期示肝右叶肿块呈轻~中度强化,其内可见血管穿过(箭头示),而血管本身无明显狭窄、包绕等受侵表现。图8 病理HE染色示弥漫大B细胞型淋巴瘤。图9 弥漫大B细胞型淋巴瘤病例的病理免疫组化CD20(+)图。图10 多发结节型弥漫大B细胞型淋巴瘤。增强CT门脉期示肝内多发结节,呈轻度强化。
PHL的病因和发病机制尚不清楚。文献报道,乙肝或丙肝肝炎病毒感染、EB病毒(EBV)及人类免疫缺陷病毒(HIV)感染、器官移植、免疫抑制治疗或后天性免疫缺陷等因素可能在PHL的发生、发展中起重要作用[6],以乙肝肝炎病毒感染最多见[7]。本组病例中有5例有乙肝病史。另有文献[8]认为乳酸脱氢酶是诊断PHL并判断其预后的敏感指标,本组病例中有5例出现血清乳酸脱氢酶(LDH)升高,其中1例明显升高者综合治疗后复查降至正常,与文献报道一致。
PHL分为单发型、多发型及弥漫型,以单发孤立病灶多见,多发病灶相对少见,弥漫型更为罕见[9]。本组病例中7例为单发,仅1例为多发,病变无特殊好发肝叶、肝段。单发较大者可呈分叶状,中心可出现坏死区,本组1例病变最大径约12.8cm,其内可见不规则条片状坏死区。CT表现:平扫所有病变均呈低密度,大多数密度均匀,边界较清,增强扫描动脉期病灶无明显强化,门脉期呈轻度强化,这与文献报道一致[10-11]。本组有1例病变位于肝左叶内侧段呈肝段分布,CT增强后亦呈轻度强化,病灶内可见血管穿行,而血管本身无明显狭窄、包绕等受侵表现。由于脂肪肝好发部位亦为肝左叶内侧段,导致CT上易误诊为脂肪肝[12]。本例进行了MRI检查,同反相位及DWI特征性的高信号否定了脂肪肝的诊断。MRI表现:T1WI所有病变均呈低信号,T2WI呈稍高/高信号。DWI呈特征性的高信号[13],这是由于病理上淋巴瘤细胞排列致密,核浆比高,核异型性显著,导致水分子扩散运动明显受限,因而病变在DWI上呈明显高信号,这也有助于疗效监测和其它疾病的鉴别诊断。
本组CT及MRI增强扫描所有病例均呈轻度强化,表明PHL为一种乏血供肿瘤。本组有4例显示病灶内可见血管穿行,而血管本身无明显狭窄、包绕等受侵表现。有学者[14]将这种表现称为“血管漂浮征”,可能原因是结外淋巴瘤起源于脏器的间质,肿瘤跨越或沿脏器解剖结构生长,因而肿瘤内原有解剖结构残留。笔者认为这些表现虽不常见,却比较有特征性,有助于PHL的诊断。
本组病例中出现多发病灶1例,CT增强后呈轻度强化,误诊为转移瘤,但该病例临床未发现原发肿瘤病变。因此,对于CT及MRI图像疑似肝转移性肿瘤,但无原发肿瘤存在时,应考虑PHL可能性。
文献报道,在PHL的病理分型中,以弥漫大B细胞型淋巴瘤为多见,本组8个病例中,1例为小淋巴细胞性淋巴瘤,余7例均为弥漫大B细胞型淋巴瘤,这与文献报道一致[15]。本组病例中未见其它病理分型,这可能与发病率低、样本量太小有关,以后需进一步扩大样本量进行相关研究。
主要鉴别诊断:①原发性肝细胞癌(HCC):HCC属富血供肿瘤,AFP常升高,增强动脉期呈明显强化,门脉期快速廓清,常伴有门静脉癌栓。而PHL属乏血供肿瘤,多表现为轻度强化,无包膜,病灶内可见血管穿行,但无侵犯、中断和破坏改变。②胆管细胞癌:肝左叶多见,常伴有邻近肝脏的萎缩,肝内胆管扩张,动态增强扫描有助于鉴别诊断,增强早期病灶通常无明显强化,病灶中心可有延迟强化,这有别于PHL。③局灶性结节增生(FNH):FNH为肝脏少见的良性肿瘤样病变,典型的FNH在T2WI像呈略高或等信号,中心瘢痕呈明显高信号,增强早期FNH病灶明显强化,中心瘢痕无明显强化,增强中晚期大多数病灶为高或略高信号,边界显示不清,此时中心瘢痕可逐渐强化。FNH的中心瘢痕及强化方式很有特点,有助于鉴别。④上皮样血管内皮瘤:增强扫描二者都无明显强化,但上皮样血管内皮瘤可出现轻度边缘强化或周边环形强化,以门脉期强化更明显,部分病灶显示晕征,且病变多位于肝脏表面近包膜下,邻近包膜可出现包膜回缩征。⑤转移瘤[16]:需要和PHL表现为多发型病变时鉴别,转移瘤常有原发肿瘤病史,典型表现为“靶征”或“牛眼征”,增强后呈厚壁环形强化。
总之,PHL是肝脏的一种罕见病变,CT及MR表现为乏血供肿瘤,增强扫描病灶内有血管穿过而血管本身无明显受具有一定特征。当患者有发热、全身乏力等症状,实验室检查LDH升高,AFP、CEA及白细胞不高时,要高度怀疑PHL,但确诊需要组织病理学检查。
[1]Mastoraki A,Stefanou MI,Chatzoglou E,et a1.Primary hepatic lymphoma:dilemmas in diagnostic approach and therapeutic management[J].Indian J Hematol Blood Transfus,2014,30(3):150-154.
[2]杨波.原发性肝脏淋巴瘤研究进展[J].国外医学·老年医学分册,2007,28(1):32-37.
[3]Lei KI,Chow JH,Johnson PJ.Aggressive primary hepatic lymphoma in Chinese patients[J].Cancer,1995,76(8):1336-1343.
[4]Swerdlow sH,Campo E,Harris,et a1.World Health Organization classification of tumors of haematopoietic and lymphoid tissues[J].Lyon:IARC,2008,14-22.
[5]赵翠翠,王华庆,钱正子,等.原发性肝淋巴瘤的临床特点及治疗[J].中华肝胆外科杂志,2013,19(2):112-115.
[6]Mossad SB,Tomford JW,Avery RK,et al.Isolated primary hepatic lymphoma in a patient with acquired immunodeficiency syndrome[J].Int J Infect Dis,2000,4(1):57-58.
[7]Bronowicki JP,Bineau C,Feugier P,et a1.Primary lymphoma of the liver:clinicalpathological features and relationship with HCV infection in French patients[J].Hepatology,2003,37(4):781-787.
[8]Page RD,Romaguera JE,Osborne B,et a1.Primary hepatic lymphoma:favorable outcome after combination chemotherapy[J].Cancer,2001,92(8):2023-2029.
[9]张晖,丁红,黄备建,等.原发性肝淋巴瘤的超声表现与临床病理分型[J].中华超声影像学杂志,2012,21(12):1040-1042.
[10]李章宇,何剑,祝跃明,等.原发性肝脏淋巴瘤的CT表现[J].医学影像学杂志,2014,24(10):1762-1764.
[11]明兵,何瑜,贺国庆,等.肝淋巴瘤的CT诊断价值[J].中国CT和MRI杂志,2008,6(6):45-47.
[12]Panlson E X,Baker M E,spritzer C K,et al.Focal fatty inltraction:Acause of nontumorus defects in the left hepatic lobe chrins CT arterial portography[J].J Comput Assist Tomogr,1993,17:590.
[13]谢辉,安维民,孙艳玲,等.肝原发性淋巴瘤MRI表现及鉴别诊断[J].中国医学影像学杂志,2011,19(7):518-519.
[14]Apicella PL,Mirowitz SA,Weinreb JC.Extension of vessels through hepatic neoplasms:MR and CT findings[J].Radiology,1994,19(1):135-136.
[15]Dhamija E,Madhusudhan KS,Shalimar,et a1.Primary hepatic diffuse large B-cell lymphoma:unusual presentation and imaging features[J].Curr Probl Diagn Radiol,2015,44(3):290-293.
[16]许淑桂,陈韵彬.肝脏不典型转移瘤CT及MRI的诊断与鉴别诊断[J].中国CT和MRI杂志,2013,11(3)11-13.

