空心莲子草浸提液对苜蓿、菊苣和燕麦的潜在化感效应
殷 洁,隋宗明,魏立本,黄建国(西南大学资源环境学院,重庆 北碚 400716)
空心莲子草(Alternantheraphiloxeroides)属苋科多年生草本植物,水陆两栖,生长迅速,是全球公认的、难以根除的恶性杂草[1-2],遍及我国20多个省(市)的陆地和水域,造成了巨大的生态灾难和经济损失[3-5]。
空心莲子草能释放多种化感物质,干扰周边植物新陈代谢,降低光合色素含量,改变保护性氧化物酶活性,破坏细胞膜结构,妨碍有丝分裂和DNA复制修复[6-7],抑制莴苣(Lactucasativa)、小麦(Triticumaestivum)、油菜(Brassicanapus)、生菜(L.sativavar.ramosa)、萝卜(Raphanussativus)、蚕豆(Viciafaba)、玉米(Zeamays)和三叶草(Trifolium)等植物的种子萌发和植株生长[8-11]。溶液培养120~180 d的空心莲子草,吸收钾的米氏常数(Km)值仅8.0~14.0 μmol·L-1,Cmin<0.2 μmol·L-1,能利用低浓度的外源养分[12];在重金属污染的水体和土壤上,空心莲子草大多能正常生长,并富集Zn2+、Mn2+、Pb2+、Cu2+、Cd2+、Cr3+等金属离子[13-14]。因此。空心莲子草既抑制其他植物生长,又具有极强适应能力,大范围地形成单优种群。目前,空心莲子草大规模侵入我国南方草地,多种化学除草剂均难以将其彻底杀灭[15],残存的根系仍能再生繁殖,继续扩展自己的种群优势。为了明确空心莲子草对牧草的化感作用,了解其入侵草地的机制,为有效防除空心莲子草和选种牧草奠定科学基础,试验以豆科紫花苜蓿(Medicagosativa)、菊科菊苣(Cichoriumintybus)、禾本科燕麦(Avenasativa)3种生物学特性差异较大,且与空心莲子草生长同季的牧草为材料,采用培养和盆栽试验,研究空心莲子草地上部和根系浸提液对3种牧草种子萌发和幼苗生长的化感效应,为空心莲子草多发地区选种较不敏感的草种提供理论参考。
1 材料与方法
1.1 供试材料
牧草品种:“赛特”紫花苜蓿、“奥利维亚”菊苣、“白燕8号”燕麦,均采购于重庆市北碚区种子公司。空心莲子草为多年生(茎和叶取当年新长部分),采集于重庆市北碚区西南大学的农场草地(106°25′ E;29°49′ N)。
供试土壤:取西南大学农场草地上空心莲子草常年生长土壤,属灰棕紫泥土,肥力中等,质地中壤,pH 6.3,有机质含量为17.07 g·kg-1,全氮、磷、钾含量依次为0.730、0.312和14.80 g·kg-1,碱解氮、有效磷、速效钾含量分别为68.60、23.49和108.47 mg·kg-1。
1.2 试验方法
1.2.1空心莲子草浸提液的制备 考虑到空心莲子草分泌的化感物质种类繁多,非单一物质产生化感作用,故本研究利用提取空心莲子草浸提液研究其化感效应。采集新鲜空心莲子草植株,分地上部和根系,洗净,分别置于去离子水中浸提48 h[根系(和地上部)∶去离子水=1∶2(w/w),(25±2) ℃,光强15 000 lx,昼夜交替12 h],补充水分至原体积,抽滤,制备出质量浓度为0.5 g·mL-1的地上部浸提液(extract ofA.philoxeroidesstems and leaves,ESA)和根系浸提液(extract ofA.philoxeroidesroots,ERA)。试验时用去离子水将母液稀释成0.125、0.25、0.5 g·mL-1共3种浓度,对照为去离子水。
1.2.2空心莲子草浸提液对种子萌发影响的试验 用1% H2O2消毒牧草种子1 min,洗净,分别用不同浓度的ESA和ERA浸种[12 h,(25±1) ℃]。取40粒(苜蓿、菊苣)或30粒(燕麦)种子,均匀摆放于垫有3层滤纸的培养皿中(直径10 cm),加5 mL相应浓度的ESA或ERA,置于培养箱中发芽[(25±1) ℃,12 h光暗周期,光照强度10 000 lx],考虑到在培养期间由于水分的蒸腾作用,ESA和ERA浓度会发生改变,故在发芽期间补充去离子水至原体积,每处理重复5次。
以胚根长度达到1 mm为发芽标准,每隔24 h统计一次发芽种子数,连续2 d发芽数无增长则视为发芽完全,计算种子发芽率、发芽指数(germination index,GI)和活力指数[16-17]:
发芽率=(发芽的种子总数/供试种子总数)×100%;
GI=∑Gt/Dt。
式中:Dt为发芽天数,Gt为在Dt日的发芽数。
活力指数= GI×S。
式中:GI为发芽指数,S为单株幼苗鲜重(g)。
为了解种子萌发过程中贮藏物的变化,将牧草种子浸泡于不同浓度的ESA和ERA中至露白[苜蓿12 h、菊苣36 h、燕麦72 h,(25±1 )℃],分别用蒽酮比色法、水合茚三酮比色法和钼锑抗比色法测定种子可溶性糖、游离氨基酸和水溶性无机磷含量[18];并用电导率法测定电导率,计算细胞膜损伤率[19]:
细胞膜损伤率=(浸泡电导率-对照电导率)/(煮沸电导率-对照电导率)×100%。
1.2.3空心莲子草浸提液对幼苗生长影响的试验 盆栽试验在西南大学试验温室进行。采集空心莲子草常年生长土壤为供试土壤,拣除杂物,风干,过5 mm筛。用塑料盆(∅135 mm×150 mm)进行盆栽试验,每盆装土1.00 kg,拌入1.00 g尿素、2.00 g过磷酸钙和0.50 g硫酸钾,分别播种20(燕麦)和50粒(苜蓿、菊苣)牧草种子,当幼苗长至两叶一心时(10 d),浇灌42 mL浓度为0、0.125、0.25、0.5 g·mL-1的 ESA和ERA,分3次浇灌,分别在10、20、30 d时,每次浇灌14 mL,对照为清水。随机区组排列,重复5次,培养30 d,培养期间按一般盆栽试验方法管理。
培养结束后,测定根长、苗高、生物量和根冠比。用TTC法、磺胺-萘胺比色法和乙醇-丙酮提取分光光度法分别测定根系活力、叶片硝酸还原酶活性和叶绿素含量[19]。将幼苗置于105 ℃杀青,60 ℃烘干,经硫酸-过氧化氢消化,依次用凯氏定氮法、钼蓝比色法和火焰光度计法分别测定消化液中的氮、磷、钾含量[20]。
1.2.4化感敏感指数和化感综合效应计算 根据Williamson和Richardson的方法,计算化感作用敏感指数(response index,RI)和化感综合效应(allelopathic synthesis effects,ASE)[21]:当 T≥C时,RI=1-C/T;当T
在相同处理中,ASE(种子萌发)为种子发芽率、发芽指数和活力指数等敏感指数RI的算术平均值,ASE(幼苗生长)为苗高、生物量、根长RI的算术平均值。
1.3 数据处理
用Excel 2013和SPSS 18.0软件进行基本计算和统计分析,用平均值和标准误表示测定结果,不同浓度空心莲子草浸提液处理进行单因素方差分析,并用Duncan法对各测定数据进行多重比较,显著水平设置为P< 0.05;采用Excel 2010制图。
2 结果与分析
2.1 ESA和ERA对种子萌发的影响
2.1.1种子发芽 ESA和ERA明显抑制牧草种子发芽,降低发芽率、发芽指数和活力指数,浸种浓度越高,降幅愈大;ERA的抑制作用明显大于ESA(表1)。与对照相比,用0.5 g·mL-1ESA浸种,3种牧草发芽率、发芽指数和活力指数均分别显著降低了44.91%~91.30%、55.67%~90.97%和79.68%~96.34%(P<0.05);用0.5 g·mL-1ERA浸种,发芽率、发芽指数和活力指数均显著降低了74.58%~95.66%、91.51%~96.15和95.72%~98.63%。此外,燕麦种子发芽受到的抑制作用最强,菊苣次之,苜蓿最小。
2.1.2萌动种子贮藏物 与发芽参数类似,ESA和ERA降低萌动种子游离氨基酸、水溶性无机磷和可溶性糖含量,浸种浓度越高,降幅愈大;ERA的抑制作用显著大于ESA(表2)。用0.5 g·mL-1ESA浸种,牧草种子游离氨基酸、水溶性无机磷和可溶性糖含量较对照分别降低21.29%~47.13%、9.40%~22.81%和18.71%~44.26%;用ERA浸种,其最大降幅依次为32.55%~53.23%(游离氨基酸)、11.29%~28.90%(水溶性无机磷)和28.06%~48.04%(可溶性糖)。
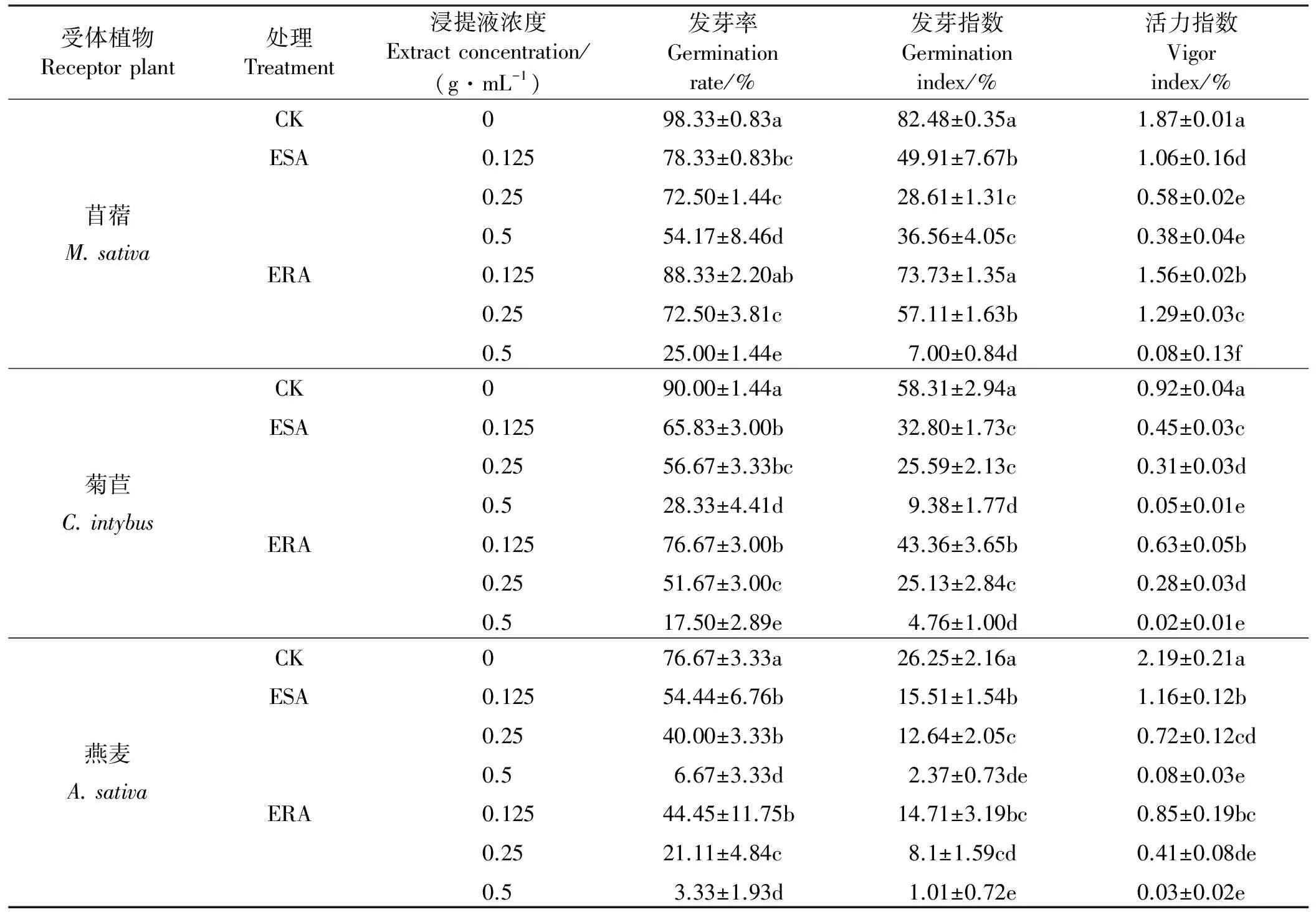
表1 空心莲子草浸提液对3种受体牧草种子发芽率、发芽指数和活力指数的影响Table 1 Effect of extract liquid of A. philoxeroides germination rate, index, and vital index of different receptor plant
同列不同小写字母表示同一供试牧草不同处理间差异显著(P<0.05)。ESA表示空心莲子草地上部浸提液,ERA表示空心莲子草根系浸提液;下同。
Different lowercase letters within the same column for the same receptor plant indicate significant difference among different treatments at the 0.05 level. ESA,extract ofA.philoxeroidesstems and leaves; ERA, extract ofA.philoxeroidesroots; similarly for the following tables.
2.1.3种子细胞膜损伤率 对比清水对照处理,ESA和ERA浸种对牧草种子细胞膜有损伤,随浸种浓度升高,3种牧草种子细胞膜的损伤率增大(图1),分别增加了1.11%~7.23%(苜蓿)、5.02%~12.50%(菊苣)和4.09%~8.87%(燕麦)。其中,苜蓿和菊苣ESR和ERA处理间均无显著差异(P>0.05),但ERA处理燕麦细胞膜损伤率大于ESA处理。
2.2 ESA和ERA对幼苗生长和生理指标的影响
2.2.1幼苗生长 ESA和ERA处理降低牧草苗高、根长、生物量和根冠比,且浓度越高降幅越大(表3)。用0.5 g·mL-1ERA浇灌幼苗,牧草苗高、根长、生长量和根冠比较对照分别降低了37.69%~50.28%、38.08%~58.73%、45.35%~63.74%和41.18%~68.42%;用0.5 g·mL-1ESA浇灌幼苗,牧草苗高、根长、生长量和根冠比分别较对照降低了12.03%~36.21%,24.52%~49.26%,37.33%~52.27%和39.22%~63.16%。此外,在相同浓度的ESA和ERA处理之间,用ERA浇灌后的牧草幼苗,其苗高、根长、生物量的降幅普遍高于ESA处理,根冠比无显著差异(菊苣除外)。
2.2.2幼苗氮、磷、钾含量 用ESA和ERA浇灌牧草幼苗后,植株氮、磷、钾含量均受影响(表4)。ESA对牧草幼苗含氮量无显著影响(P>0.05);但用ERA灌根,牧草幼苗含氮量降低,尤以高浓度(0.5 g·mL-1)最为显著(P<0.05),其降幅可达22.73%(苜蓿)、29.47%(菊苣)和37.02%(燕麦)。ESA和ERA均降低牧草幼苗含磷量,浓度越高降幅愈大,其降幅分别为21.31%~48.72%(ESA)和34.43%~47.37%(ERA)。与含磷量相似,随ESA和ERA浓度提高,牧草幼苗含钾量降低,其降幅分别为6.15%~12.14%(ESA)和8.03%~29.22%(ERA)。此外,用ERA灌根,3种牧草氮、磷、钾含量的降幅均大于ESA。

表2 空心莲子草浸提液对3种受体牧草萌动种子贮藏物含量的影响Table 2 Effect of extract liquid of A. philoxeroides on storage contents in germinated seeds of different receptor plant

图1 空心莲子草浸提液对3种受体牧草种子细胞膜的损伤率的影响Fig. 1 Effect of extract liquid of A. philoxeroides on rate of cell membrane damage of different receptor plant seeds
同一牧草不同字母表示不同空心莲子草浸提液浓度间差异显著(P<0.05)。下图同。
Different lowercase letters for the same receptor plant indicate signifficant difference among different concentration of extractA.phitoreroidesat the 0.05 level. similarly for Fig. 2.
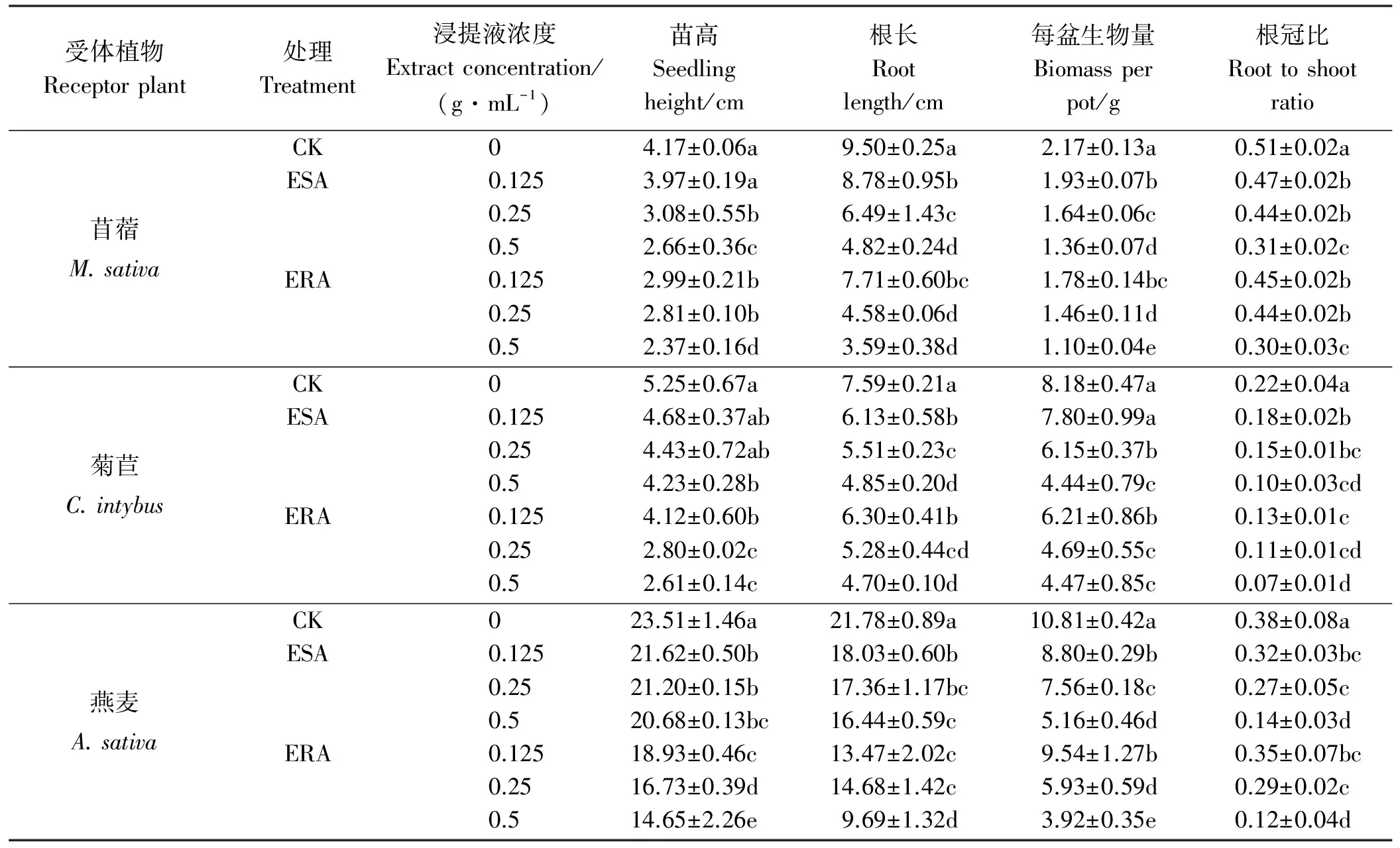
表3 空心莲子草浸提液对3种受体牧草幼苗生长的影响Table 3 Effects of A. philoxeroides extracts on the seedling growth of different receptor plant
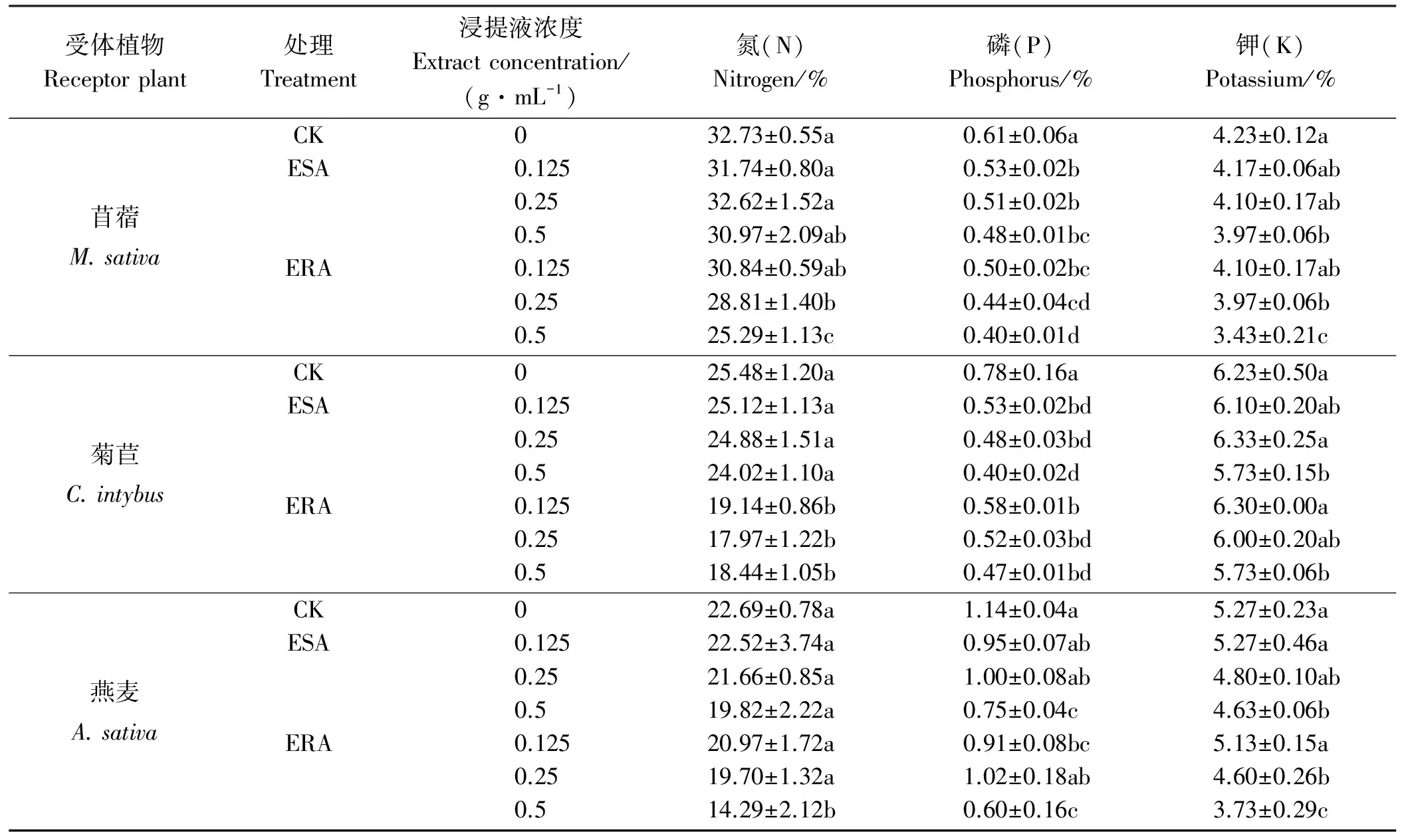
表4 空心莲子草浸提液灌根后3种受体牧草幼苗的氮、磷、钾含量Table 4 Levels of nitrogen, phosphorus, and potassium in different receptor plant seedlings irrigated with A. philoxeroides extract
2.2.3叶绿素、硝酸还原酶和根系活力 ESA和ERA均不同程度地降低了植株叶绿素含量、硝酸还原酶活性和根系活力,总体上也表现出浓度越高降幅越大的趋势(图2)。用ESA浇灌幼苗,叶绿素、硝酸还原酶和根系活力分别较对照降低了29.76%~54.17%、17.42%~55.63%和19.19%~60.91%;用ERA浇灌幼苗,分别较对照降低了39.88%~65.63%(叶绿素)、55.13%~61.50%(硝酸还原酶活性)和37.67%~80.00%(根系活力)。
2.3 ESA和ERA的化感效应
ESA和ERA对牧草种子萌发和幼苗生长的化感敏感指数(RI)和化感综合效应(ASE)均为负值,随ESA和ERA浓度增加,RI和ASE的绝对值增大;IR和ASE的绝对值均表现为ESA
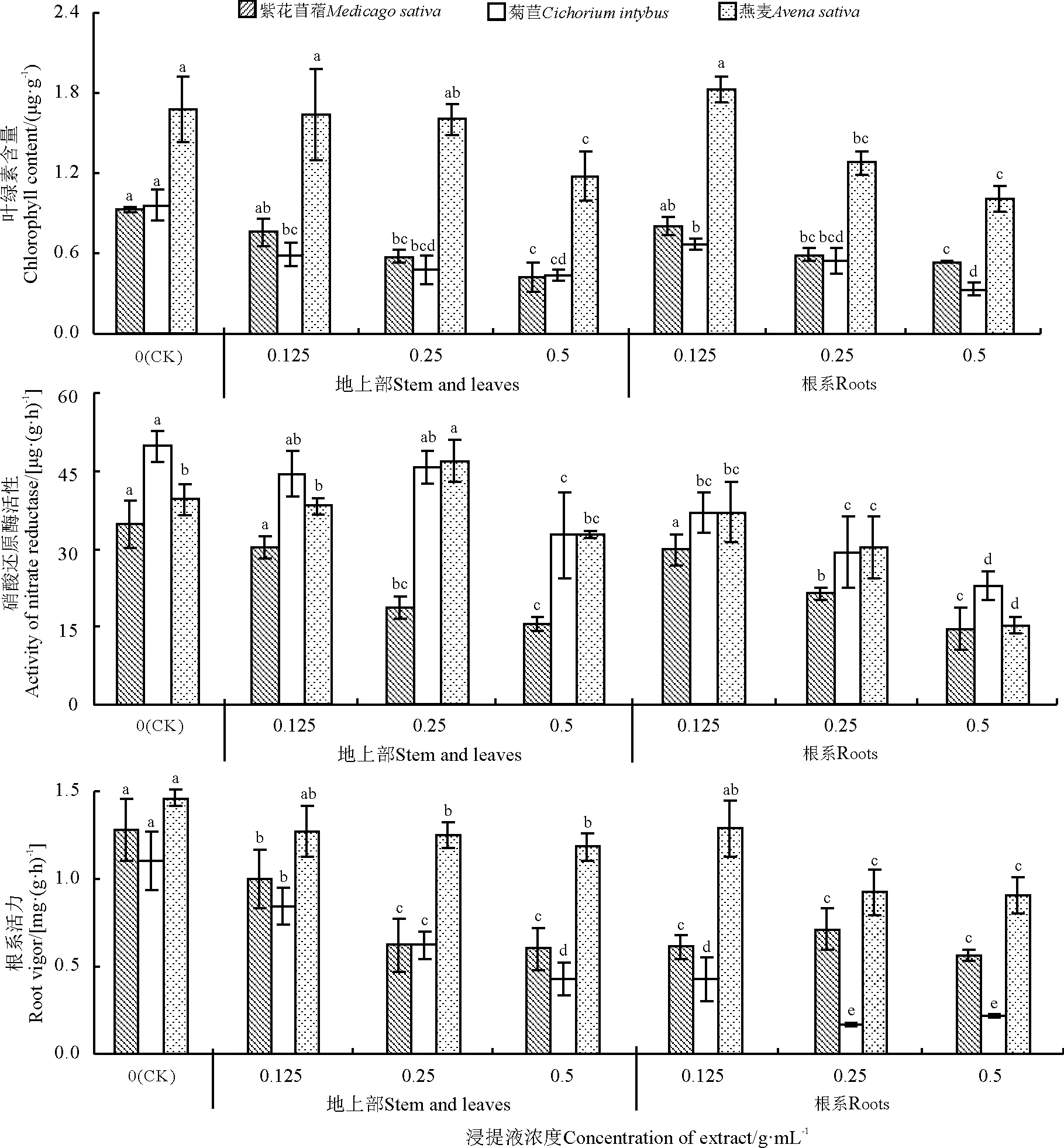
图2 空心莲子草浸提液灌根后牧草幼苗的叶绿素含量、硝酸还原酶活性和根系活力Fig. 2 Chlorophyll content, nitrate reductase activity, and root vigour of different receptor plant seedlings irrigated with A. philoxeroides extract
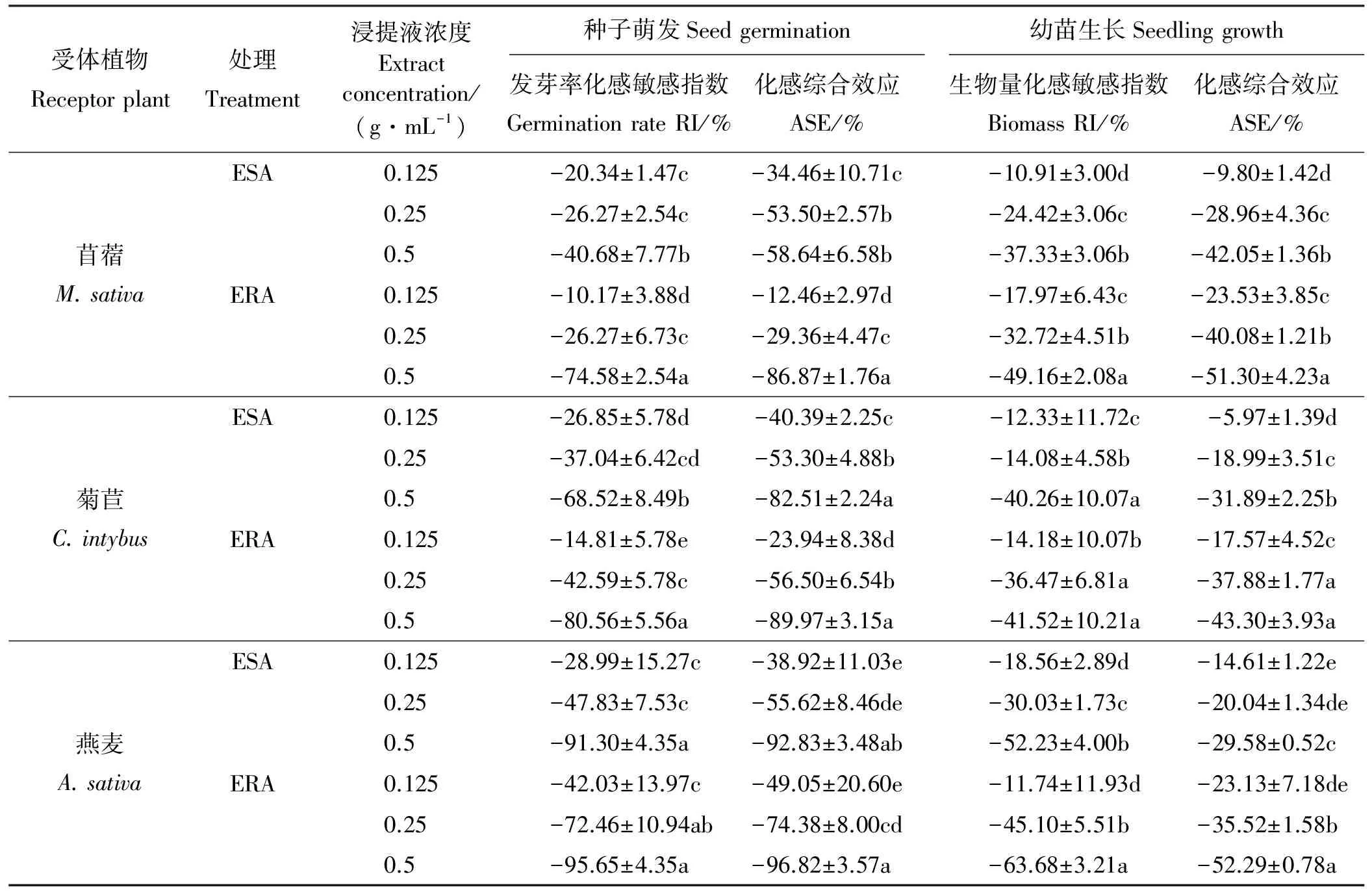
表5 空心莲子草浸提液对3种受体牧草的化感效应Table 5 Comprehensive allelopathic effect of A. philoxeroides extract on receptor plant
3 讨论与结论
空心莲子草是我国10种危害最严重的入侵植物之一。据报道,菊科、禾本科、十字花科、豆科、忍冬科、马鞭草科和胡颓子科的植物能释放化感物质,抑制其他植物生长,从而扩大自己的生态优势和生存空间[22]。与之类似,空心莲子草也对其他植物具有化感作用。研究发现,用ESA和ERA浸种,对牧草种子发芽和幼苗生长的化感综合效应均为负值, ESA和ERA抑制牧草生长,类似空心莲子草对多种农作物的影响[8-11],说明空心莲子草内含抑制牧草种子发芽和幼苗生长的化感物质,但其成分和作用大小还有待研究。此外,随ESA和ERA浓度增加,化感综合效应的绝对值增大,ERA大于ESA。一般植物产生的化感物质愈多,其化感作用也越强,说明空心莲子草根系化感作用强于地上部,根系中的化感物质含量较高。目前,多种化学除草剂均难于彻底杀灭空心莲子草根系[15]。在化学防除空心莲子草的过程中,尽管地上部已经死亡,但残存的根系仍能继续抑制周围植物(包括牧草)的生长繁殖。因此,在自然生长环境中,其根系可能持续产生较强的化感作用可能是化学除草剂效果欠佳的重要原因之一。本研究中,不同浓度空心莲子草浸提液处理的3种牧草化感综合效应均表现出ESA 据报道,化感物质对植物的危害是多方面的,包括破坏细胞膜、抑制光合作用、改变酶结构、损伤染色体、影响有丝分裂等[23-25]。在种子萌发过程中,胚乳中的淀粉、蛋白质和肌醇磷酸盐等大分子物质分别在淀粉酶、蛋白酶和植素磷酸酶的催化作用下,水解成单糖、氨基酸和水溶性无机磷,用于构建新的植物体[26]。研究发现,用ESA和ERA浸种降低了萌动种子的游离氨基酸、可溶性糖和水溶性无机磷含量,说明空心莲子草浸提液中的化感物质抑制了胚乳大分子物质水解,供幼苗利用的氨基酸、单糖和无机磷减少,从而抑制种子萌发,降低发芽率、发芽指数和活性指数[27]。此外,ESA和ERA还提高牧草种子细胞膜损伤率,类似芳香环类、酚类、醛类和有机酸类等化感物质[28-29],说明空心莲子草浸提液中化感物质破坏了种子细胞膜。细胞膜是细胞最重要的屏障,与物质转运、信号转导、能量转化、物质代谢等有密切关系[30],细胞膜损伤导致胞内物质外渗,代谢紊乱直至死亡。 氮、磷、钾是“植物营养三要素”,具有构建植物体、参与新陈代谢、提高抗逆性等多种生理生化功能[31]。在本研究中,用ESA和ERA浇灌牧草幼苗,植株氮、磷、钾含量降低,且浇灌浓度越高,降幅越大,说明空心莲子草体内的化感物质抑制苜蓿、菊苣和燕麦幼苗吸收养分,类似紫茎泽兰(Ageratinaadenophora)、乌头(Aconitumcarmichaeli)和黄连(Coptischinensis)提取液[32-34]。在自然条件下,空心莲子草抑制其他植物吸收养分的作用有益于其争夺土壤养分,保证自身需要,同时造成周围植物营养不良,生长不佳。在植物体内,硝酸还原酶催化氮素同化的原初反应——硝酸盐还原,是植物利用氮素营养的关键酶之一[35];根系活力是根系内多种呼吸酶活性的综合体现,与养分吸收密切相关[36]。因此,ESA和ERA不同程度地抑制根系活力和硝酸还原酶活性可能是牧草幼苗氮、磷、钾含量降低的直接原因。据报道,黄花蒿(Artemisiaannua)、紫茎泽兰和牵牛花(Ipomoeanil)等植物的提取液也有类似作用[32,37-38]。此外,在光合作用中,叶绿素参与光能的吸收与转化,对光合速率的影响甚大[39]。在空心莲子草生长过程中,所释放的化感物质降低牧草叶绿素含量,减少干物质积累,抑制牧草生长。 空心莲子草浸提液对紫花苜蓿、菊苣及燕麦的种子萌发和幼苗生长均表现出化感抑制作用;其根系浸提液的化感效应大于地上部浸提液;燕麦种子萌发和幼苗生长受到的抑制程度大于苜蓿和菊苣。因此,在空心莲子草入侵地区的牧草栽培中,选种较不敏感的菊苣和苜蓿有益于减轻危害和减少损失。 References: [1] Longstreth D J,Bolanos J A,Smith J E.Salinity effects on photosynthesis and growth inAlternantheraphiloxeroidesGriseb.Plant Physiology,1984,75(4):1044-1047. [2] Garbari F,Pedulla M L.Alternantheraphiloxeroides(Amaranthacease),a new species for the exotic flora of italy.Webbia,2001,56(1):139-143. [3] 王桂芹,高瑞如,王玉良,柴瑞娟.异质生境空心莲子草的结构基础与生态适应性.草业学报,2011,20(4):143-152. Wang G Q,Gao R R,Wang Y L,Chai R J.Structure foundation and ecological adaptability ofAlternatheraphiloxeroidesin heterogeneous habitats.Acta Prataculturae Sinica,2011,20(4):143-152.(in Chinese) [4] 陈立立,余岩,何金.喜旱莲子草在中国的入侵和扩散动态及其潜在分布区预测.生物多样性,2008,16(6):578-585. Chen L L,Yu Y,He J.Historical invasion and expansion process ofAlternantheraphiloxeroidesand its potential spread in china.Biodiversity Science,2008,16(6):578-585.(in Chinese) [5] 翁伯琦,林嵩,王义祥.空心莲子草在我国的适应性及入侵机制.生态学报, 2006,26(7):2374-2377. Weng B Q,Lin S,Wang Y X.Discussion on adaptability and invasion mechanisms ofAlternantheraphiloxeroidesin China.Acta Ecologica Sinica,2006,26(7):2374-2377.(in Chinese) [6] 张志忠,石秋香,孙志浩,蓝茂锋.入侵植物空心莲子草对生菜和萝卜的化感效应.草业学报,2013,22(1):288-293. Zhang Z Z,Shi Q X,Sun Z H,Lan M F.Allelopathy of the invasive plantAlternantheraphiloxeroidesto radish and lettuce.Acta Prataculturae Sinica,2013,22(1):288-293.(in Chinese) [7] 雷波,李洁.空心莲子草水浸提液对蚕豆根尖细胞有丝分裂的影响.南方农业学报,2013,44(12):1972-1976. Lei B,Li J.Effect ofAlternatheraphiloxeroidesaqueous extract on mitosis ofViciafabaroot tip cell.Journal of Southern Agriculture,2013,44(12):1972-1976.(in Chinese) [8] 余柳青,Yoshiharu Fujii,周勇军,张建萍,陆永良,玄松南.外来入侵杂草空心莲子草与本土杂草的化感作用潜力比较.中国水稻科学,2007,21(1):84-89. Yu L Q,Fujii Y,Zhou Y J,Zhang J P,Lu Y L,Xuan S N.Comparison of allelopathy potential between an exotic invasive weedAlternantheraphiloxeroidesand a local weedA.sessilis.Chinese Journal of Rice Science,2007,21(1):84-89.(in Chinese) [9] 熊勇,屈睿,王红斌,熊开金,姜传亮.空心莲子草不同部位水浸提液对蚕豆、玉米化感作用机制的研究.中国农学通报,2011,27(18):158-163. Xiong Y,Qu R,Wang H B,Xiong K J,Jiang Z L.The study on allelopathy mechanism of aqueous extracts from the different organizations ofAlternantheraphiloxeroidesGriseb onViciafabaandZeamays.Chinese Agricultural Science Bulletin,2011,27(18):158-163.(in Chinese) [10] Hu Y,Wang Y H,Wen G S,Shen L Q,Wu A P.The interactive effects of different sterilization levels and aqueous extracts fromAlternantheraphiloxeroideson the seed germination and seedling growth ofTrifoliumrepens.Ecological Science,2015,528:230-237. [11] Dong B C,Alpert P,Guo W.Effects of fragmentation on the survival and growth of the invasive,clonal plantAlternantheraphiloxeroides.Biological Invasions,2012,14(6):1101-1110. [12] 彭克勤,胡笃敬.空心莲子草K+吸收的动力学研究.植物生理学报,1986,12(2):187-193. Peng K Q,Hu D J.Study on the K+absorption ofAlternantheraphiloxeroidesGriseb.Acta Phytophysiologica Sinica,1986,12(2):187-193(in Chinese) [13] 林茂兹,邱雪芬,林能文,黄丽萍.空心莲子草对污泥重金属的响应与吸附效应.草业科学,2012,29(5):681-686. Lin M Z,Qiu X F,Lin N W,Huang L P.Response ofAlternatheraphiloxeroidesto heavy metals and its sorption effectiveness for heavy metals.Pratacultura Science,2012,29(5):681-686.(in Chinese) [14] 李丹,徐丽,张震,王育鹏.喜旱莲子草的利用及其生物防治研究进展.中国农学通报,2013,29(1):71-75. Li D,Xu L,Zhang Z,Wang Y P.The research progress on utilization and biological control ofAlternantheraphiloxeroides.Chinese Agricultural Science Bulletin,2013,29(1):71-75.(in Chinese) [15] 周国峰,彭念军,王云,万海青,彭友林.2种化学除草剂对沟渠空心莲子草防除效果.草业科学,2009,26(3):95-96. Zhou G F,Peng N J,Wang Y,Wan H Q,Peng Y L.Two kinds of chemical herbicides on control ofAlternantheraphiloxeroideseffect.Pratacultural Science,2009,26(3):95-96.(in Chinese) [16] 赛米拉克孜·台外库力,靳瑰丽,安沙舟,崔国盈,张勇娟,才登巴·金保.醉马草根围土壤对牧草种子萌发的影响.草业科学,2015,31(11):2105-2112. Saimilakezi·Taiwaikuli,Jin G L,An S Z,Cui G Y,Zhang Y J,Caidengba·Jinbao.Effects of rhizosphere soil ofAchnatheruminebrianson forages seed germination.Pratacultural Science,2015,31(11):2105-2112.(in Chinese) [17] 郑艳玲,马焕成,Scheller Robert,高柱,郑元.环境因子对木棉种子萌发的影响.生态学报,2013,33(2):0382-0388. Zheng Y L,Ma H C,Robert S,Gao Z,Zheng Y.Influence of environmental factors on seed germination ofBombaxmalabaricum.Acta Ecologica Sinica,2013,33(2):0382-0388.(in Chinese) [18] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导.北京:中国轻工业出版社,2011:34-78. Cao J K,Jiang W B,Zhao Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables.Beijing:China Light Industry Press,2011:34-78.(in Chinese) [19] 王学奎.植物生理生化实验原理和技术.北京:高等教育出版社,2005:199-207. Wang X K.Principles and Techniques of Plant Physiology and Biochemistry Experiment.Beijing:Higher Education Press,2005:199-207.(in Chinese) [20] 杨剑虹,王成林,代亨林.土壤农化分析与环境监测.北京:中国大地出版社,2008:55-56. Yang J H,Wang C L,Dai H L.Soil Chemical Analysis and Environmental monitoring.Beijing:China Land Press,2008:55-66.(in Chinese) [21] Williamson G B,Richardson D.Bioassays for allclopathy:Measuring treatment response with independent controls.Journal of Chemical Ecology,1988,14(1):181-188. [22] Macias F A,Molnillo J M V.Allelopathy anatural alternative for weed control.Pest Management Science,2007,63(4):327-348. [23] Babula P,Vanco J,Kohoutkova V,Dankova I,Havel L,Kizek R.Cell signals as markers of cytotoxicity of new complexes of naphthoquinones.Analysis of Biomedical Signals and Images,2010,6159(3):259-263. [24] 刘成,吴明,陈晓德,叶小齐,贺丽.芦苇水提液对加拿大一枝黄花生长及光合作用的化感效应.生态学杂志,2014,33(3):624-630. Liu C,Wu M,Chen X D,Ye X Q,He L.Allelopathic effects of aqueous extracts fromPhragmitescommunison the growth and photosynthesis ofSolidagocanadensis.Chinese Journal of Ecology,2014,3(3):624-630.(in Chinese) [25] 胡琬君,马丹炜,王亚男,张红,李群.土荆芥挥发油对蚕豆根尖细胞的化感潜力.生态学报,2011,31(13):3684-3690. Hu W J,Ma D W,Wang Y L,Zhang H,Li Q.Allelopathic potential of volatile oil fromChenopodiumambrosioideson root tip cells ofViciafaba.Acta Ecologica Sinica,2011,31(13):3684-3690.(in Chinese) [26] 王三根.植物生理生化.北京:中国林业出版社,2013:102-156. Wang S G.Plant Physiology and Biochemistry.Beijing:China Forestry Publishing House,2013:102-156.(in Chinese) [27] 焦玉洁,桑宇杰,杨磊,王亚麒,吴叶宽,杜如万,袁玲.新鲜和腐熟紫茎泽兰对三种茄科蔬菜生理和辣椒产量品质的影响.中国农业科学,2016,49(5):874-884. Jiao Y J,Sang Y J,Yang L,Wang Y Q,Wu Y K,Du R W,Yuan L.Effects of fresh and compostedAgeratinaadenophoraon physiology of three Solanaceae vegetables and yield and quality of pepper.Scientia Agricultura Sinica,2016,49(5):874-884.(in Chinese) [28] Xing S Z,Wang J F,Cai D.Effects of citrate and malate on the seed germination and memberane permeability ofPakchoi.Chinese Agricultural Science Bulletin,2007,123(9):312-316. [29] Politycka B.Peroxidase activity and lipid peroxidation in roots of cucumber seedlings influenced by deriatives of cinnamic and benzoic acids.Acta Physiology Plantarum,1996,18(4):365-370. [30] Wang Y C,Wang D X,Peng S B,He K.Effects of drought stress on physiological characteristics of woody saltbush.Scientia Silvae Sinica,2010,46(1):61-67. [31] 彭克明.农业化学总论.北京:中国农业大学出版社,2003:79-99. Peng K M.Agricultural Chemical General.Beijing:China Agriculture Press,2003:79-99.(in Chinese) [32] 王亚麒,焦玉洁,陈丹梅,袁玲,黄玥,吴叶宽,杜如万.紫茎泽兰浸提液对牧草种子发芽和幼苗生长的影响.草业学报,2016,25(2):150-159. Wang Y Q,Jiao Y J,Chen D M,Yuan L,Huang Y,Wu Y K,Du R W.Effects ofEupatoriumadenophorumextracts on seed germination and seedling growth of pasture species.Acta Prataculturae Sinica,2016,25(2):150-159.(in Chinese) [33] 焦玉洁,王亚麒,袁玲.乌头块根浸提液对3种牧草的化感效应.中国中药杂志,2015,40(21):4155-4199. Jiao Y J,Wang Y Q,Yuan L.Allelopathic effects of extracts from tuberous roots ofAconitumcarmichaelion three pasture grasses.Journal of Traditional Chinese Medicine,2015,40(21):4155-4199.(in Chinese) [34] Wang Y Q,Chen D M,Yuan L.Allelopathic effects of the extracts from fibrous roots ofCoptischinensison Compositae.Vigna Radiate and Brassica Rapa Pekinensis,2015,24(6):142-149. [35] Wu W,Zhao J.Progress of research on plant nitrogen absorption and utilization.Chinese Agricultural Bulletin,2010,26(13):75-78. [36] Kerley S J.The effect of soil liming on shoot development,root growth,and cluster root activity of white lupin.Biology and Fertility of Soil,2000,32(2):94-101. [37] 高平,刘燕萍,潘为高,江德洪,甘明哲,秦晓娜,刘世贵.紫茎泽兰醇提物的毒理学研究.四川动物,2005,24(1):87-89. Gao P,Liu Y P,Pan W G,Jiang D H,Gan M Z,Qin X N,Liu S G.Toxicological study of alcohol extract ofEupatoriumadenphorumSprengel.Sichuan Journal of Zoology,2005,24(1):87-89. [38] 白祯,黄玥,黄建国.青蒿素对蔬菜种子发芽和幼苗生长的化感效应.生态学报,2013,33(23):7576-7582. Bai Z,Huang Y,Huang J G.Allelopathic effects of artemisinin on seed germination and seedling growth of vegetables.Acta Ecologica Sinica,2013,33(23):7576-7582.(in Chinese) [39] 李鑫,张会慧,张秀丽,许楠,胡举伟,逄好胜,滕志远,孙广玉.不同光环境下兴安胡枝子叶片光合和叶绿素荧光参数的光响应特点.草业科学,2016,33(4):706-712. Li X,Zhang H H,Zhang X L,Xu N,Hu J W,Pang H S,Teng Z Y,Sun G Y.Photosynthetic gas exchange and chlorophyll fluorescence parameters in response to illumination intensity in leaves ofLespedezadavuricaunder different light environments.Pratacultural Science,2016,33(4):706-712.(in Chinese)4 结论

