红曲高产洛伐他汀低产桔青霉素的研究
张江宁,王娟娟,张俊杰,杨春
(1.山西省农业科学研究院农产品加工研究所,太原 030031;2.山西大学,太原 030031)
红曲是红曲霉发酵制成的产品的总称,国内外大量研究表明由于红曲含有洛伐他汀成分,因此具有明显的降胆固醇和降血脂的功效,与传统中成药、鱼油类、亚麻酸类相比,在治疗效果上更胜一筹[1],起效迅速,而且具有生产成本低、食用方便等优点。但是红曲霉发酵过程中产生的桔青霉素是对人体有害的真菌毒素[2],靶器官为人体肾脏,具有致癌致畸作用,因此,红曲产品中桔青霉素的含量问题引起了广泛的关注[3]。国外一些国家早已将红曲产品中的桔青霉素含量作为食品污染的严格控制指标,这使我国红曲产品的出口
受到了很大的限制,桔青霉素问题已成为我国红曲产品出口的瓶颈[4],如何通过工艺革新提高洛伐他汀、降低桔青霉素含量是亟待研究的课题[5]。本实验建立了洛伐他汀、桔青霉素的高效液相色谱检测方法,并在此基础上研究6种不同发酵基质对洛伐他汀、桔青霉素含量的影响,旨在研究适合生产红曲米的优质培养基,在实现红曲保健功能作用的同时,避免毒副作用和不良反应的发生,保证红曲药用和食用的安全性。
1 材料与方法
1.1 仪器和试剂
安卡红曲:实验室保藏,甲醇、磷酸、95%乙醇洛伐他汀、桔青霉素、乙醇提取液(75%)、乙腈、磷酸、甲醇、甲苯、乙酸乙酯、甲酸、复合萃取剂(TEF):甲苯-乙酸乙酯-甲酸(7∶3∶1),将7份体积的甲苯、3份体积的乙酸乙酯和1份体积的甲酸混合而成。
SW-CJ-2G 超净工作台 苏州净化设备有限公司;GMSX-280高压灭菌锅 上海博迅有限公司;LG10-2.4离心机 北京医用离心机厂;高效液相色谱仪:DIONEX UltiMate 3000 UHPLC+focused,配备泵RS Pump,自动进样器RS Autosampler,柱温箱RS Column Compartment,检测器 Diode Array Detector;Thermo Scientific Q Exactive高分辨质谱仪; SHZ-D(III)不锈钢循环水式真空泵 北京医用离心机厂;JY92-ⅡN超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 试验方法[6]
1.2.1 PDA琼脂斜面培养基
称取200 g马铃薯切成小块,加水煮烂(煮沸20~30 min,能被玻璃棒戳破即可),用4层纱布过滤,再加葡萄糖和琼脂各20 g,继续加热搅拌混匀,稍冷却后加入柠檬酸1 g,再补足水分至1000 mL,分装试管,加塞、包扎,121 ℃灭菌20 min后取出,试管摆斜面,冷却后贮存备用[7]。
1.2.2 固态发酵培养基及红曲米制备[8]
原料20 g分别装入250 mL三角瓶中,经清洗,放置于0.25%的柠檬酸水用蒸锅蒸熟,蒸至物料颗粒分散、微粘状态,分别装入250 mL三角瓶中,加自来水适量,包扎,121 ℃灭菌30 min。红曲米制作:挑取1环保藏菌种接种于斜面培养基中,于 31 ℃恒温箱中扩大培养1周,试管表面加无菌生理盐水,稀释制成孢子浓度约为106~107个/mL的悬液。以每瓶10 mL孢子悬液接种于固体发酵培养基中,30 ℃培养6天。每天翻曲,并根据情况加pH 4的柠檬酸水。
1.2.3 不同固态发酵基质红曲米感官评价及对洛伐他汀、桔青霉素含量的影响[9]
取大米、小米、黑小米、燕麦米、苦荞麦仁、高粱20 g分别装入250 mL三角瓶中,其余方法同1.2.2,制成红曲米[10],进行感官评价并测定洛伐他汀及桔青霉素含量[11,12]。
2 结果与讨论
2.1 洛伐他汀UHPLC测定方法的建立[13]
2.1.1 发酵样品处理[14,15]
将发酵样品碾磨烘干过40目筛,取0.5 g于50 mL比色管中,用70%乙醇溶液定容到50 mL,55 ℃水浴萃取1 h,每隔20 min震荡1次,水浴结束后冷却至室温,取5 mL萃取液微滤。
2.1.2 UHPLC条件
色谱柱:Thermo Scientific Hypersil GOLD(100 mm×2.1 mm,1.9 μm),流动相A为纯水,流动相B为乙腈,流速0.200 mL/min,流动相梯度设置:0 min,5% B;1 min,5% B;8 min,95% B;15 min,95% B;15.01 min,5% B;18 min,5% B。柱温:35 ℃,检测波长238 nm,进样量:2 μL。
2.1.3 标准曲线的绘制及洛伐他汀标准品及发酵样品谱图[16,17]
标准曲线的配制:准确称取0.002 g的洛伐他汀标准品于100 mL容量瓶中,用色谱甲醇溶解并定容,制成20 mg/L的洛伐他汀标准储备液。取一定量的储备液用甲醇稀释后配制成质量浓度10,5,2,1,0.5,0.1,0.05 mg/L的标准工作液用于制标准曲线。将标准溶液注入液相色谱仪中,以保留时间结合其质谱精确质量数定性,洛伐他汀标准品与以小米为基质功能红曲的UHPLC-MS图见图1。根据标品的保留时间可以判断,洛伐他汀出峰时间为10 min,其质谱精确分子量为427.24550,对应为其分子的加钠峰[M+Na]+。以洛伐他汀标准品质量浓度(mg/L)与相对应的质谱峰面积(Y)绘制标准曲线见图2,获得线性回归方程及相关系数。


图1 洛伐他汀标准品与以小米为基质功能红曲的UHPLC-MS图Fig.1 UHPLC-MS spectrum of lovastatin standard sample and functional monascus with millet as substrate

图2 洛伐他汀标准曲线Fig.2 Standard curve of lovastatin
2.2 桔青霉素含量测定方法[18]
2.2.1 发酵样品处理
用电子天平准确称取一定量固态红曲样品6 g于100 mL具塞比色管中,加入40 mL TEF溶液,超声提取10 min(强度40%,工作5 s,间隔5 s)3000 r/min离心20 min,上清液转入250 mL具塞三角瓶中,残渣用30 mL TEF溶液同上述步骤再提取2次,合并3次提取上清液于250 mL具塞三角瓶中,40 ℃真空浓缩至干后加入60 mL甲醇溶解,经微孔有机滤膜过滤后进行HPLC分析。
2.2.2 UHPLC检测条件
色谱柱:Thermo Scientific Hypersil GOLD(100 mm×2.1 mm,1.9 μm),流动相A为纯水,流动相B为乙腈,流速0.200 mL/min,流动相梯度设置:0 min,5% B;1 min,5% B;8 min,95% B;15 min,95% B;15.01 min,5% B;18 min,5% B。柱温:35 ℃,检测波长:238 nm,进样量:2 μL。
2.2.3 标准曲线的绘制及桔青霉素标准品及发酵样品谱图[19]
桔青霉素标准溶液:准确称取0.002 g的桔青霉素标准品于100 mL容量瓶中,用甲醇溶解并定容,制成20 mg/L的桔青霉素标准储备液。取一定量的储备液用甲醇稀释2倍,制成10 mg/L的标准工作液。储备液和工作液密封后于4 ℃冰箱闭光保存,工作液现用现配。工作液从冰箱取出后室温下放置10 min。将工作液用甲醇稀释后配制成质量浓度5,1,0.25,0.1 mg/L的标准工作液用于制标准曲线。分别将不同质量浓度20,10,5,1,0.25,0.1 mg/L的桔青霉素标准溶液注入液相色谱仪中,以保留时间结合其质谱精确质量数定性,桔青霉素标准品与以小米为基质功能红曲的UHPLC-MS谱图见图3。根据标品的保留时间可以判断,桔青霉素出峰时间为6.26 min,其质谱精确分子量为251.09140,对应其加氢形式[M+H]+。以桔青霉素质量浓度与相对应的峰面积绘制标准曲线见图4,获得线性回归方程及相关系数,以此计算样品中桔青霉素含量。
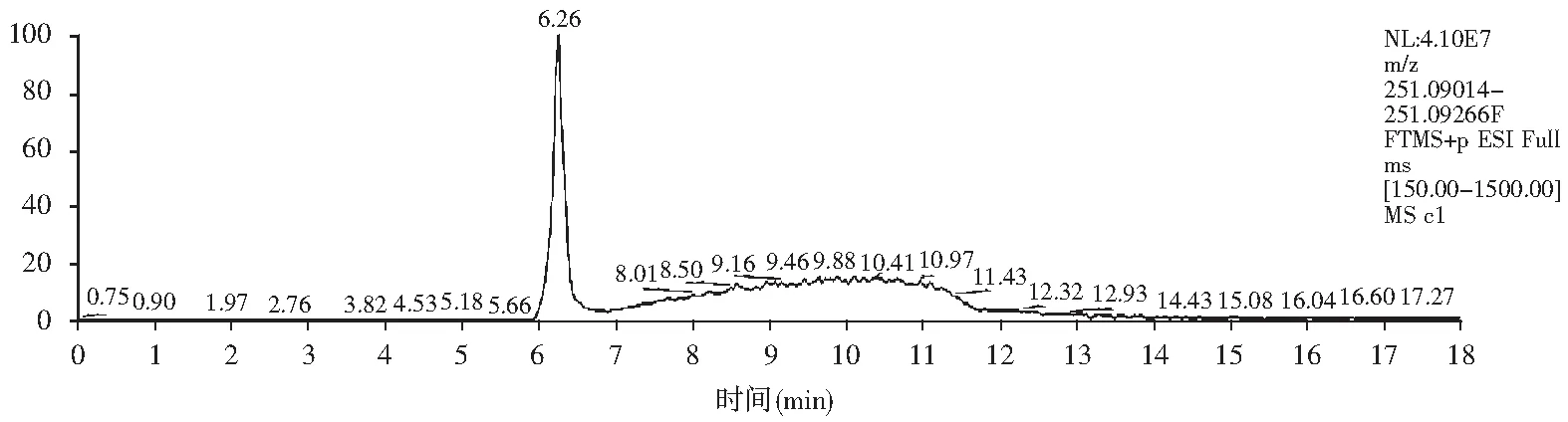

图3 桔青霉素标准品及以小米为基质功能红曲的UHPLC-MS图Fig.3 UHPLC-MS spectrum of citrinin standard sample and functional monascus with millet as substrate

图4 桔青霉素标准曲线Fig.4 Standard curve of citrinin
2.3 不同发酵基质红曲米感官评价
发酵过程中,不同发酵基质最终发酵产物特征见图5[20-22]。

图5 不同发酵基质最终发酵产物特征Fig.5 The characteristics of final fermented products with different fermentation substrates
由图5可知,以大米、小米为基质发酵菌丝最先生长,原料最先变红,发酵至6天时,红曲大米表面颜色鲜红,断面为粉红色,色泽鲜艳,具有红曲固有的曲香;红曲小米表面呈橙红色,断面为米红色;黑小米发酵至8天时颜色呈黑红色;苦荞麦仁呈深红色,断面为粉红色;高粱、燕麦米[23]菌丝生长最慢,发酵至3天时,原料开始显现红色,最终发酵至8天时,颜色不再变化,原料本身颜色与红色相间,具有些许红曲固有的曲香,说明原料发酵不充分,这可能是由于原料表面种皮较厚,粉碎程度不高导致淀粉物质没有被充分暴露出来,未能被充分利用,同时简单的蒸煮方式导致淀粉熟化程度不够,不利于红曲菌种生长,造成原料利用不充分,因此以高粱、燕麦米为基质发酵菌丝生长缓慢,原料利用率低。
2.4 不同发酵基质对红曲米洛伐他汀及桔青霉素含量的影响
不同发酵基质对红曲米洛伐他汀及桔青霉素含量的影响见表1。
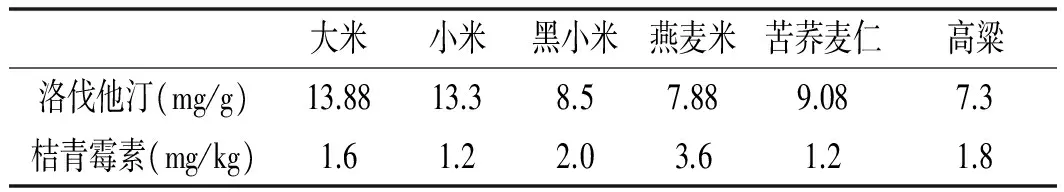
表1 不同发酵基质对红曲米洛伐他汀及桔青霉素含量的影响Table 1 The effect of different fermentation substrates on the content of lovastatin and citrinin produced by monascus
不同发酵基质对红曲产洛伐他汀及桔青霉素的含量有重要影响[24],单独以大米为发酵基质生产的功能性红曲,其洛伐他汀含量最高,达到13.88 mg/g,小米、苦荞麦仁、黑小米次之,燕麦米[25]、高粱较低;以苦荞麦仁、小米为发酵基质生产的功能性红曲桔青霉素的含量最低,为1.2 mg/kg,燕麦米桔青霉素的含量最高,为3.6 mg/kg。传统功能红曲通常以大米为原料,但是发酵过程中大米容易粘结,影响菌丝的生长,该实验表明小米、苦荞麦仁由于其颗粒度小,且在发酵过程中不易结团,分散性好,可以为微生物生长提供较好的生长面积,而且桔青霉素含量较低[26],可以作为很好的发酵基质,高粱、燕麦米有较厚的种皮,红曲菌生长困难,经粉碎处理后菌丝生长旺盛,洛伐他汀含量略有提高,但在发酵过程中需要不断地补充水分,而且燕麦红曲米的桔青霉素含量较高,这可能是由于原料中某种成分促进了桔青霉素的生成,因此确定将小米作为发酵基质可以满足高洛伐他汀低桔青霉素的要求。
[1]沈平.红曲固态发酵生产洛伐他汀的实验条件优化[J].北京农学院学报,2005,20(3):47-79.
[2]杜新芳,陈运中.红曲提取物的急性毒性和致突变性研究[J].食品研究与开发,2013,34(5):34-36.
[3]唐僖,宋航.红曲中桔霉素的检测控制及无桔霉素红曲产业化[J].中国酿造,2009(9):1-3.
[4]赵秀举,刘志国.红曲洛伐他汀发酵条件优化及降脂功能[J].中国酿造,2014,33(1):32-35.
[5]张晓伟,王昌禄,陈勉华.理化因子对红曲色素色价的影响及桔霉素的光降解性[J].食品科学,2013(15):35-38.
[6]陈勉华,吉达维,马仁杰.不同发酵基质对红曲重要代谢产物的影响[J].中国酿造,2013,32(3):22-24.
[7]周建建,苏理,赵双枝.采用响应曲面法优化红曲霉发酵培养基组分[J].食品工业科技,2012(23):62-67.
[8]林祖申.红曲的生产方法及其在调味品生产中的应用[J].中国酿造,2005(10):1-4.
[9]许赣荣.无桔霉素高比例开环式莫纳可林K红曲产品的生产[J].食品与发酵工业,2004,30(10):59-60.
[10]黄勋,王常苏,高泽鑫,等.发芽大豆固态发酵功能红曲产Monacolin K工艺技术研究[J].中国酿造,2014,33(8):132-135.
[11]GB 1986.19-2015,食品添加剂 红曲米[S].
[12]陈泉,吴远征,扈进冬.高产Monacolin K红曲霉菌种的筛选及液态发酵条件优化[J].中国酿造,2015,34(6):78-82.
[13]童爱均,吕旭聪,刘晓艳.固体发酵基质和外加碳氮源对红曲霉色素产量的影响[J].中国调味品,2015,40(5):5-7.
[14]穆洪霞,丁雪梅,黄六斌.红曲霉发酵不同底物产色素的研究进展[J].中国酿造,2014,33(1):1-4.
[15]罗仁才.红曲中洛伐他汀总量的测定方法[J].卫生研究,2003,32(2):157-158.
[16]姜冰洁.红曲菌固态发酵高产 Monacolin K的研究[D].无锡:江南大学,2015.
[17]马帅.红曲菌发酵豆浆生产Monacolin K的研究[J].食品研究与开发,2016,37(21):156-162.
[18]GB/T 5009.222-2008,红曲类产品中桔青霉素的测定[S].
[19]赖卫华,龚春来,黄秋阳.红曲霉培养过程中桔霉素积累规律的初步研究[J].食品工业科技,2003(7):29-30.
[20]Sharmila G, Nidhi B, Muthukumaran C.Sequential statistical optimization of red pigment production byMonascuspurpureus(MTCC369) using potato powder[J].Ind Crop Prod,2013,44:158-164.
[21]Silveira S T, Daroit D J, Sant'anna V,et al. Stability modeling of red pigments produced byMonascuspurpureusin submerged cultivations with sugarcane bagasse[J].Food Bioprocess Tech,2013(6):1007-1014.
[22]Meinicke R M,Vendruscolo F, Moritz D E, et al.Potential use of glycerol as substrate for the production of red pigments byMonascusruberin submerged fermentation[J].Biocatal Agric Biotechnol,2012(1):238-242.
[23]涂璐,王爱莉,李再贵.燕麦红曲黄酒多酚含量及抗氧化性研究[J].中国酿造,2012,31(1):43-46.
[24]范志诚,徐伟,王金凤,等.玉米液态发酵制红曲色素及在食品防腐中应用研究[J].中国调味品,2012,37(12):89-92.
[25]汪建国,沈玉根,黄炎远. 燕麦红曲黄酒的研制[J].中国酿造,2013,32(2):152-155.
[26]石侃,夏枫耿,吴振强.红曲色素发酵生产过程桔霉素控制技术研究进展[J].中国酿造,2016,35(4):1-6.

