酒萸肉-熟地黄配伍煎液中马钱苷和莫诺苷含量变化研究
周函钰 余平 吴国清
浙江省立同德医院 浙江 杭州 310012
酒萸肉与熟地黄是临床常用的中药,本文从煎液层面观察酒萸肉-熟地黄(简称“酒萸肉-地黄”)中马钱苷、莫诺苷含量变化,研究其配伍的优势。
1 仪器与材料
1.1 实验药品:酒萸肉(河南省宛西制药股份有限公司,批号:1200051);熟地黄(衡州南孔中药有限公司饮片厂,批号:130515);马钱苷(批号111640-200604)购于中国药品生物制品检验所;莫诺苷购于鼎瑞化工(上海)有限公司(批号为25406-64-8,HPLC归一化测定纯度≥98%);乙腈(色谱纯)与甲醇(分析纯)均购自江苏汉邦科技有限公司;所有实验用水为超纯水。
1.2 实验器材:梅特勒XS-105电子分析天平(METTLER,TOLEDO);梅特勒AL-204电子天平(METTLER,TOLEDO);DZF-6050真空干燥箱(上海一恒有限公司);DHG-9240A电热鼓风干燥箱(上海一恒有限公司),YBIA真空恒温干燥箱(天津光学仪器厂);HH-4数显恒温水浴锅(上海梅悉仪器有限公司);98-I-B电子控温电热套(天津市泰斯特仪器有限公司);岛津LC-20AT高效液相色谱仪;LC solution色谱工作站。
2 方法和结果
2.1 色谱条件:色谱柱:Inertsil ODS-SP C18柱(4.6mm×250mm,5μm);流动相为:乙腈:水=15:85,流速:1ml/min;柱温:25℃;进样体积:10μl。
2.2 配伍水煎液与单煎酒萸肉中马钱苷与莫诺苷的比较:分述如下。
2.2.1 酒萸肉单煎液供试品制备:取酒萸肉50g,加10倍量水浸泡1h,置500ml双颈圆底烧瓶中回流提取,沸腾计时,每隔15min从其中取10ml提取液,称定重量,用热水迅速补足损失的重量,至180min为止。精密吸取水煎液各1ml,置水浴上蒸干,加入适量甲醇溶解,离心,定量转移到5ml容量瓶,少量多次转移,定容,即作为测定马钱苷、莫诺苷供试品。
2.2.2 酒萸肉-地黄供试品制备:分别取地黄100g、酒萸肉50g,加10倍量水浸泡1h,置1500ml双颈圆底烧瓶中进行回流提取,至沸腾开始计时,每隔15min从其中取10ml提取液,称定重量,用热水迅速补足损失的重量,至180min为止。煎煮各时间点得到的水煎液,精密吸取1ml,置水浴上蒸干,加入适量甲醇溶解,离心,定量转移到5ml容量瓶,少量多次转移,定容,即作为测定马钱苷、莫诺苷供试品。
2.2.3 酒萸肉、地黄单煎、混煎液制备:取酒萸肉50g、地黄100g,加10倍量水浸泡1h,圆底烧瓶中进行回流提取,至沸腾开始计时,煎煮1h。取酒萸肉水煎液100ml,地黄水煎液200ml,煎煮1h。取酒萸肉水煎液10ml,地黄水煎液20ml,物理混合(2份),取1份物理混合液再煎煮1h。精密吸取酒萸肉水煎液,酒萸肉-地黄配伍煎液,酒萸肉-地黄物理混合煎液、酒萸肉-地黄物理混合再煎煮煎液1ml,置水浴上蒸干,加入适量甲醇溶解,离心,定量转移到5ml容量瓶,少量多次转移,定容,即为供试品。
2.3 固形物的比较:将2.2项下得到提取液3000r/min离心,从中精密量取5ml,精密称定,置恒重的蒸发皿中,浓缩、干燥至恒重,称量,得固形物重量。
2.4 结果:按照中国药典方法,测定酒萸肉-地黄配伍水煎液中活性成分的含量,见图1~6,表1~2。

图1 莫诺苷、马钱苷对照品的HPLC图谱
图2 酒萸肉单煎液不同时间HPLC图谱
图3 酒萸肉-地黄配伍不同时间点HPLC图谱

图4 酒萸肉单煎液、酒萸肉-地黄配伍对比HPLC图谱

表1 酒萸肉、酒萸肉-地黄煎液中马钱苷、莫诺苷含量
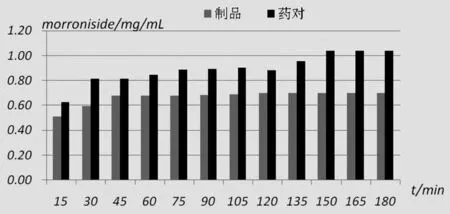
图5 酒萸肉、药对水煎液中马钱苷和莫诺苷的煎出曲线
图6 各样品中马钱苷和莫诺苷的溶出率HPLC图谱

表2 各样品中马钱苷和莫诺苷的含量
2.5 酒萸肉-地黄配伍水煎液中固形物的比较:将2.2项下得到提取液3000r/min离心,从中精密量取5ml,精密称定,置恒重的蒸发皿中,浓缩、干燥至恒重,称量,计算煎出率,见图7。

图7 酒萸肉、酒萸肉-地黄配伍不同时间点的固形物
3 讨论
本文从水煎液来观察酒萸肉-地黄配伍后活性成分变化,研究了酒萸肉与地黄配伍时马钱苷、莫诺苷的变化规律。采用先对单味药材进行煎煮,然后对单煎液进行配伍的思路可以消除药材共煎过程中酒萸肉组分和熟地组分之间的相互作用。按照经典配伍(酒萸肉:地黄=1:2),酒萸肉单煎液中马钱苷含量为0.2945mg/ml,莫诺苷含量为0.7015mg/ml;与地黄配伍后,马钱苷含量为0.3615mg/ml,莫诺苷含量为1.0380mg/ml。提示酒萸肉-地黄配伍具有协同煎出的作用,有利于酒萸肉中有效组分的溶出。中药临床用药的特点之一就是复方配伍,探讨中药配伍过程中成分的变化,为深入研究中药作用机理,加速中药现代化提供了一条新的思路。

