纳米银洗液与伤科黄水联合VSD治疗下肢感染创面的疗效对比分析
欧 文
近年来不断提升人们的收入及生活水平,逐年增加汽车数量,随之提高了车源性外伤发生率;建筑业繁荣发展与进步过程中,也增多了工地源性外伤;另外,发展工业与制造业后,工业源性外伤病例数量处于增长态势中。外伤后,局部软组织有可能发生感染、坏死,尤其是严重开放性外伤、严重皮下软组织损伤时,感染与坏死的发生几率进一步提高,使感染创面发生率日渐升高,特别是下肢感染创面[1]。临床治疗下肢感染创面患者时,负压封闭引流技术(VSD)为常用方法之一,具有引流彻底、引流时间短等优势,但在治疗期间,存在一定副作用、产生细菌耐药等,导致治疗效果并不理想[2]。研究指出[3],下肢感染创面应用VSD治疗过程中,联系洗液治疗后,可促进治疗效果的提升,但由于目前可采用的洗液比较多,因此,本院以行VSD治疗的下肢感染创面患者为研究对象,分别在治疗中联合纳米银洗液及伤科黄水,对比治疗效果,以能为临床选择提供参考。
1 资料与方法
1.1 一般资料
选择本院2016年4月—2017年4月收治的下肢感染创面患者96例,男52例,女44例;年龄19~64岁,平均(35.2±2.8)岁。(1)诊断标准[4]:①西医诊断标准:感染症状出现,如红热、肿痛;渗出液浓稠,化脓,改变创周组织颜色;采集创面分泌物,经细菌培养后,结果呈阳性;②中医诊断标准:创面属于创伤性,由外伤所致;红肿、溃烂出现在皮肤软组织且伴有脓性液体分泌;创周皮肤水肿且呈暗紫色;溃疡反复发作;中医辨证分型为气血两虚证。(2)纳入标准:①与诊断标准相符合;②下肢创伤后形成的创面,且伴有感染;③未合并高血压等基础疾病;④感染后病情平稳;⑤创面面积在8 cm×8 cm以下;⑥对本研究知情,自愿参与。(3)排除标准:①疑似伴有恶性疾病疾病;②合并严重原发性疾病,如造血系统疾病、心血管疾病;③伴有严重神经官能症;④特异性感染。(4)剔除标准:①疗效无法判定或疗效受到相关因素影响;②感染加重,病情变危患者。按照随机方式,分为A组、B组和C组,每组32例,3组患者资料无显著差异(P>0.05)。
1.2 方法
C组常规实施VSD治疗,清创常规进行,坏死组织与异物清除后,以实际创面大小为依据,修剪聚烯醇明胶海绵材料(材料带有引流管及输入管),与创面紧密接触后,在创周部位缝合,使创面被生物透性薄膜密闭,避免漏气,于与创面距离2~3 cm处的皮肤戳孔,引出负压引流管,再与负压装置连接,负压调整到50~60 kPa,负压吸引持续进行。
A组利用纳米银洗液冲洗联合VSD治疗,VSD治疗方法与C组相同,在此基础上加用纳米银洗液(批准文号:吉食药监械(准)字2005第2640170号),将冲洗器与输入管连接,连接前冲洗器先吸入纳米银洗液,速度控制在10 ml/min,冲洗60 min,每天1次。
B组利用伤科黄水联合VSD治疗,VSD治疗方法与C组相同,同时,将伤科黄水纱(广东佛山市中医院,批准文号粤Z20070924)外敷在患侧下肢创面上,需超出创面3~4 cm,覆盖2~4层,包扎时采用无菌纱布,每天换药1次或2次,换药时,坏死、腐烂组织要清除,创面渗出物清除时采用0.05%无醇型安尔碘棉球,完成后利用干棉球擦干,重新覆盖、包扎。
1.3 观察指标
记录3组患者的换药次数、住院时间、创面愈合时间及感染控制时间;观察3组患者局部FGF、IL-1的表达分级,统计阳性细胞数量,无阳性细胞为阴性(-),阳性细胞数量10个以内为弱阳性(+),阳性细胞数量11~30个为阳性(++),阳性细胞数量30个以上为强阳性(+++)[6];分别于治疗1 d、治疗3 d、治疗7d时评价3组患者的疼痛程度,评价工具为视觉模拟评分法(VAS),0~10分评分,分数越高,表示患者疼痛越严重。
1.4 统计学分析
2 结果
2.1 换药次数、住院时间、创面愈合时间、感染控制时间比较
经治疗后,A组、B组换药次数、住院时间、创面愈合时间、感染控制时间均低于C组,且A组低于B组,差异显著(P<0.05),见表1。
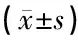

组别(n=32)换药次数(次)住院时间(d)创面愈合时间(d)感染控制时间(d)A组4.8±2.610.8±3.28.9±1.58.1±1.3B组13.5±4.219.4±3.716.2±2.414.7±2.2C组-23.3±4.521.7±3.120.0±2.8tt1=5.368/t2=4.927/t3=5.504t1=5.424/t2=5.116/t3=5.632t1=5.381/t2=5.115/t3=5.337t1=5.501/t2=5.068/t3=5.518PP1=0.024/P2=0.029/P3=0.021P1=0.020/P2=0.026/P3=0.018P1=0.021/P2=0.025/P3=0.017P1=0.018/P2=0.026/P3=0.018
注:t1为A组与C组相比,t2为B组与C组相比,t3为A组与B组相比
2.2 治疗后各时段疼痛评分比较
A组、B组治疗1 d、治疗3 d、治疗7 d时疼痛评分均低于C组,且A组低于C组,存在统计学差异(P<0.05),见表2。


组别(n=32)治疗1d治疗3d治疗7dA组1.24±0.180.79±0.300.64±0.17B组2.57±0.542.19±0.371.62±0.24C组3.32±0.642.97±0.422.81±0.33tt1=5.627/t2=5.128/t3=5.904t1=5.424/t2=4.827/t3=5.632t1=5.483/t2=4.928/t3=5.364PP1=0.016/P2=0.024/P3=0.011P1=0.020/P2=0.032/P3=0.018P1=0.018/P2=0.032/P3=0.016
注:t1为A组与C组相比,t2为B组与C组相比,t3为A组与B组相比
2.3 局部FGF、IL-1表达分级与阳性细胞数比较
A组、B组IL-1表达分级、阳性细胞数量均低于C组,且A组低于B组;A组、B组局部FGF表达分级及阳性细胞数高于C组,且A组高于B组;差异显著(P<0.05),见表3。
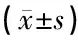

组别(n=32)FGFIL-1表达分级阳性细胞数(个)表达分级阳性细胞数(个)A组+++37.2±3.5-~+8.9±4.7B组++~+++30.8±7.1-~+11.2±2.3C组++17.8±6.3+~++20.8±6.3tt1=5.716/t2=5.226/t3=6.347t1=5.534/t2=5.028/t3=5.835PP1=0.014/P2=0.020/P3=0.008P1=0.021/P2=0.030/P3=0.015
注:t1为A组与C组相比,t2为B组与C组相比,t3为A组与B组相比
3 讨论
外科、骨科、烧伤科等临床科室中,创面感染均属于常见病,且解决难度比较大,尤其下肢创面感染。目前,临床中尽管具有比较多的治疗下肢感染创面的方法,但多数具有较长的病程,也不能获得理想的治疗效果,患者满意情况较差。1992年,德国Fleischmann博士首先提出了VSD技术,1994年时,裘华德教授将该项技术引入国内[7]。感染性创面应用VSD技术治疗时,能够使创面处于密闭状态,经持续负压吸引,彻底的引流出创面炎性渗出物及坏死组织,预防局部炎症反应,甚至全身脓毒血症及败血症的发生,促进患者痊愈[8]。因VSD技术具有封闭创面、预防创面二次感染、促进感染腔隙快速闭合等优点,在感染创面中广泛的应用,但从临床实践情况来看,单纯VSD治疗中,还存在一些不足之处,表现为导管易受到沉积血液或分泌物的堵塞,消除负压吸引作用;密闭状态一直存在,促创面愈合药物难以应用;继发厌氧菌或革兰阴性菌感染可能发生[9]。
基于单纯VSD技术在下肢感染创面中存在的不足,学者进行了大量相关的研究,提出VSD联合伤科黄水的方法,伤科黄水由中药组成,包含黄连、栀子、黄柏等,具有清热解毒、消肿止痛的功效[10]。伤科黄水与VSD联合治疗下肢创面感染过程中,能够促使创面愈合速度加快,促进局部软组织增生,使患者尽早的康复[11]。不过,伤科黄水属于外敷药,需频繁的更换药物,不利于感染的控制及创面的尽快愈合。研究指出[12],伤科黄水联合VSD治疗下肢感染创面时,换药次数平均(15.4±2.4)次,而本研究B组换药次数平均(13.5±4.2)次,与前人研究一致,但却明显高于A组。纳米银洗液是近年来研制出来的新型抗菌洗液,抗菌效果广谱高效,能够强烈的的杀灭多种微生物,且耐药性不易产生,广泛的应用于临床中,并在下肢感染创面中取得良好的应用效果[13]。VSD持续负压引流基础上,将纳米银洗液与输入管相连接,利用纳米银洗液冲洗感染创面,冲洗过程中,纳米银洗液释放银离子,再通过银离子抗菌作用的发挥,达到杀灭细菌的效果,整个过程并不会产生细胞毒性,安全性较高,且能够尽快的控制感染,促使患者创面尽早愈合[14-15]。
综上,下肢感染创面治疗中,与伤科黄水联合VSD的疗效相比,采用纳米银洗液联合VSD治疗时,有利于更为快速的控制感染,缩短创面愈合时间及住院时间,减轻患者的痛苦程度,提高患者的生活质量。
[1] 刘霄龙.负压封闭引流技术在下肢严重创伤后软组织缺损感染中的疗效[J].黑龙江医药科学,2017,40(4):97-98.
[2] 左可斌,李 静,蔡玉琪.VSD联合皮瓣修复下肢骨外露的临床效果[J].中国城乡企业卫生,2017,32(3):10-12.
[3] HOROBIN A J, SHAKESHEFF KM, PRITCHARD D I. Promotion of human dermal fibroblastmigration, matrix remodelling and modification of fibroblast morphology within a novel 3D model by Lucilia sericata larval secretions[J].J InvestDermatol,2016,126(6):1410.
[4] 吴 坚,罗兴良,马树云,等.下肢骨折创面感染患者负压封闭引流治疗对下肢微循环及愈合的影响分析[J].中华医院感染学杂志,2016,26(17):3978-3980.
[5] 张太元,谢新敏,布金鹏,等.负压封闭引流技术结合深部冲洗治疗下肢露骨感染创面[J].中国医学创新,2015,12(13):71-73.
[6] RAMUNDO J, GRAY M. Enzymatic wound debridement[J].J Wound Ostomy Continence Nurs,2015,35(3):273-280.
[7] 司佳亚,刘长志,陈新胜.负压封闭引流术与灌注冲洗术治疗下肢骨感染疗效比较[J].中华医院感染学杂志,2014,24(14):3574-3576.
[8] 李 驰,金广建,陈 雷,等.上下肢开放性骨折创面并发感染的影响因素分析及对策[J].中华医院感染学杂志,2015,22(20):4515-4516.
[9] VENTURI ML,ATTINGER CE,MESBAHI AN,et al.Mechanisms and clinical applicatio-ns of the vacuum assisted closure (VAC) De-vice:a review[J].Am JC lin Dermatol:2015:6(3):185-194.
[10] 李少兰,银桂彬,阮晓玲,等.持续、间断封闭负压引流对下肢慢性感染性创面游离植皮术后疗效的影响[J].广东医学院学报,2014,30(2):175-176.
[11] 马红梅,李 彦,魏现娟.银离子敷贴治疗下肢感染30例疗效观察[J].齐鲁护理杂志,2017,17(35):124-125.
[12] SKIRAKAWA W, ZSSEROFF RR. Topical Negative pressure devices use for enhancement of healing chronic wounds[J]. Arch Rermatol, 2015,141(11):1449-1453.
[13] 齐新文,王兆杰,陈军平,等.负压封闭引流术在大面积皮肤缺损感染坏死中的应用及疗效[J].生物骨科材料与临床研究,2016,8(2):25-28,32.
[14] WEED T,RATLIFF C,DRAKE DB,et al.Quantifying bacterial bioburden during negative pressure wound therapy:does the wound VAC enhance bacterial clearance[J].Ann Plast Surg,2014,52(3):276-280.
[15] 吴 玲,周 芳,范英华.美皮康银治疗下肢静脉溃疡创面的临床研究[J].江苏医药,2015,36(14):1661-1662.

