奶牛隐性乳房炎大肠杆菌16S rRNA序列分析
谢 昆,蒋成砚,刘 杰,李桥善,周文树,唐秀华,汪 镜
(1.红河学院生命科学与技术学院,云南蒙自 661199;2.云南省高校农作物优质高效栽培与安全控制重点实验室,云南蒙自 661199)
奶牛乳房炎是奶牛高发病之一,极大地影响了奶牛业发展[1],根据临床表现可分为临床型、非临床型2种。其中,非临床乳房炎即隐性乳房炎,最主要是奶牛隐性乳房炎[2],导致奶牛隐性乳房炎的病原菌主要有金黄色葡萄球菌、大肠杆菌、无乳链球菌等,其中大肠杆菌较为重要[3]。目前,奶牛乳房炎的治疗主要靠抗生素,但是经过时间积累,大量使用或者滥用抗生素现象较为突出,导致抗生素大量残留在奶牛体内,最终导致其产生耐药菌株[4]。因此,尽早诊断出导致奶牛隐性乳房炎的病原菌,对人类健康和经济发展至关重要[5]。奶牛隐性乳房炎不仅给奶牛养殖业带来了巨大经济损失,而且牛奶也因为奶牛患病而使其营养价值下降,甚至当人类食用带有病原菌的牛奶后会给人类健康带来巨大威胁[6-7]。本研究在生理生化初步鉴定的基础上,提取病原菌DNA,设计特异性引物,通过分子生物学方法检测奶样中大肠杆菌16S rRNA,并与GenBank中发表的16S rRNA序列进行比较,以便建立一种检测奶样中大肠杆菌的分子生物学方法。
1 材料与方法
1.1 材料
经过生理生化鉴定的大肠杆菌为笔者所在实验室从奶样中分离保存。
1.2 细菌培养
在超净工作台中,将经过生化鉴定并进行纯化培养后初步确定的大肠杆菌接种到LB培养液中,再将培养液放置在37 ℃、150 r/min的摇床中培养24 h后提取细菌DNA。
1.3 细菌DNA提取
应用CTAB结合SDS法提取大肠杆菌DNA,取5 μL进行琼脂糖凝胶电泳检测DNA含量。
1.4 大肠杆菌16S rRNA的PCR扩增
根据GenBank上发表的大肠杆菌16S rRNA序列(NC002695),应用Primier premier 5 引物设计软件设计1对特异性引物,引物序列如下:P1,5′-GAATCACAAAGT GGTAAGCGC-3′;P2,5′-TCGAACAATAACAGGAAACAGC-3′,以提取的细菌DNA为模板进行PCR扩增,反应条件如下:95 ℃预变性5 min;94 ℃变性1 min,49.7 ℃退火1 min,72 ℃延伸100 s,28个循环;72 ℃延伸10 min,4 ℃保存,取5 μL样品进行琼脂糖凝胶电泳检测。
1.5 PCR产物的测序和分析
将PCR扩增产物送到深圳华大基因科技服务有限公司,完成正反测序,序列结果运用DNAStar软件进行同源性分析。
2 结果与分析
2.1 细菌DNA的提取
细菌DNA经CTAB结合SDS法提取后于1%琼脂糖凝胶电泳检测,结果表明,细菌DNA约为21 000 bp(图1)。

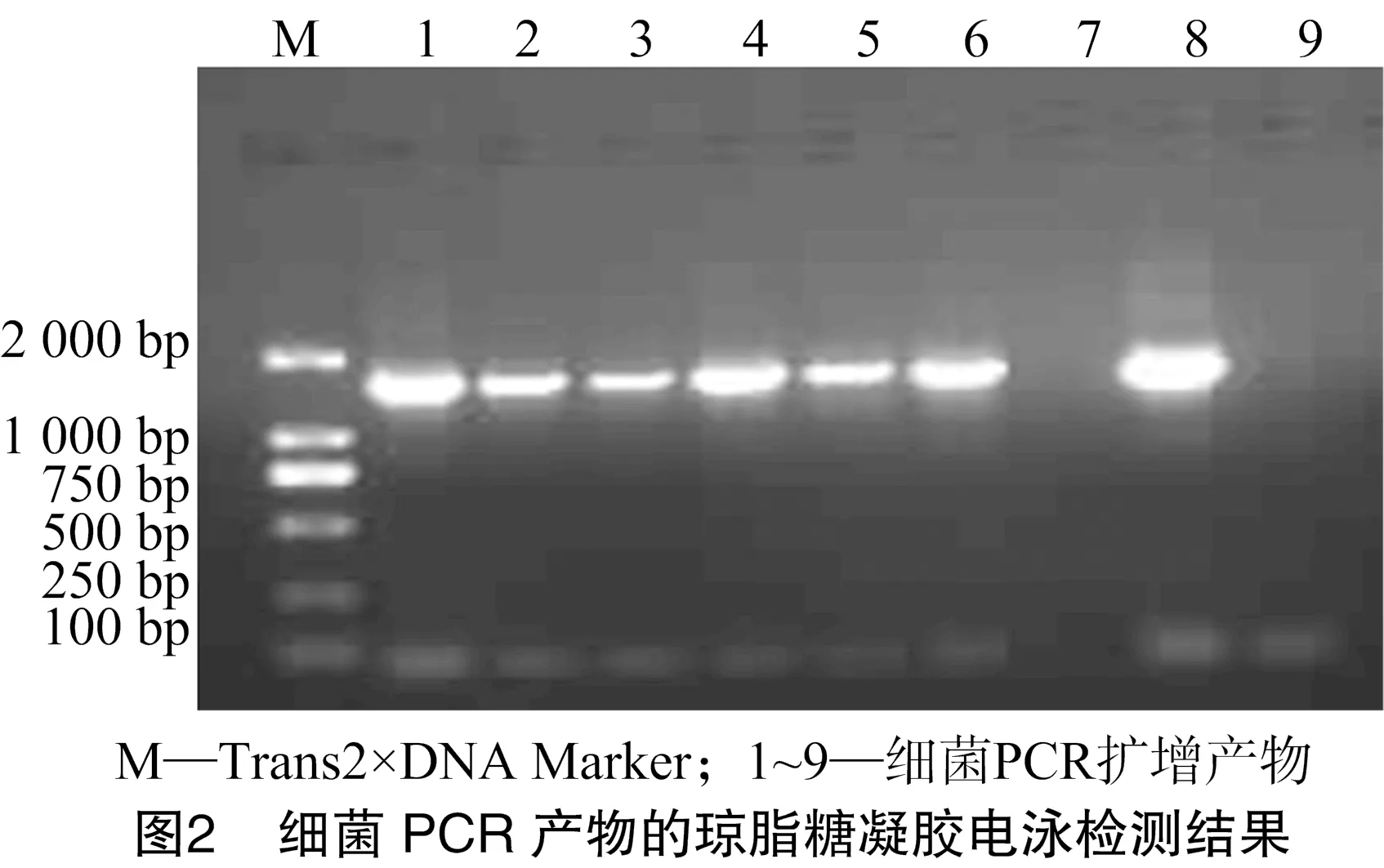
2.2 PCR产物的琼脂糖凝胶电泳
PCR产物经1%琼脂糖电泳检测,结果见图2,从图2可以看出,PCR产物约为1 400 bp,与预测结果一致。
2.3 序列同源性对比
PCR产物经测序后,将测序结果与GenBank中大肠杆菌16S rRNA基因序列(NC002695)进行同源性对比分析,发现二者序列相似性为96%,同源性对比结果见图3。
3 讨论与结论
细菌基因组DNA提取方法较多,有SDS法、CTAB法[8]、传统DNA抽提法、加热煮沸发、试剂盒抽提法、chelex 100法。 本研究利用SDS、CTAB混合法提取细菌基因组DNA,通过琼脂糖凝胶电泳检测可看到细菌DNA提取过程中无污染,琼脂糖凝胶条带中无拖尾现象,说明细菌提取的基因组DNA较为完整。

16S rRNA基因是细菌染色体上编码rRNA相对应的DNA序列,存在于所有细菌的染色体基因组中,具有较高的保守性,由于16S rRNA基因核苷酸序列总长度适宜,结构完整,更便于对细菌进行各种研究。因此设计一对引物,以 16S rRNA 为靶分子在适当条件下进行PCR扩增,便得到扩增后的16S rRNA片段,将扩增后的16S rRNA基因序列与基因库中的片段比对,便可以知道未知菌与其他菌的同源性,从而完成对菌的鉴定。
[1]李永安.奶牛乳房炎病原菌的分离鉴定及防制研究[D].武汉:华中农业大学,2005.
[2]程振涛.奶牛隐性乳房炎的诊断方法与细菌学研究[D].贵阳:贵州大学,2006.
[3]苏俊强,王建亮,梁海锋,等.奶牛隐性乳房炎发生规律探讨[J].湛江海洋大学学报,2002,22(6):65-68.
[4]闫常平.奶牛隐性乳房炎病原菌的分离鉴定及药敏试验[D].哈尔滨:东北农业大学,2003.
[5]高会玲.双抗体夹心ELISA检测奶牛隐性乳房炎的研究[D].长春:吉林农业大学,2007.
[6]尹柏双,王秋竹,付连军,等.隐性乳房炎奶牛乳清中部分酶活性变化[J].江苏农业科学,2016,44(7):276-277.
[7]罗志尧,陈天来.奶牛隐性乳房炎大肠杆菌的鉴定与药敏试验[J].江西畜牧兽医杂志,2013(4):11-14.
[8]周 彪,郭政宏,严亨秀.藏猪粪便芽孢杆菌基因组DNA的提取方法[J].江苏农业科学,2016,44(4):93-95.

