TaGW2-6A等位变异对青海省小麦育成品种千粒重的影响
李 娜,曹 东,陈文杰,张 波,刘宝龙,张怀刚
(1.青海省作物分子育种重点实验室,青海西宁810001; 2.中国科学院大学,北京 100039;3.中国科学院高原生物适应与进化重点实验室,青海西宁810001)
千粒重、穗粒数和单位面积穗数是小麦产量构成的三要素。提高小麦粒重是提高产量的重要途径之一,而粒长和粒宽是影响小麦籽粒大小的重要因素,同时也对小麦粒重和产量也有很大影响,且籽粒大小也是驯化和育种过程中的一个重要目标性状[1-2]。在我国小麦育种历史中,小麦千粒重在我国不同小麦生态区,由于栽培条件和气候等的不同,小麦产量的要素构成及在产量中所占的比重各不相同,与其他重要农艺性状和产量性状相比,小麦粒重在我国小麦的主要生态区均被不同程度地正向选择和提高。
GW2 基因是控制作物粒重的主效功能基因,对粒重具有较大的贡献[3]。目前,Song等[4]、姜 颖等[5-6]和周 进[7]从水稻、拟南芥、玉米和大麦中均克隆出 GW2 基因,通过分析得出该基因能够有效地控制粒重,进而影响产量。在小麦中,前人通过同源克隆法鉴定了一个与水稻 GW2 基因同源并控制小麦粒重的 TaGW2 基因,将该基因定位到6A染色体上,并根据大粒和小粒 TaGW2-6A启动子区存在的序列差异,开发了以TaqⅠ限制性内切酶为工具的CAPS(cleaved amplified polymorphic sequence)标记,该标记是 TaGW2-6A的理想共显性标记,能产生大小为167 bp和218 bp的两种片段,能很好地区分Hap-6A-A和Hap-6A-G两种等位变异[8]。Su等[8]和韩利明等[9]的研究结果表明,Hap-6A-A是优异等位变异,千粒重比Hap-6A-G高3 g。但是,Zhang等[10]的研究表明,Hap-6A-G是优异等位变异,其千粒重比Hap-6A-A高8.09 g。同样相互矛盾的结果出现在RNAi干扰降低Hap-6A的基因表达试验中。Bednarek等[11]研究认为,RNAi干扰技术可以降低 TaGW2 的转录水平,与对照株系相比,转基因株系籽粒显著减小。敲除 TaGW2-6A后引起胚乳细胞数显著减少。而Hong等[12]认为 TaGW2-6A的表达量降低显著增加了籽粒宽度和重量, TaGW2-6A负调节小麦的千粒重。通过总结前人研究结果得出, TaGW2-6A基因可能具有正向调控[11]或者负向调控[8,10,12-14]粒重的作用。这些结果的差异很有可能是由于受到材料种植的地理环境的影响所造成的。另外,寇 程等[3]利用高分辨率熔解曲线分析技术(high resolution melting curve analysis,HRM),检测了316份小麦材料中 TaGW2-6A基因启动子区Hap-6A-A和Hap-6A-G两种等位变异,且该方法重复好,准确率高,为更加高效准确地检测 TaGW2-6A基因等位变异奠定了基础。
柴达木盆地海拔2 600~3 000 m,具有独特的生态气候条件,海拔高,云量少,日照时间长,常年干旱少雨,但可以利用充足的地表水和地下水进行春小麦的生产,是典型的高原绿洲农业区。由于该地区昼夜温差较大,有利于小麦光合产物的积累,且中午温度在光合作用适宜温度之内,不会出现“午休”现象[15-16],因而小麦产量较高,春小麦产量在50.0×103~56.7×103kg·hm-2的现象较为普遍,有记录的60.0×103kg·hm-2以上的高产试验与示范达到30余次,并且有4次达到66.7×103kg·hm-2的水平,创造了我国及世界春小麦的高产纪录[17]。在该地区条件下,有关 TaGW2-6A基因的等位变异对千粒重的影响尚未见报道。本研究以64份青海育成小麦品种为材料,测定了它们在柴达木盆地的典型高产区青海省海西州香日德农场生态条件下的千粒重,利用Hap-6A-P1/P2分子标记检测这些品种中 TaGW2-6A基因的等位变异,评价这些等位变异对青海省小麦育成品种千粒重的影响。
1 材料与方法
1.1 试验材料
64份小麦品种是自1957年至2009年在青海省审定的品种(表1),现保存于中国科学院西北高原生物研究所农业研究中心。
1.2 试验方法
1.2.1 田间试验设计
试验材料于2010-2012年种植于青海省海西州香日德农场,采用随机区组设计。每个品种设3个重复,每个重复种植2行,行长2 m,行距20 cm,每行30粒种子,常规田间管理。待成熟后,收获并进行千粒重测定。
1.2.2 TaGW2-6A等位变异的检测
将新鲜小麦叶片用液氮冷冻研磨,粉末放入灭菌的2.0 mL Eppendorf管中,用CTAB法提取基因组DNA。DNA浓度用紫外分光光度计测定,纯度用琼脂糖凝胶电泳鉴定。
Hap-6A-P1和Hap-6A-P2的引物序列参照Su等[8]方法,其中,Hap-6A-P1的引物序列为:5′-GTTACCTCTGGTTTGGGTGTCGTG-3′(正向引物),5′-ACCTCTCGAAAATCTTCCCAAT TA-3′(反向引物); Hap-6A-P2的引物序列为: 5′-AGAAAGGGCTGGTGCTATGGA-3′(正向引物),5′-TAACGCTTGATAAACATAGGTA AT-3′(反向引物),均由北京六合华大基因股份有限公司合成。TaqⅠ限制性内切酶购自赛默飞世尔科技公司(Thermo Fisher Scientific)。第二轮 PCR 产物测序由北京六合华大基因股份有限公司完成。Hap-6A-P1/P2引物的反应体系和循环程序参照韩利明等[9]的方法并略作改动:分两步扩增,首先用Hap-6A-P1引物扩增,反应体系为20 μL,包括120 μmol·L-1dNTPs、每条引物4 pmol、100 ng的DNA、TaqDNA聚合酶1 U、2 μL 10×buffer、12.3 μL ddH2O。反应程序:95 ℃ 预变性4 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。第一轮PCR扩增完成后,电泳检测出大小约1 kb的条带。用Hap-6A-P2引物进行第二轮扩增,反应体系为25 μL,包括125 μmol·L-1dNTPs、每条引物5 pmol、TaqDNA聚合酶1.25 U、2.5 μL 10×buffer、16.4 μL ddH2O。将第一轮PCR产物适当稀释后,作为第二轮PCR反应的模板。反应程序:95 ℃预变性4 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。扩增完毕后用限制性内切酶TaqⅠ(按产品说明操作)酶切第二轮PCR扩增产物,PCR产物和酶切片段分别用1.5%和2.0%的琼脂糖电泳分离。
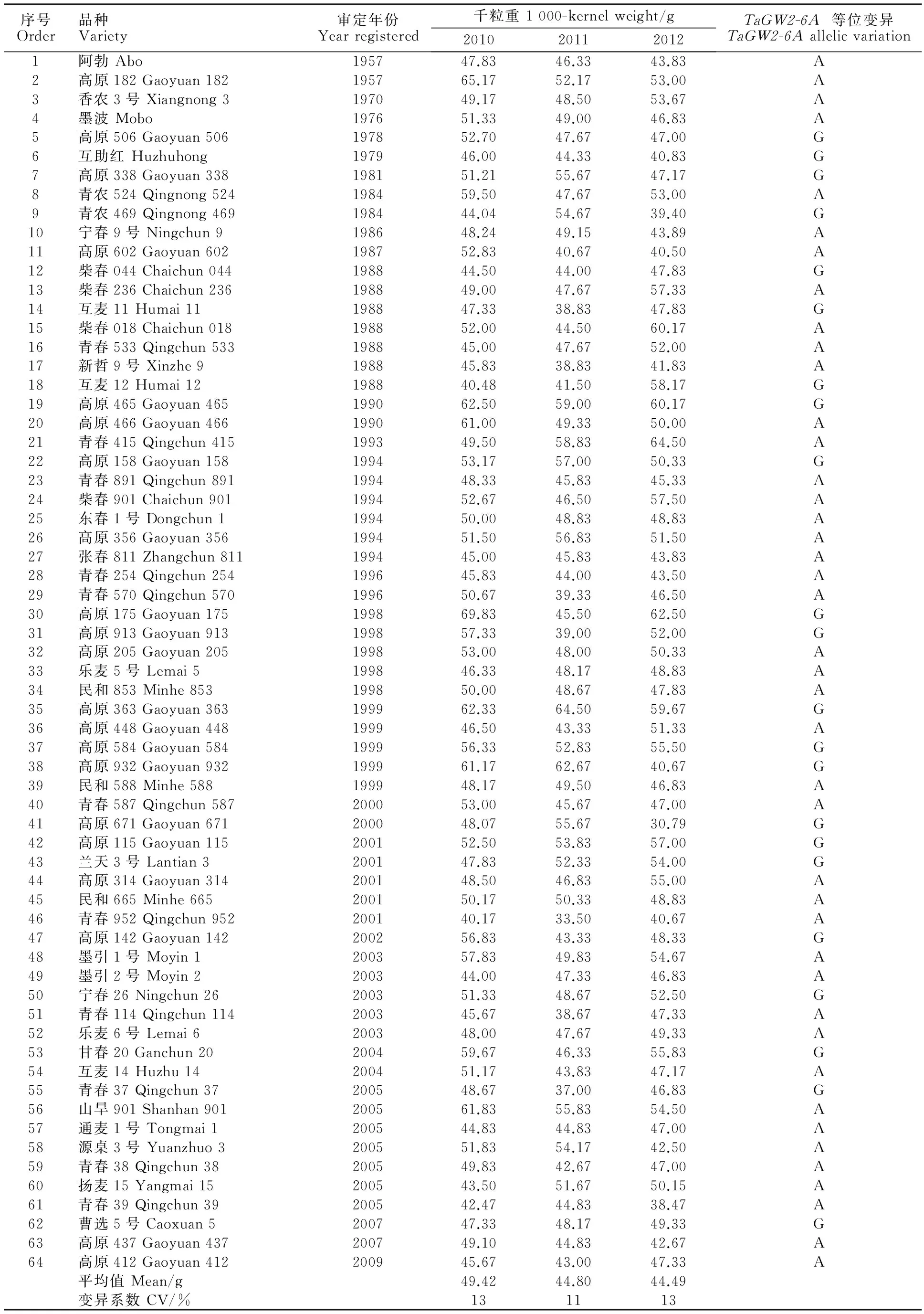
表1 64份供试小麦品种的千粒重及 TaGW2-6A基因的等位变异类型Table 1 1 000-kernel weight and TaGW2-6A allelic variations of the 64 tested wheat varieties
2 结果与分析
2.1 青海小麦育成品种的千粒重分布
64份青海小麦育成品种的千粒重如表1所示,三年平均值为46.24 g,千粒重超过60 g的育成品种分别是高原182和高原465,其中,高原182的千粒重于2010年达到65.7 g。从变异系数来看,千粒重的变异系数较大(11%~13%),表明64份小麦品种的千粒重遗传变异大。
2.2 TaGW2-6A等位变异在育成品种中的分布
Hap-6A-P1/P2标记可以有效地鉴定Hap-6A-A/G等位变异。等位变异Hap-6A-A酶切出了167 bp小片段,而等位变异Hap-6A-G酶切出了218 bp大片段(图1),其原因是小粒品种的第2轮PCR产物中有3个限制性内切酶TaqⅠ的酶切位点(该酶的识别序列为TCGA),所以酶切后产生167 bp的小片段,而大粒品种中第三个酶切位点的第4个碱基发生了单碱基变异(A→G),TaqⅠ内切酶不识别TCGG序列,从而导致第三个酶切位点缺失,仅存在两个酶切位点,产生了218 bp的大片段。在64个品种中检测到40个(62.5%)Hap-6A-A等位变异,24个(37.5%)Hap-6A-G等位变异(表1)。

M:Maker;1:高原437;2:高原412;3:青春533;4:高原256;5:高原182;6:瀚海304;7:青春254;8:高原338。
M:Maker ;1:Gaoyuan 437;2:Gaoyuan 412;3:Qingchun 533;4:Gaoyuan 256;5:Gaoyuan 182;6:Hanhai 304;7:Qingchun 254;8:Gaoyuan 338.
图1青海小麦品种中TaGW2-6A基因的Hap-6A-P1/P2标记分析
Fig.1PolymorphismanalysisbymarkersHap-6A-P1/P2ontheTaGW2-6AgeneinthewheatcultivarsofQinghaiprovince
2.3 TaGW2-6A等位变异对千粒重的影响
单倍型为Hap-6A-G的品种,2010-2012年平均千粒重分别为52.78、49.66和47.54 g,而单倍型为 Hap-6A-A 的材料,千粒重仅为49.37、46.62和43.37 g,分别相差3.41、3.04和4.17 g,且差异显著(图2)。Hap-6A-G单倍型品种3年的千粒重平均值为49.99 g,而Hap-6A-A单倍型材料的平均值为46.46 g,相差3.54 g。总体而言,在青海省育成品种中,Hap-6A-G是一个优异等位变异,但不是所有具有Hap-6A-G等位变异的材料都有高的千粒重,也不是所有的Hap-6A-A等位变异的材料都是低千粒重的。千粒重是一个数量性状,受多个基因的影响,在其他位点也可能影响千粒重的形成。

图柱上方不同字母代表差异在0.05水平显著。
Different letters above columns indicated significant difference at 0.05 level.
图2青海小麦品种中Hap-6A-A和Hap-6A-G单倍型的千粒重分析
Fig.21000-grainweightanalysisofHap-6A-AandHap-6A-GhaplotypesinwheatcultilarsofQinghaiprovince
3 讨 论
本研究以64份青海省小麦品种为试验材料,统计分析了这些小麦品种的千粒重表型数据,并通过Hap-6A-P1/P2 功能标记鉴定了Hap-6A-A和Hap-6A-G两种单倍型,统计其在青海小麦品种的分布及分析其与千粒重的关系。已有研究表明,等位变异Hap-6A-A在澳大利亚、中国和俄罗斯的品种中占优,而Hap-6A-G是美国、CIMMIT和欧洲的优势等位变异。Su等[8]以265份小麦种质资源为材料,对 TaGW2-6A基因等位变异进行鉴定并与籽粒千粒重进行相关分析得出,单倍型为Hap-6A-A的品种千粒重显著高于单倍型为Hap-6A-G的材料,说明Hap-6A-A为优异等位变异。Zhang等[10]利用2个遗传群体和1个自然群体为试验材料,对 TaGW2-6A基因等位变异进行鉴定并与籽粒千粒重进行相关分析得出,Hap-6A-G单倍型是优异的变异类型。而我们通过对青海小麦品种中 TaGW2-6A基因等位变异鉴定并结合千粒重表型数据得出,单倍型为Hap-6A-G的品种千粒重显著高于单倍型为Hap-6A-A的品种,说明青海省育成品种中Hap-6A-G等位变异占有绝对优势,在柴达木地区Hap-6A-G是千粒重的优异等位变异,这与Zhang等[10]的研究结果一致,而与Su 等[8]和韩利明等[9]得到的Hap-6A-A是优异等位变异不同。另外,千粒重被多基因所控制,且受不同环境的影响。张新业[18]认为Su等[8]和韩利明等[9]的试验材料种植在中国农业科学院作物科学研究所河南省洛阳试验站,导致含有Hap-6A-G的材料未能正常成熟,从而造成千粒重降低。在小麦整个生育期完全正常的情况下,Hap-6A-G是一个优异等位变异。
Hap-6A-G和Hap-6A-A等位变异除了调节千粒重外,还能够调节小麦的开花期和收获时间。韩利民等[9]研究发现,在 TaGW2-6A位点携带Hap-6A-A等位变异的材料,主要为春性和弱冬性小麦品种,而冬性和强冬性品种中Hap-6A-G分布较为广泛。携带Hap-6A-A等位变异的品种具有相对早熟性状,在青海地区,早熟性状有利于获得高产小麦,因为在青海东部农业区,晚熟会导致后期的高温胁迫,而在西部农业区,晚熟又会导致霜冻,从而影响产量。青海的育种者在选择早熟性状的过程中,很有可能优先选择了Hap-6A-G等位变异,从而导致在青海地区Hap-6A-G等位变异占优势地位。本研究通过对 TaGW2-6A基因等位变异的鉴定,筛选出在青海小麦品种的优异变异单倍型,为运用分子标记辅助选择手段来培育高产新品种奠定基础,并可为选配亲本提供理论基础,加速青海小麦高产育种的速度。
[1]BOTWRIGHT T L,CONDON A G,REBETZKE G J,etal.Field evaluation of early vigor for genetic improvement of grain yield in wheat [J].AustralianJournalofAgriculturalResearch,2002,53(10):1137.
[2]PENG J,RONIN Y,FAHIMA T,etal.Domestication quantitative trait loci inTriticumdicoccoides,the progenitor of wheat [J].ProceedingsoftheNationalAcademyofSciences,2003,100(5):2489.
[3]寇 程,高 欣,李立群,等.小麦粒重基因 TaGW2-6A等位变异的组成分析及育种选择[J].作物学报,2015,41(11):1640.
KOU C,GAO X,LI L Q,etal.Composition and selection of TaGW2-6A alleles for wheat kernel weight [J].JournalofTriticeaeCrops,2015,41(11):1640.
[4]SONG X J,HUANG W,SHI M,etal.A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase [J].NatureGenetics,2007,39(5):623.
[5]姜 颖.一个玉米RING蛋白基因克隆和功能分析[D].哈尔滨:黑龙江大学,2010.
JIANG Y.Cloning and function analysis of ZmGW2,a RING-domain protein [D].Harbin:Heilongjiang University,2010.
[6]姜 颖,曹言勇,路运才,等.拟南芥中RING型E3泛素连接酶基因 AtGW2的克隆和功能分析[J].植物遗传资源学报,2011,12(3):448.
JIANG Y,CAO Y Y,LU Y C,etal.Cloning and functional analysis ofArabidopsisthalianaAtGW2,a RING-type E3 ubiquitin ligase protein [J].JournalofPlantGeneticResources,2011,12(3):448.
[7]周 进.大麦BAC文库三维混合池的构建与 基因筛选[D].武汉:武汉轻工大学,2012:5.
ZHOU J.Three-dimensional pooling and HvGW2 gene screening of barely(HordeumvulgareL.) BAC Library [D].Wuhan:Wuhan Polytechnic University,2012:5.
[8]SU Z Q,HAO C Y,WANG L F,etal.Identification and development of a functional marker of TaGW2 associated with grain weight in bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2011,122(1):211.
[9]韩利明,杨芳萍,夏先春,等.株高、粒重及抗病相关基因在不同国家小麦品种中的分布[J].麦类作物学报,2011,31(5):824.
HAN L M,YANG F P,XIA X C,etal.Distribution of genes related to plant height,kernel weight and disease resistance among wheat cultivars from major countries [J].JournalofTriticeaeCrops,2011,31(5):824.
[10]ZHANG X,CHEN J,SHI C,etal.Function of TaGW2-6A,and its effect on grain weight in wheat(TriticumaestivumL.) [J].Euphytica,2013,192(3):347.
[11]BEDNAREK J,BOULAFLOUS A,GIROUSSE C,etal.Down-regulation of the TaGW2 gene by RNA interference results in decreased grain size and weight in wheat [J].JournalofExperimentalBotany,2012,63(16):5945.
[12]HONG Y,CHEN L,DU L P,etal.Transcript suppression of TaGW2,increased grain width and weight in bread wheat [J].Functional&IntegrativeGenomics,2014,14(2):341.
[13]JAISWAL V,GAHLAUT V,MATHUR S,etal.Identification of novel SNP in promoter sequence of TaGW2-6A associated with grain weight and other agronomic traits in wheat(TriticumaestivumL.) [J].PLoSOne,2015,10(6):371.
[14]YANG Z H,BAI Z Y,LI X L,etal.SNP identification and allelic-specific PCR markers development for TaGW2,a gene linked to wheat kernel weight [J].TheoreticalandAppliedGenetics,2012,125(5):1057.
[15]权文利,刘 莉,连利叶,等.青海高原春小麦光合日变化及水分利用效率比较[J].西北农业学报,2014,23(4):9.
QUAN W L,LIU L,LIAN L Y,etal.Comparison between on diurnal photosynthesis changes and water use efficiency of spring wheat varieties in Qinghai plateau [J].ActaAgriculturaeBoreali-OccidentalisSinica,2014,23(4):9.
[16]高亚婷,刘登才,张怀刚,等.小麦重要农艺性状在四川和青海两地的表型变异规律[J].西北农业学报,2013,22(2):18.
GAO Y T,LIU D C,ZHANG H G,etal.The differences of major phenotypic traits of wheat caused by different environments in Sichuan and Qinghai [J].ActaAgriculturaeBoreali-OccidentalisSinica,2013,22(2):18.
[17]程大志.柴达木盆地春小麦高额丰产的生态生理特点及栽培技术[M]//卢良恕.中国小麦栽培研究新进展.北京:农业出版社,1993:327.
CHENG D Z.The physiological and ecological characteristics and cultivation techniques of spring wheat in Qaidam Basin [M]//LU L S.New progress of wheat cultivation in China.Beijing:Agriculture Press,1993:327.
[18]张新业.小麦粒重基因 TaGW2-6A的功能验证及粒重相关性状的QTL分析[D].泰安:山东农业大学,2013:2.
ZHANG X Y.Functional identification of TaGW2-6A and QTL analysis for kernel weight related traits [D].Tai’an:Shandong Agricultural University,2013:2.

