小麦花药液体漂浮离体培养体系的建立与应用
赵林姝,何子伟,刘 丽,古佳玉,谢永盾,郭会君,赵世荣,李军辉,熊宏春,丁玉萍,刘录祥
(1.中国农业科学院作物科学研究所/国家农作物航天诱变技术改良中心/作物分子育种国家工程实验室,北京 100081;2.西澳基础工业和农村发展部农业和食品司粮食研发处双单倍体育种实验室,澳大利亚珀斯 6151)
花药培养技术在品种选育、DH遗传群体构建、突变体创制及转基因研究中发挥着重要作用[1-7]。自20世纪70年代初首次通过花药离体培养方法诱导出小麦花粉植株以来[8-9],各国研究人员通过对小麦花药离体培养条件和培养方法等深入细致的研究,建立了比较成熟的花药离体培养体系并广泛应用[10-13]。
小麦花药离体培养过程中的脱分化阶段有固体培养和液体漂浮培养两种方式。花药液体漂浮离体培养技术是在单细胞水平上获得纯系的培养方法,既具有固体培养方法操作简便的优势,同时又解决了固体培养方法中存在的细胞壁及其他组织干扰的问题,利用此方法培养的花药在离体培养过程中会释放成千上万个小孢子到液体培养基中,且释放的花粉小孢子无损伤,因此具有产生更多花粉苗的潜力。研究表明,液体漂浮培养方式具有较好的愈伤诱导及分化效果[14-15]。Broughton[16]建立了一套适于澳大利亚春小麦花药离体培养的液体诱导培养基(LIM,Liquid induction medium)及花药培养程序,利用此方法对10个生产上广泛应用的春小麦品种进行花药离体培养,结果表明,10个品种中有9个能再生出绿苗,绿苗产率变异范围为0.00%~56.90%,其中50%品种的绿苗产率高于5%;该实验室利用此套液体漂浮离体培养体系,结合温室加代的种植模式,每年可生产2万余花粉植株。
目前,国内各实验室小麦花药离体培养过程中的脱分化阶段基本是利用固体培养方式,不同研究团队采用的培养基不同,主要是C17[17]、W14[18]、癸培养基[19]三种,例如本研究团队以C17培养基为主[20],韩晓峰等[21]及王成社等[22]则以W14培养基为主,河南农科院小麦所研制的癸培养基适用于黄淮麦区小麦花药培养的脱分化培养[19]。为研究小麦花药液体漂浮离体培养体系的培养效果,本研究团队抑利用Sue[16,23]建立的液体培养体系,对部分冬小麦品种(系)进行花药离体培养,并对幼穗低温预处理的效果进行研究,以探讨该花培体系用于我国小麦品种(系)离体培养的可行性,为寻找高效的小麦花药离体培养体系提供参考。
1 材料与方法
1.1 试验材料
供试材料为本研究团队保存的小麦品种(系)Pavons、Chris、矮抗58、周麦18、H307、H341S、石4185及S6123,于2016年盆栽于中国农业科学院作物科学研究所北圃场温室,生长期温度控制在16~30 ℃之间,苗期施缓释肥一次,全生育期防治蚜虫及白粉病。
1.2 花药培养
选取花粉粒发育至单核中晚期(一般在打苞期,穗子尚未露出旗叶叶鞘时)的小麦幼穗,接种前将穗子剥出,用2%次氯酸钠灭菌30 min,超净台中无菌蒸馏水冲洗3~4次备用。液体漂浮离体培养的接种方法及培养基参照Broughton[16]的方法,固体培养为C17培养基[20]。
实验一:选取小麦品种(系)矮抗58、周麦18、H307、H341S、石4185及S6123的适期幼穗进行接种,研究液体漂浮培养及固体培养方法对小麦的培养效果。每个品种(系)6个穗子,每穗接种花药60枚。
实验二:选取小麦品种Pavons及Chris的适期幼穗,留茎秆10~15 cm,将幼穗放入装有水的烧杯中,锡箔纸包裹放入 4 ℃冰箱分别处理3 d、6 d、9 d、12 d、15 d、18 d,未进行低温预处理的幼穗作为对照,研究低温预处理对小麦花药液体漂浮离体培养特性的影响。每处理6个穗子,每穗接种花药60枚。
1.3 花药培养特性统计与数据分析
愈伤组织诱导率=(产生的愈伤组织块数/接种花药数)×100%;
绿苗分化率=(产生的绿苗数/转分化愈伤数)×100%;
绿苗产率=(产生的绿苗数/接种花药数)×100%;
白苗分化率=(产生的白苗数/转分化愈伤数)×100%;
白苗产率=(产生的白苗数/接种花药数)×100%。
用DPS统计软件进行各性状低温预处理间的多重比较分析(最小显著差异法,LSD),SigmaPlot软件绘制低温处理花培特性折线图,Excel进行平均值及标准误用的计算。
2 结果与分析
2.1 液体漂浮离体培养过程中小麦花药的脱分化及再分化
单核中晚期花药(图1A)接种于液体培养基后药壁开裂,其中小孢子散落到液体培养基中(图1B),利用血球计数板对接种3 d后的液体培养基中的小孢子数进行统计。结果显示,每毫升培养基中小孢子数可达到50 000左右。接种15 d后培养基中肉眼可见白色颗粒状物质,30 d可见脱分化形成的带有胚芽的胚状体(图1C);之后将胚状体转入再生培养基中进行分化培养,7 d左右可分化出苗(图1D),15 d后即可将分化出的苗进行生根培养。

A: 单核靠边期小孢子; B: 接种3 d后释放到液体培养基中的小孢子; C: 培养30 d产生的胚状体; D: 再生的绿色植株。
A: Microspores at the late uninucleate stage; B: Microspores released from the anther suspension cultured for 3 days; C: Embryos after 30 days of anther culture; D: Regenerated green plantlets.
图1小麦花药液体漂浮培养的脱分化及再分化
Fig.1Dedifferentiationandredifferentiationofanthersuspensioncultureinwheat
2.2 两种离体培养方式下不同小麦品种(系)的花药培养特性
由表1可以看出,液体漂浮离体培养(LIM)方式下,各被测指标在品种(系)间差异程度不同;固体培养(C17)方式下,被测指标中,愈伤组织诱导率、绿苗分化率及绿苗产率在品种(系)间差异程度不同。液体漂浮离体培养方式下,各品种(系)的愈伤组织诱导率、绿苗分化率、绿苗产率、白苗分化率和白苗产率变异范围分别为116.48%~633.33%、5.79%~95.42%、10.25%~274.29%、3.27%~80.95%及6.11%~111.03%;固体培养方式下,各品种(系)的愈伤组织诱导率、绿苗分化率、绿苗产率、白苗分化率和白苗产率变异范围分别为6.64%~31.44%、0.67%~70.02%、0.13%~16.39%、1.67%~14.92%及0.40%~2.11%。各被测指标液体漂浮培养方式品种(系)间的变异范围均高于固体培养方式。除了H307的白苗分化率表现为固体培养方式高于液体培养方式外,各品种(系)其他被测指标均表现出液体培养方式高于固体培养方式,所研究品种(系)液体漂浮培养方式的愈伤组织诱导率、绿苗分化率、绿苗产率、白苗分化率和白苗产率,分别是固体培养方式相应性状的3.70~94.95倍、1.24~8.65倍、2.54~149.54倍、2.93~36.11倍和4.77~219.63倍,说明液体培养方式较固体培养方式可获得更多的愈伤及绿苗,但同时也出现了较多的白苗。
除绿苗分化率在液体漂浮培养及固体培养两种培养方式下表现的品种(系)排序完全一致外,其他各性状在两种培养方式下表现较好的品种(系)并不完全一致。液体培养方式下花药脱分化形成愈伤能力表现最好的品种(系)是石4185,愈伤分化形成绿苗能力表现较好的品种(系)是H307、S6123和H341S,愈伤分化形成白苗较多的品种(系)是周麦18和石4185。花药分化形成绿苗能力表现较好的品种(系)是石4185和S6123,花药分化形成白苗最多的品种(系)是石4185。
2.3 不同低温预处理的花药离体培养特性
由图2、图3可以看出,低温预处理对小麦品种Pavons及Chris离体培养性状的影响各不相同。两个品种(系)幼穗的愈伤组织诱导率受低温预处理影响均较小,其中,将幼穗低温放置3 d和9 d的处理均与对照差异不显著;小麦品种Chris幼穗在低温处理6 d后愈伤组织诱导率也与对照没有显著差异,但小麦品种Pavons幼穗在低温处理6 d后愈伤组织诱导率显著低于对照,两个品种(系)幼穗低温预处理12 d、15 d和18 d后的愈伤组织诱导率显著降低;与绿苗分化相关的两个指标受低温处理影响较大,且低温处理后绿苗分化指标均表现下降的趋势,除了低温处理15 d的小麦品种Chris的幼穗绿苗产率与对照无显著差异外,两个品种(系)其他各低温处理的幼穗绿苗分化率和绿苗产率均显著低于对照;白苗分化率和白苗产率两个指标,与上述3个指标呈现相反的趋势,幼穗经低温预处理后白苗产率呈上升趋势,两个品种(系)间具有一定差异。小麦品种Pavons幼穗低温处理9 d和18 d时产生的白苗显著多于对照,其他各低温处理与对照差异不显著;小麦品种Chris除了低温处理9 d的幼穗与对照差异不显著外,其他各低温处理产生的白苗数均显著多于对照。

表1 不同小麦品种(系)的花药培养特性Table 1 Characters of cultured anthers from six different cultivars(lines) of wheat %
LIM:液体漂浮培养;C17:固体培养;同一列数据后的不同字母表示品种(系)间存在显著差异(采用LSD法,P<0.01)。
LIM:invitrosuspension culture; C17:The solid culture method; Means followed by different letters are significantly different among cultivars according to LSD test(P<0.01).
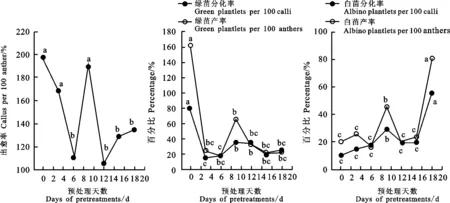
不同字母表示处理间存在显著差异(采用LSD 法,P<0.05)。下图同。
Means followed by different letters are significantly different among pretreatments according to LSD test(P<0.05).The same in figure 3.
图2低温预处理对小麦品种Pavons花培特性的影响
Fig.2Effectoflow-temperaturepretreatmentsontheanthercultureabilityofwheatPavons

图3 低温预处理对小麦品种Chris花培特性的影响
3 讨 论
3.1 花药液体漂浮培养方法用于小麦离体培养的可行性及应用前景
本研究对6个小麦品种(系)的花药液体漂浮离体培养特性的研究表明,各性状在不同品种(系)间均差异程度不同,说明品种(系)间的花药培养特性是有差异的,此结果与Broughton[16]的研究结果一致。6个品种(系)液体漂浮离体培养方法的出愈及绿苗分化能力均较好,其中,愈伤组织诱导率均高于116.48%,绿苗分化率均高于5.79%,绿苗产率均高于10.25%;说明液体漂浮离体培养方法用于国内小麦品种(系)花药培养是可行的。对液体漂浮培养及固体培养两种离体培养方法花培效果的比较研究结果表明,针对绿苗产率这一花药培养特性重要指标,各品种(系)的液体漂浮培养效果均好于固体培养方法,特别是对固体培养方法很难再生绿苗的品种(系)矮抗58(0.13%)和周麦18(0.33%),液体漂浮培养方法分别获得了19.44%和10.25%的绿苗产率,分别是固体培养方法的149.54倍和31.06倍。液体漂浮离体培养这一简便高效的花药离体培养技术有望在小麦单倍体育种工作中发挥更大作用。
本试验中,6个品种(系)均分化出较多的白苗,其中,花药分化形成绿苗能力较强的品种(系)石4185和S6123,白苗分化率均超过100%,分化绿苗能力最弱的品种(系)周麦18,其白苗产率也超过50%。但同样绿苗产率较高的品种(系)H307,其白苗分化率只有6.11%。因此,进一步探索影响白苗产生的因素,降低白苗产率,是下一步研究工作的重点。
3.2 低温预处理对小麦花培特性的影响
由于接种能力的限制,实际工作中常常会出现田间或温室取回的样品当天来不及进行接种的问题。小麦小孢子离体培养研究结果表明,幼穗经低温预处理4~5周可以提高小孢子离体培养过程中的胚状体及绿苗获得率[24]。为了探讨4 ℃低温预处理对小麦花药液体漂浮离体培养效果的影响,本试验选用6个低温预处理时间,对两个小麦品种Pavons及Chris开展了花药培养特性的研究,结果表明,两个品种(系)的幼穗对低温预处理的反应并不完全一致,总体来说,低温预处理对两个品种(系)的幼穗均表现出降低愈伤组织诱导率、绿苗获得率及增加白苗的趋势,说明低温预处理对小麦花药液体漂浮离体培养具有负效应。此结果与小麦小孢子培养[24]及固体培养方法[20-21]需要低温预处理不同,可能是由于本试验中对花药进行了5 d的甘露醇渗透压预处理。Chris的幼穗在15 d低温预处理时表现特殊,绿苗产率与对照差异不显著,此结果是否是品种(系)的效应还有待进一步验证。除了Chris 15 d低温预处理外,其他各低温处理的幼穗虽然绿苗产率显著低于对照,但均获得了一定数量的绿苗。因此,实际育种工作中出现无法在取样当天进行接种的情况时,将幼穗进行4 ℃低温保存后再进行接种也不失为一种解决办法。值得说明的是,本研究中低温预处理实验所用材料为春小麦品种,低温预处理对冬小麦品种花药离体培养特性的影响还有待进一步研究。
致谢:本实验中花药液体漂浮离体培养技术得到了西澳基础工业和农村发展部农业和食品司粮食研发处双单倍体育种实验室Sue Broughton的悉心指导,在此深表感谢。
[1]SZAREJKO I,FORSTER B P.Doubled haploidy and induced mutation [J].Euphytica,2007,158:359.
[2]MARIA A G.Anther culture for haploid and doubled haploid production [J].PlantCellTissueandOrganCulture,2011,104:283.
[3]CHAUHAN H,KHURANA P.Use of doubled haploid technology for development of stable drought tolerant bread wheat(TriticumaestivumL.) transgenics [J].PlantBiotechnologyJournal,2011,9:408.
[4]PLAMENOV D,BELCHEV I,DASKALOVA N,etal.Application of a low dose of gamma rays in wheat androgenesis [J].ArchivesofBiologicalSciences,2013,65(1):291.
[5]LANTOS C,WEYENJ,ORSINIJM,etal.Efficient application ofinvitroanther culture for different European winter wheat(TriticumaestivumL.)breeding programmes [J].PlantBreeding,2013,132:149.
[6]王 炜,杨随庄,叶春雷,等.丰产优质花培春小麦新品种——陇春31号[J].麦类作物学报,2014,34(3):432.
WANG W,YANG S ZH,YE CH L,etal.A high yield and good quality spring wheat variety Longchun 31 of anther culture method [J].JournalofTriticeaeCrops,2014,34(3):432.
[7]LANTOS C,PAUK J.Anther culture as an effective tool in winter wheat(TriticumaestivumL.) breeding [J].RussianJournalofGenetics,2016,52(8):794.
[8]欧阳俊闻,胡 含,庄家骏.小麦花粉植株的诱导及其后代的观察[J].中国科学(B辑),1973,24(1):72.
OUYANG J W,HU H,ZHUANG J J.Induction of pollen plants in wheat(TriticumaestivumL.) and preliminary observations on performance of their progenies [J].ScienceinChina(SeriesB),1973,24(1):72.
[9]朱至清,王敬驹,孙敬三,等.小麦花粉植株的诱导及其形态发生过程的研究[J].植物学报,1973,15(1):1.
ZHU ZH CH,WANG J J,SHUN J S,etal.Investigations on the induction and morphogenesis of wheat(TriticumaestivumL.) pollen plants [J].ActaBotanicaSinica,1973,15(1):1.
[10]SADASIVAIAH RS,PERKOVIC SM,PEARSON DC,etal.Registration of 'AC Andrew' wheat [J].CropScience,2003,44(2):696.
[11]KANG TJ,YANG MS,DECKARD EL.The effect of osmotic potential on anther culture in spring wheat(TriticumaestivumL.) [J].PlantCellTissueandOrganCulture,2003,75:35.
[12]REDHA A,SULEMAN P.Effects of exogenous application of polyamines on wheat anther cultures [J].PlantCellTissueandOrganCulture,2011,105:345.
[13]REDHA A,TALAAT A.Improvement of green plant regeneration by manipulation of anther culture induction medium of hexaploid wheat [J].PlantCellTissueandOrganCulture,2008,92:141.
[14]卫志明.小麦花粉液体培养成苗的试验[J].实验生物学报,1980,13(2):219.
WEI Z M.Experiment on shoot formation from wheat pollen by liquid culture [J].ActaBiologiacExperimentalisSinica,1980,13(2):219.
[15]陈兆驹.春小麦花药漂浮培养研究初报[J].沈阳农学院学报,1982,27(1):46.
CHEN Z J.A primary study on the anther floating culture of spring wheat [J].JournalofShenyangAgriculturalCollege,1982,27(1):46.
[16]BROUGHTON S.Ovary co-culture improves embryo and green plant production in anther culture of Australian spring wheat(TriticumaestivumL.) [J].PlantCellTissueandOrganCulture,2008,95:187.
[17]王 培,陈玉蓉.C17培养基在花药培养中应用的研究[J].植物学报,1986,28(1):38.
WANG P,CHEN Y R.A study on the application of C17medium for anther culture [J].ActaBotanicaSinica,1986,28(1):38.
[18]OUYANG J W,HE D G,FENG G H,etal.The response of anther culture to culture temperature varies with growth conditions of anther-donor plants [J].PlantScience,1987,49(2):145.
[19]海 燕,和现昌,黄冰艳,等.癸培养基的研制及在小麦花药培养中的应用研究[J].植物学报,1997,39(8):742.
HAI Y,HE X C,HUANG B Y,etal.Preparation of GUI culture medium and its application to wheat anther culture [J].ActaBotanicaSinica,1997,39(8):742.
[20]ZHAO L S,LIU L X,WANG J,etal.Development of a new wheat germplasm with high anther culture ability by using a combination of gamma-ray irradiation and anther culture [J].JournaloftheScienceofFoodandAgriculture,2015,95:121.
[21]韩晓峰,陶丽莉,殷桂香,等.基因型和环境条件对小麦花药培养效果的影响[J].作物学报,2010,36(7):1210.
HAN X F,TAO L L,YIN G X,etal.Effect of genotype and growing environment on anther culture in wheat [J].ActaAgronomicaSinica,2010,36(7):1210.
[22]王成社,李景琦,邹淑芳,等.小麦花培育种效率与从不同杂种世代取材的关系[J].遗传学报,2002,29(10):900.
WANG C S,LI J Q,ZOU S F,etal.Studies of the relationship between the reeding efficiency of anther culture and the use of different hybrid generations as anther donor plants in wheat [J].ActaGeneticaSinica,2002,29(10):900.
[23]BROUGHTON S.The application of n-butanol improves embryo and greenplant production in anther culture of Australian wheat(TriticumaestivumL.) genotypes [J].CropPastureScience,2011,62:814.
[24]AYED O S,BUYSER J D,PICARD E,etal.Effect of pre-treatment on isolated microspores culture ability in durum wheat(Triticumturgidumsubsp.DurumDesf.) [J].JournalofPlantBreedingandCropScience,2010,2(2):30.

