火眼金睛鉴别苏打两“兄弟”
王峰

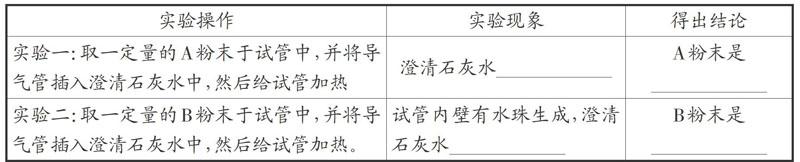
碳酸钠俗称苏打,碳酸氢钠俗称小苏打,两“兄弟”不仅学名、俗名相似,就连化学式和化学性质也极为相似。比如,它们的溶液都显碱性,都能与盐酸反应产生CO2气体等。那么如何鉴别碳酸钠和碳酸氢钠呢?请看下面两例的分析。
例1 小娜同学发现自家的厨房中有两瓶一大一小的无标签的白色粉末,妈妈告诉她是苏打和小苏打。为了鉴别这两瓶白色粉末,小娜分别各取一小包粉末并将它们编号为A、B,然后带到学校的实验室与小红、小慧两位同学进行实验探究。
【查阅资料】资料摘要如下:
苏打,学名碳酸钠,白色粉末或微小颗粒,加热至851℃时溶化而不分解,易溶于水,其水溶液呈碱性……
小苏打,学名碳酸氢钠,白色粉末,受热易分解生成碳酸钠、二氧化碳和水,在水中的溶解性比碳酸钠略小,其水溶液的碱性比碳酸钠溶液弱……
【实验探究】根据以上信息及学过的知识,三位同学各自设计的实验方案及探究过程如下:
小娜同学:取等量的A、B粉末分别完全溶于相同体积的蒸馏水中,根据溶液的pH鉴别出两种粉末。
(1)测得A的溶液pH = 10,B的溶液pH = 8,则A粉末是____________________。
(2)水溶液呈碱性的物质一定是碱吗?_______________(填“一定”或“不一定”)。
小红同学:将A、B两种粉末分别与盐酸发生反应,根据是否有气体生成鉴别出这两种粉末。你认为小红同学的实验方案__________(填“正确”或“不正确”),理由是_______________。
小慧同学:将A、B两种粉末分别加热,根据粉末是否分解及生成的产物鉴别出这两种粉末。她所用的实验装置如图1所示。
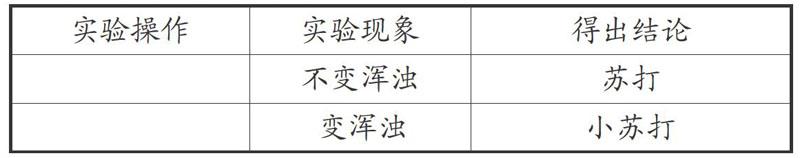
小慧同学设计的探究报告如下,请你帮她补充完整。
解析:(1)pH>7,溶液显碱性,且pH越大,碱性越强,结合题目信息不难判断,A粉末是苏打。
(2)从化学组成看,碳酸钠和碳酸氢钠均属于盐,但它们的水溶液却显碱性,可见,水溶液呈碱性的物质不一定是碱。
碳酸钠中含有CO32-,碳酸氢钠中含有HCO3-,它们与盐酸反应都有二氧化碳气体生成,化学方程式分别为:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑;NaHCO3 + HCl = NaCl + H2O + CO2↑。因此,用盐酸不能鉴别出Na2CO3和NaHCO3,小红同学的实验方案不正确。
由“查阅资料”可知,碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,因此加热碳酸氢钠能观察到大试管内壁有水珠生成,小试管内澄清石灰水变浑浊。而碳酸钠较稳定,加热至851℃也不分解,所以加热碳酸钠时澄清石灰水无明显现象。
答案:(1)苏打;(2)不一定,不正确,苏打和小苏打与盐酸反应都有二氧化碳气体生成。
[实验操作 实验现象 得出结论 不变浑浊 苏打 变浑浊 小苏打 ]
点拨:本题起点高,落点低,尽管课本中没有出现Na2CO3和NaHCO3热稳定性比较的知识,但只要通读全题,尤其是认真阅读“查阅资料”,就能发现Na2CO3和NaHCO3在化学性质上存在的差异,从而找到鉴别Na2CO3和NaHCO3的有效方法,并能在表格中补全Na2CO3和NaHCO3受热时的实验现象,顺利完成探究报告。
例2 某学习小组的同学在学习了Na2CO3、NaHCO3的性质后,了解到它们都能与盐酸反应产生CO2气体,那么如何鉴别Na2CO3和NaHCO3呢?带着这样的疑问,他们进行了下列探究:
【查阅资料】(1)Ca(HCO3)2可溶于水;(2)NaHCO3固体受热分解生成碳酸钠、二氧化碳和水。
【猜想】(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学认为可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
甲、乙两同学的猜想是依据澄清石灰水、CaCl2溶液分别与Na2CO3溶液反应均有沉淀产生;又知道Ca(HCO3)2可溶于水,因此猜测澄清石灰水、CaCl2溶液分别与NaHCO3溶液混合不会产生沉淀,从而鉴别出两种溶液。
(3)丙同学认为固体Na2CO3、NaHCO3可用加热的方法鑒别。
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
(2)乙同学将CaCl2溶液加入到分别盛有少量Na2CO3、NaHCO3溶液的试管中,发现两支试管中也都产生了白色沉淀,实验结果出乎意料,但根据观察到的其他实验现象,他认为仍可用CaCl2溶液鉴别Na2CO3和NaHCO3溶液。
(3)丙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图1):
①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊;
②加热NaHCO3时,观察到实验现象与①不同,证实了自己的猜想是合理的。
【问题讨论】(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中分离出不同离子的微观角度分析了原因(如图2、图3)。请写出Na2CO3与澄清石灰水发生反应的化学方程式:____________________;写出NaHCO3与澄清石灰水混合时参与反应的离子:_______________。
(2)在乙同学的两个实验中,大家对CaCl2和Na2CO3溶液的反应比较熟悉,该反应的化学方程式为_______________;而对CaCl2与NaHCO3溶液混合产生沉淀的现象难以理解,同学们又进一步查阅了资料,了解到CaCl2与NaHCO3溶液可发生如下反应:CaCl2 + 2NaHCO3 = CaCO3↓+ 2NaCl + CO2↑+ H2O,因而同学们知道了乙同学是通过观察_______________现象来鉴别Na2CO3和NaHCO3溶液的。
至于CaCl2与NaHCO3溶液为什么能发生上述反应,其反应原理较复杂,有待于今后学习中进一步探究。
(3)丙同学在加热Na2CO3固体时,开始产生少量气泡的原因是_________________________,据此分析,Na2CO3受热____________________分解(填“易”或“不易”)。在加热NaHCO3固体时,丙同学观察到的实验现象是_______________(任写一种)。
【拓展应用】
(1)固体Na2CO3中混有少量NaHCO3,可通过_______________方法除去。
(2)要除去Na2CO3溶液中混入的少量NaHCO3,可加入适量的____________________溶液。

