微针技术在透皮给药方向的研究进展
刘春晶,林福玉,刘金毅,童梅,高向东
1.中国药科大学 生命科学与技术学院,江苏 南京 210009;
2.北京三元基因药业股份有限公司(北京市长效干扰素工程技术研究中心),北京 102600
透皮给药是替代口服给药的一种重要给药方式,但是由于皮肤屏障的限制,只有一部分具有合适物理化学性质的分子能够被透皮吸收。微针(microneedles)作为一种透皮给药技术,近年来受到广泛关注。微针是能够穿透皮肤表皮层或上真皮层的一种一个或一排微米尺寸的针,通常直径几百微米,长度可达1000 μm,根据给药方式可以分为固体、包衣、空心或溶解微针4种类型。在美容领域,微针可以促进皮肤表皮细胞再生、提高产品成分渗透率[1],如德国Dermaroller公司的Dermaroller系列产品广泛应用于皮肤皱纹、红斑、水肿、色素沉着和瘢痕的预防与治疗。在诊断上,微针可以快速穿透皮肤采集微量血液/组织液,具有微量、安全、经济的优点,一项将微针用于潜伏性结核感染诊断的临床试验证明诊断微针具有安全性和有效性[2]。在治疗上,采用微针局部或系统给药,可用于纳曲酮、利多卡因、肾上腺素等低分子量药物及甲状旁腺激素、胰岛素等多肽及蛋白质药物的透皮输送。在疫苗方面,已有流感、狂犬病、卡介苗、西尼罗病毒和人乳头瘤病毒等微针疫苗的研究[3]。微针用于黄斑水肿、葡萄膜炎等眼科疾病给药[4]和细胞内传递DNA/RNA[5]等化合物的研究也取得了一定的进展。目前已被批准上市的微针给药产品只有BD Soluvia和MicronJet 600空心微针给药装置,其余产品如表1所示还处于临床研究阶段。我们在此主要介绍微针在疫苗、糖尿病和皮肤病等领域的临床试验成果及最新研究进展。
1 微针用于疫苗接种
1.1 微针流感疫苗
微针疫苗是微针研究进展最快的领域,目前已上市和处于临床研究阶段的微针疫苗多为针长为600~1500 μm的空心微针,主要因为空心微针可以通过控制针长、针内径和外加储药装置达到一定的给药流速和给药剂量。多篇文献报道微针疫苗与传统疫苗相比具有相近或更高的免疫原性。老年人、5岁以下儿童、孕妇和慢性疾病患者是季节性流感的易感人群,一项1107名年龄均在60岁以上的受试者参加的临床试验中,实验组使用近端有1.5 mm微针的预填充型装置皮内注射(ID)三价灭活流感疫苗,肌肉注射(IM)作为对照组。结果显示21 d内皮内注射组的特异性抗体几何平均滴度(GMT)、血清保护率、血清转化率均优于肌肉注射组,但局部反应更常见[6]。Intanza 9 μg是一种使用BD Soluvia微针注射系统进行皮内给药的三价流感疫苗,2009年被欧洲药品管理局(EMA)批准用于18~59岁成人流感预防,现已在40多个国家使用,该疫苗的不良反应包括超敏反应、发烧或急性感染[7]。一项为期3年的Ⅱ期临床试验比较了Intanza 9 μg与肌肉注射疫苗的免疫原性,结果显示Intanza 9 μg的安全性及反应原性符合相关标准,可诱导不劣于对照疫苗的免疫反应[8]。一项Ⅱ期临床试验表明接种Intanza 9 μg后1年抗体滴度仍然保持在基线以上[9]。Akihiro等[10]利用羟乙基淀粉70000与疫苗混合制备针长约430 μm的溶解型微针,评估H1N1、H5N1病毒粒子(VP)和全病毒颗粒(WVP)微针疫苗的效力,动物实验结果表明微针比皮下注射(SC)具有更高的免疫原性,WVP微针疫苗比VP微针疫苗诱导更高的抗体中和反应。微针疫苗具有更高的稳定性,易于储藏和运输。Intanza 9 μg可以在2~8℃避光条件下保存长达1年,Mat⁃thew等[11]证明精氨酸与葡萄糖酸盐溶解型微针中的三价流感疫苗可在25℃储存超过1年,该微针疫苗接种后引起的抗体滴度与新鲜疫苗相当。同时微针疫苗具有较高的患者接受度,在Intan⁃za 9 μg的Ⅲ期临床研究期间,1679名接种者中97%认为微针皮内注射引起的局部疼痛反应完全可以接受,94%的人认为可接受,总体来说受试者对微针疫苗感知良好[12]。
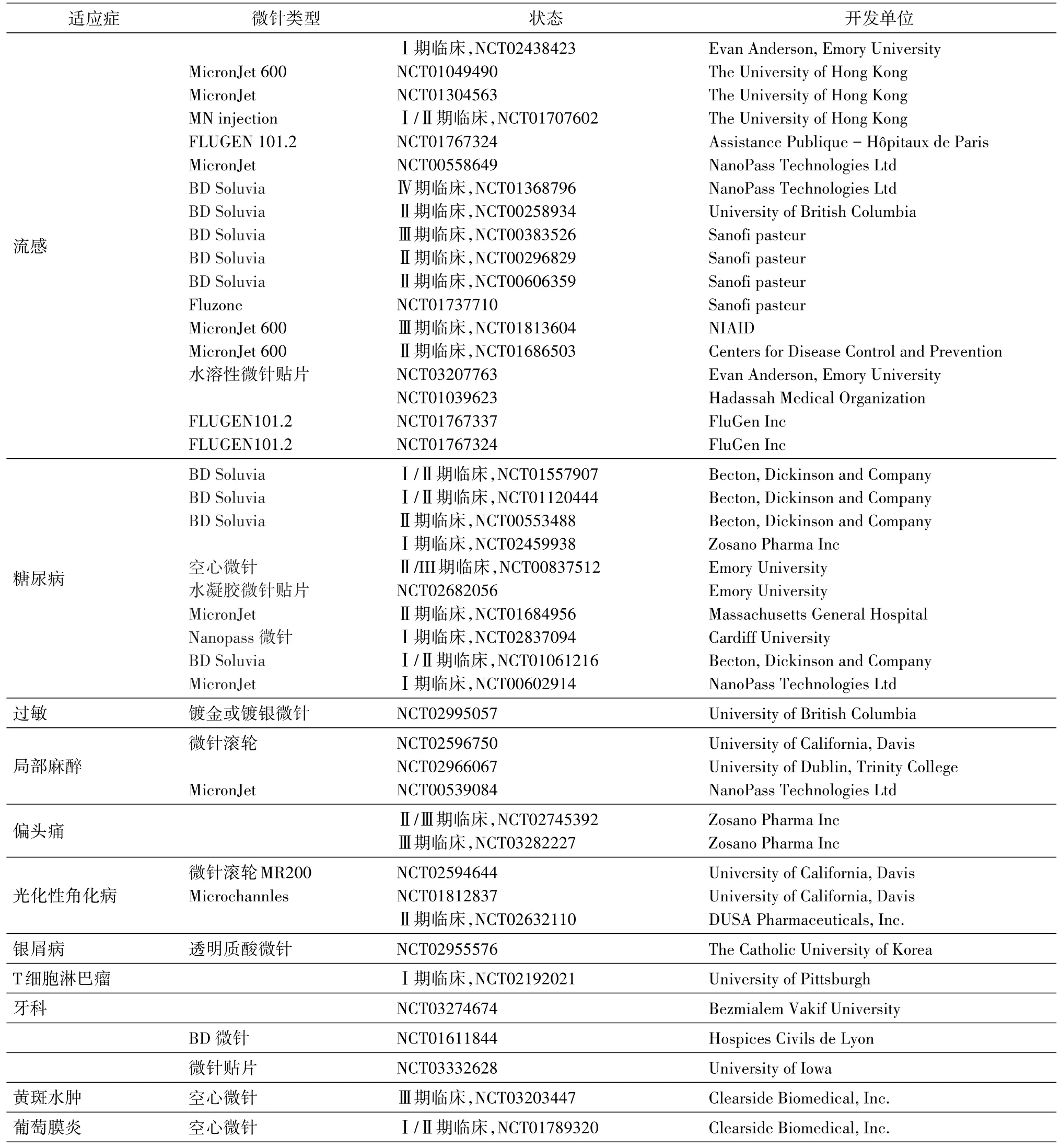
表1 处于临床研究阶段的微针给药产品
1.2 微针脊髓灰质炎疫苗
微针透皮给药不仅限于季节性流感的免疫治疗,研究显示微针疫苗能有效对抗多种病原体引起的疾病。接种脊髓灰质炎疫苗是预防脊髓灰质炎的有效手段,口服脊髓灰质炎疫苗(OPV)使用方便、价格低廉,但免疫原性较低且不稳定。活脊髓灰质炎疫苗(IPV)价格较高,目前在很多地区未能得到推广使用,降低IPV成本是脊髓灰质炎疫苗研究的热点方向。在一项临床试验中,231名免疫缺陷受试者按2∶2∶2∶1的比例分组(40%标准剂量皮内注射组,20%标准剂量皮内注射组,标准剂量肌内注射组,40%标准剂量肌内注射组),皮内接种使用NanoPass Micron⁃Jet 600微针装置,IPV给药后显示40%标准剂量皮内注射组与标准剂量肌内注射组疫苗反应原性相当,而皮内40%标准剂量组产生了更高的抗体滴度[13]。
1.3 微针基因疫苗
DNA疫苗接种已成为乳腺癌、卵巢癌、前列腺癌及宫颈癌等癌症的有效治疗策略[14]。RALAE6/E7纳米粒子(NPs)微针使用一种全新的30个氨基酸的阳离子肽递送序列(RALA)作为E6/E7 DNA的载体,载体与NPs结合后溶于聚乙烯吡咯烷酮(PVP)制备成E6/E7 DNA溶解型微针。接种MN/RALA-E6/E7 NPs比肌内注射RALA-E6/E7 NPs产生了更丰富的E6/E7特异性IgG,具有更高的T细胞介导的TC-1细胞毒性,并且小鼠血清含有更多的IFN-γ。MN/RALA-E6/E7 NPs在预防模型中延缓了肿瘤的发生,在治疗模型中减缓肿瘤生长,且效果均优于肌内注射[15]。Tang等[16]证明HPV16 E6 siRNA微针疫苗可以无痛、有效、安全地将siRNA递送到宫颈癌小鼠模型皮肤的特定区域,抑制肿瘤生长,该研究为宫颈癌的治疗提供了替代给药方法。
2 微针用于糖尿病治疗
2.1 空心微针胰岛素给药
2014年全球范围内约有4.22亿名成年人患有糖尿病,患病率较1980年上升了3.8%[17],微针作为替代胰岛素注射的一种给药方式被用于糖尿病治疗研究,目前大多数糖尿病微针都处于临床Ⅰ/Ⅱ期阶段,仅有一例报道的Ⅲ期临床试验(NCT00837512)。虽然临床试验中使用的微针、胰岛素的种类和剂量有所不同,但多项临床研究表明微针给药可达到治疗剂量,并且多具有较高的峰浓度(Cmax)、较短的达峰时间(Tmax)、疼痛感低于皮下或肌肉注射等优点。美国BD公司2015年的一项临床研究中28名1型糖尿病患者(T1DM)接受皮下和皮内胰岛素注射,ID使用34 G×1.5 mm长,外径和内径分别为178和63.5 μm的不锈钢空心微针,结果表明在72 h内与SC相比ID具有更短的Tmax、较少的受试者体内变异和较平稳的血糖变化[18]。近年来儿童和青少年糖尿病患病风险正在增加,微针给药在儿童与青少年糖尿病的治疗上也受到重视。2012年Emory大学的一项临床试验中,16名10~18岁儿童和青少年T1DM患者通过长度为1.1 mm的硼硅酸盐玻璃空心微针和皮下注射胰岛素给药,试验中使用视觉模拟量表评估受试者疼痛感,收集4 h以上血液测定胰岛素和葡萄糖浓度。结果显示微针给药疼痛感显著低于皮下注射,且具有更快的胰岛素体内起效速率和清除速率。微针Tmax为30±2 min,皮下注射 Tmax为 52±4 min,微针给药清除时间34 min,比皮下注射加快24%[19]。有研究认为胰岛素微针更快的起效速率和清除速率可以用于闭环胰岛素治疗,使患者血糖保持在正常水平,以预防低血糖的发生[20]。NanoPass公司2016年的一项临床试验中,17名2型糖尿病患者使用MicronJet皮内和皮下注射胰岛素,比较评价药代动力学/药效学(PK/PD)、安全性及耐受性。ID的Tmax(35 min)明显小于 SC 的 87.5 min,ID 的 Cmax(80 IU/mL)高于SC的55 IU/mL,2组药时曲线下面积(AUC)无明显区别,相对生物利用度相似[21]。
2.2 溶解型微针胰岛素给药
目前临床试验中使用的胰岛素微针多为空心微针,空心微针具有药物质量可控、活性稳定,载药量较大等优点。近年来高分子材料研究进展迅速,可以预见高分子材料微针会得到快速发展。目前多种新型高分子材料和缓释型胰岛素微针正处在研究阶段,并取得了一定的成果,为胰岛素溶解型微针的临床研究提供了基础。Lee等[22]使用胰岛素的明胶和羧甲基纤维素钠(CMC)溶解型微针贴片对糖尿病小鼠进行体内药效学研究,该微针药理相对利用度和相对生物利用度(RBA)分别为95.6%和85.7%。聚-γ-谷氨酸微针[23]、硫酸钙和明胶复合微针[24]藻酸盐和透明质酸微针[25]等用于胰岛素的透皮给药都取得了较好的效果。糖尿病并发症包括糖尿病异常低血糖引起的行为和认知障碍、癫痫发作、昏迷,甚至死亡,动态调节胰岛素或胰高血糖素的输送能够有效预防低血糖,缓释型微针用于糖尿病并发症预防也是微针应用研究的一个重要方向。Yu[26]等将胰岛素特异性配体与胰高血糖素结合,配体-胰高血糖素(Apt-Glu)进一步与固定在甲基丙烯酸酯化透明质酸(m-HA)上的胰岛素结合。HA微针在胰岛素浓度高的情况下,游离胰岛素可通过竞争结合使胰高血糖素从HA基质中快速释放。动物实验中该微针可维持80 mg/dL血糖浓度2 h,随后血糖值升高,对照组在0.5 h后出现低血糖(<70 mg/dL),该研究说明胰岛素触发的胰高血糖素递送微针能够预防低血糖。Yu等[27]利用含有胰岛素和葡萄糖氧化酶(GOx)的透明质酸微针作为葡萄糖触发型胰岛素输送装置,该微针贴片能有效地调节T1DM小鼠模型血糖浓度。在多项研究中,微针给药显示出优于其他给药方式的药物代谢动力学特征,有研究认为皮内给药与其他给药方式的体内代谢是不同的[28]。微针可将药物输送到含有丰富的毛细血管和淋巴管毛细管网络的真皮层,毛细血管较易吸收小分子,而淋巴毛细管由于其独特的结构和生理功能,可以吸收包括细胞碎片在内的不同大小的分子,因此淋巴吸收可能是微针给药等皮内给药的主要摄取方式,微针给药在体内的具体代谢方式还需要进一步的研究。
3 微针用于皮肤疾病治疗
微针作为一种新型皮肤病治疗给药方式同时兼具治疗和美容功能,微针给药具有增强局部吸收、操作相对简单、患者耐受性高等优点。目前微针在病理性瘢痕、脱发、皮肤疣、黑色素瘤、光化性角化病、黑斑病、白癜风等皮肤病的治疗领域均有研究[29]。
3.1 微针治疗皮肤疣
皮肤疣是人乳头瘤病毒(HPV)引起的常见皮肤病,目前治疗方法多存在病程持续、较易形成瘢痕,易复发等缺点[30]。一项研究成功制备了博莱霉素聚乳酸(L-PLA)包衣微针,并将该微针应用于皮肤疣的治疗中[31]。研究表明博来霉素可沾涂在聚乳酸微针尖端,动物实验中该微针具有足够的机械强度穿透皮肤厚角质层,体外实验中超过80%的博莱霉素在15 min内溶解进入皮肤。与局部注射相比,博莱霉素微针可更有效地使药物进入表皮皮层,药代动力学研究显示博来霉素微针在给药50 min后达到Tmax,Cmax为372.18 ng/L,半衰期36 min,而皮下注射博来霉素半衰期只有8 min。博来霉素微针为皮肤疣的治疗提供了一种方便、无痛的新途径。
3.2 微针治疗病理性瘢痕
病理性瘢痕(瘢痕疙瘩和增生性瘢痕)是临床常见的皮肤病,目前尚无明确的治疗方法[32]。有研究表明未载药的液晶聚合物微针可使成纤维细胞的存活率上升83.8%±11.96%,在兔耳增生性瘢痕模型中微针可以有效防止83.33%的伤口真皮组织增厚。临床试验显示微针贴片患者耐受良好,与未经处理的瘢痕区域相比微针治疗减少了瘢痕区浸润性炎症细胞的数量,真皮组织结构破坏较少,外观更平坦[33],但还须进一步的临床研究验证其疗效。Anastasia等[34]将16片0.5 cm2的微针贴片(14×14,针长600 μm)组合成大微针贴片,包含10名志愿者的临床试验显示该微针贴片平均插入深度为300~450 μm,与同一志愿者使用单个微针贴片效果无显着差异。该研究为大于1~2 cm2的微针贴片的应用提供了基础,也为微针在皮肤疾病的应用提供了理论支持。
3.3 微针治疗黑色素瘤
黑色素瘤(malignant melanoma,MM)来源于皮肤黏膜上皮基底细胞间的黑色素细胞,恶性程度极高,占皮肤癌相关致死病因的90%以上,占全身恶性肿瘤的4%~5%,近年来已成为发病率升高最快的肿瘤之一。Wang等[35]采用透明质酸与包封了aPD1和GOx的葡聚糖纳米颗粒结合,制备了aPD1溶解型微针。实验表明该微针贴片可以无痛地穿透表皮并有效浸入组织液中将其有效载荷持续地提供给肿瘤微环境,体内实验中单次使用MN贴片在B16F10黑色素瘤小鼠模型中可诱发免疫应答,约50%的小鼠黑色素瘤消失并存活40 d,系统注射或皮下注射aPD1能延长小鼠的存活时间但均不能达到40 d,说明注射相同剂量的aPD1,微针的治疗效果优于其他方式。在一项Dermaroller微针滚轮与5-氟尿嘧啶(5-FU)霜剂组合治疗黑色素瘤的研究中[36],当针长500 μm、直径50 μm的微针穿透小鼠皮肤后,5-FU霜剂的吸收量提高了4.5倍。在B16F10黑色素瘤小鼠模型体内比较5-FU微针与5-FU霜剂的抗肿瘤活性实验中,5-FU微针显著提高了体外皮肤局部通透性和体内抗肿瘤活性。以上研究结果说明微针技术可以整合到皮肤病的治疗中以提高药物疗效。目前很多微针在皮肤相关疾病的治疗中都处于临床前研究,证明微针可用于载药并取得治疗效果。关于微针实际释药量及微针材料在体内的代谢途径研究较少。溶解微针、包衣微针给药可有效减轻患者的疼痛感,但也面临着药物的稳定性降低、活性下降,载药量不足和安全性等问题,这些微针是否能用于皮肤疾病的治疗,还需要临床试验验证。
4 结语
微针给药研究不仅对于患者,而且对整个透皮给药领域的发展都具有重大意义,微针在疫苗、胰岛素给药的临床研究证明了微针给药的可行性,在皮肤病领域也取得了较好的试验结果。微针给药仍然面对许多挑战,在现有的微针安全性、药代动力学和药效学研究基础上,金属微针或玻璃微针的安全性、生物相容性及重复利用潜力,以及溶解型微针在体内的代谢途径,长期使用微针是否会对皮肤造成长久性或永久性的损伤等还需要进一步的研究。随着微加工技术的发展和相关药学研究的进展,其在肿瘤、眼科疾病、麻醉、牙科等领域的开发前景也倍受关注,我们相信微针给药将会在医疗、保健和生物学等领域带来新的突破。
[1] Badran M M,Kuntsche J,Fahr A.Skin penetration enhancement by a microneedle device(Dermaroller)in vitro:dependency on needle size and applied formula⁃tion[J].Eur J Pharm Sci,2009,36:511-523.
[2] Jungho J,Valerie R,Coler R,et al.Chitin micronee⁃dles for an easy-to-use tuberculosis skin test[J].Adv Healthcare Materials,2014,3:349-353.
[3] Kim Y C,Park J H,Prausnitz M R.Microneedles for drug and vaccinedelivery[J].AdvDrugDeliv Rev,2012,64(14):1547-1568.
[4] Moffatt K,Wang Y J,Donnelly R F,et al.Micronee⁃dles for enhanced transdermal and intraocular drug de⁃livery[J].Curr Opin Pharmacol,2017,36:14-21.
[5] Kumar A,Wonganan P,Sandoval M A,et al.Mi⁃croneedle-mediated transcutaneousimmunization with plasmid DNA coated on cationic PLGA nanoparticles[J].J Control Rel,2012,163(2):230-239.
[6] Holland D,Booy R,Loose F D,et al.Intradermal in⁃fluenza vaccine administered a new microinjection sys⁃tem produces superior immunogenicity in elderly adults:a randomized controlled trial[J].Oxford J,2008,198(1):650-658.
[7] Roels I L,Weber F.Intanza 9 μg intradermal season⁃al influenza vaccine for adults 18 to 59 years of age[J].Human Vaccines Immunother,2013,9(1):115-121.
[8] Beran J,Ambrozaitis A,Laiskonis A,et al.Intrader⁃malinfluenza vaccination ofhealthy adultsusing a new microinjection system:a 3-year randomised con⁃trolled safety and immunogenicity trial[J].BMC Med,2009,7(13):1741-1765.
[9] Scheifelel D W,McNeil S A,Ward B J,et al.Safe⁃ty,immunogenicity,and tolerability of three influenza vaccines in older adults[J].Human Vaccines Immunoth⁃er,2013,9(11):2460-2473.
[10]Akihiro N,Koji K,Masatoshi O,et al.Potency of whole virus particle and split virion vaccines using dissolving microneedle againstchallenges ofH1N1 and H5N1 influenza viruses in mice[J].Vaccine,2017,35:2855-2861.
[11]Matthew J,Mistilis J C,Joyce E,et al.Long-term sta⁃bility of influenza vaccine in a dissolving microneedle patch[J].Drug Deliv Transl,2017,7:195-205.
[12]Goodliffe L,Coleman B L,McGeer A J,et al.Accep⁃tance of intradermal inactivated influenza vaccines among hospital staff following 2 seasonal vaccination campaigns[J].Human VaccinesImmunother,2015,11(12):2827-2830.
[13]Troy S B,Kouiavskaia D,Siik J,et al.Comparison of the immunogenicity of various booster doses of inacti⁃vated polio vaccine delivered intradermally versus in⁃tramuscularly to HIV-infected adults[J].J Infect Dis,2015,211(12):1969-1976.
[14]Senovilla L,Vacchelli E,Garcia P,et al.DNA vac⁃cines for cancer therapy[J].Oncoimmunology,2013,2(4):e238031-13.
[15]Ali A A,McCrudden C M,McCaffrey J,et al.DNA vaccination forcervicalcancer;a noveltechnology platform of RALA mediated gene delivery via polymer⁃ic microneedles[J].Nanomed NanotechnolBiolMed,2017,13:921-932.
[16]Tang Tao,Deng Yan,Chen Jiao,et al.Local adminis⁃tration ofsiRNA through microneedle:optimization,bio-distribution,tumor suppression and toxicity[J].Sci Rep,2016,6(30430):1-8.
[17]WHO.http://www.who.int/en
[18]James C,McVey R E,Sutter D,et al.Intradermal in⁃sulin infusion achieves faster insulin action than sub⁃cutaneous infusion for 3-day wear[J].Drug Deliv Transl,2015,5:332-345.
[19]Norman J J,Brown M R,Raviele N A,et al.Faster pharmacokinetics and increased patient acceptance of intradermal insulin delivery using a single hollow mi⁃croneedle in children and adolescents with type 1 dia⁃betes[J].Pediatric Diabetes,2013,14:459-465.
[20]Battelino T,Omladic J S,Phillip M,et al.Closed loop insulin delivery in diabetes[J].BestPractRes Clin Endocrinol Metab,2015,29:315-325.
[21]Kochba E,Levin Y,Raz I,et al.Improved insulin pharmacokinetics using a novel microneedle device for intradermal delivery in patients with type 2 diabetes[J].Diabetes Technol Therapeutics,2016,18:525-531.
[22]Lee I C,Lin W M,Shu J C,et al.Formulation of two-layer dissolving polymeric microneedle patches for insulin transdermaldelivery in diabetic mice[J].J Biomed Mater Res,2017,105A:84-93.
[23]Chen M C,Ling M H,Kusuma S J.Poly-γ-glutamic acid microneedles with a supporting structure design as a potential tool for transdermal delivery of insulin[J].Acta Biomater,2015,24:106-116.
[24]Yu W J,Jiang G H,Liu D P,et al.Fabrication of biodegradable composite microneedles based on calci⁃um sulfate and gelatin for transdermal delivery of insu⁃lin[J].Mater Sci Engin,2017,71:725-734.
[25]Yu W J,Jiang G H,Zhang Y,et al.Polymer mi⁃croneedles fabricated from alginate and hyaluronate for transdermal delivery of insulin[J].Mater Sci En⁃gin,2017,80:187-196.
[26]Yu J C,Zhang Y Q,Sun W J,et al.Insulin-respon⁃sive glucagon deliveryforpreventionofhypoglycemia[J].Adv Sci News,2017,13:16030281-5.
[27]Yu Jicheng,Zhang Yuqi,Ye Yanqi,et al.Micronee⁃dle-array patches loaded with hypoxia-sensitive vesi⁃cles provide fast glucose-responsive insulin delivery[J].Proc Natl Acad Sci USA,2015,112(27):8260-8265.
[28]Milewski M,Manser K,Nissley B P,et al.Analysis of the absorption kinetics of macromolecules following intradermal and subcutaneous administration[J].Eur J Pharm Biopharm,2015,89:134-144.
[29]Iriartel C,Awosika O,Pardo M R,et al.Review of applicationsofmicroneedling in dermatology[J].Clin Cosmetic Invest Dermatol,2017,10:289-298.
[30]申琳,皮红英.皮肤疣治疗研究进展[J].临床误诊误诊,2016,29(5):113-116.
[31]Lee H S,Ryu H R,Roh J Y,et al.Bleomycin-coat⁃ed microneedles for treatment of warts[J].Pharm Res,2017,34:101-112.
[32]李梦芸,刘德伍.病理性瘢痕的研究和治疗现状[J].实用皮肤病学杂志,2017,10(3):161-165.
[33]Yeo1 D C,Balmayor E R,Schantz J T,et al.Mi⁃croneedle physical contact as a therapeutic for abnor⁃mal scars[J].Eur J Med Res,2017,22(28):1-9.
[34]Ripolin A,Quinn J,Larraneta E,et al.Successful ap⁃plication of large microneedle patches by human volun⁃teers[J].Int J Pharm,2017,521:92-101.
[35]Wang C,Ye Y Q,Hochu G M,et al.Enhanced can⁃cer immunotherapy by microneedle patch-assisted de⁃livery of anti-PD1 antibody[J].Nano Lett,2016,16:2334-2340.
[36]Naguib Y W,Kumar A,Cuin Z G.The effect of mi⁃croneedles on the skin permeability and antitumor ac⁃tivity of topical 5-fluorouraci[J].Acta Pharm Sinica B,2014,4(1):94-99.

