口服幽门螺杆菌疫苗候选株对小鼠肠道菌群的影响
陶好霞,张铮,袁盛凌,王艳春,关清,王雪涵,刘纯杰
1.军事科学院 军事医学研究院 生物工程研究所,北京 100071;
2.北京城市学院 生物医药学部,北京 100083
幽门螺杆菌是澳大利亚科学家Marshall和Warren于1982年首次从胃黏膜活检标本中分离得到的[1]。流行病学调查表明,幽门螺杆菌感染呈全球分布,全球自然人群的感染率超过50%。在发展中国家,50%~80%以上的成年人感染该菌,发达国家的感染率也达25%~50%[2-3]。在我国,幽门螺杆菌感染率为40%~90%,平均59%[4]。感染者100%出现无症状胃炎,约30%发展为慢性胃炎,10%~20%发展为胃和十二指肠消化性溃疡,1%~2%发展为胃腺癌及胃黏膜相关的淋巴样组织淋巴瘤[5-7]。1994年,世界卫生组织(WHO)国际癌症研究机构(IARC)和美国国立卫生研究院(NIH)相继通过决议,分别宣布幽门螺杆菌为胃炎、胃和十二指肠消化性溃疡的病因,同时也是第一类致癌因子[8]。
目前,临床上针对幽门螺杆菌感染的治疗主要依靠以抗生素为主的四联疗法,但存在许多问题,如所需费用昂贵,耐药菌株不断增加[9],停药后易复发与再感染等。因此,幽门螺杆菌疫苗的开发研究是非常必要的,我们实验室也开发研制了一种口服幽门螺杆菌减毒活菌载体疫苗。
近来,肠道菌群与健康的关系已成为医学界关注与研究的热点[10-12]。人们认为,肠道菌群在正常状态下保持着良好的动态平衡,具有多种重要的生理功能。口服幽门螺杆菌疫苗,在预防幽门螺杆菌感染的同时会不会对肠道菌群引起改变,导致菌群失调,引发疾病发生呢?为此,我们开展了本项研究。
1 材料和方法
1.1 材料
SPF级BALB/c小鼠(34只,雌雄各半,4~5周龄)购自北京维通利华实验动物技术有限公司,在军事医学研究院实验动物中心SPF动物房饲养;豚鼠(6只,250±20 g/只,雌雄各半)购自北京维通利华实验动物技术有限公司,在军事医学研究院实验动物中心SPF动物房饲养;口服幽门螺杆菌疫苗候选株SH02、疫苗载体菌FWL01、弗氏志贺菌野生株2457T由本室保存;志贺菌选择培养基HE琼脂购自北京奥博星生物技术有限责任公司;细菌基因组提取试剂盒购自康为世纪公司;组织基因组提取试剂盒、粪便基因组提取试剂盒购自天根生化科技有限公司。
1.2 引物的合成
实验中所用引物信息见表1,所有引物均由北京擎科生物科技有限公司合成。
1.3 细菌基因组提取及PCR扩增
从-70℃取出弗氏志贺菌野生株2457T、疫苗载体菌FWL01和疫苗株SH02,在超净工作台上分别转接至5 mL LB液体试管各1支,37℃、220 r/min过夜培养16 h,离心收集菌体,用试剂盒提取基因组DNA。20 μL PCR反应体系包括2×Es⁃Taq缓冲液 10 μL,基因组模板 1 μL,上、下游引物各1 μL,无菌水补充至终体积20 μL。反应参数:95℃预变性 5 min;95℃变性 30 s,55℃退火30 s,72℃延伸 1 min,30个循环;72℃延伸 5 min,4℃冷却10 min。PCR反应结束后,进行琼脂糖凝胶电泳。

表1 引物及序列
1.4 豚鼠角结膜试验
将经过活化培养的菌株涂布在LB固体琼脂平板上,平板凉干后倒置于37℃温箱中过夜培养;取1接种环培养18~20 h的固体菌苔培养物(活菌数约为5×1010)分别涂入不同豚鼠右眼的角结膜囊内,每种菌株接种2只豚鼠,雌雄各1只,连续7 d观察角结膜是否会发生炎症反应。
1.5 SH02菌悬液的制备及小鼠灌胃试验
SH02复苏培养后转接到100 mL LB培养基中,37℃、220 r/min培养3.5 h,每瓶加入1 mol/L IPTG使其终浓度为0.2 mmol/L,继续诱导培养4 h,测定菌液的D600nm值,离心收集菌体,用生理盐水重悬,调制菌体的最终浓度为5.0×109CFU/mL。小鼠经禁食、禁水后,先用饱和NaHCO3灌胃中和胃酸,30 min 后灌胃菌悬液 200 μL/只,2 h后恢复食水。
1.6 组织和粪便中SH02的分离培养与PCR检测
疫苗免疫接种后24、48、72和96 h各处死小鼠6只,雌雄各3只,进行组织和粪便中SH02的分离培养与PCR检测。脱颈处死小鼠,用75%酒精浸泡表面消毒15 min,在超净工作台上无菌取心脏、肺脏、肝脏、脾脏和肾脏,准确称重,加入9倍重量的生理盐水,在无菌研磨器中匀浆处理,匀浆液涂布HE平板,100 μL/块,每个样品2块平板,平板晾干后倒置于37℃温箱中培养24 h。组织基因组提取参照试剂盒说明书进行,20 μL PCR 反应体系包括 2×EsTaq缓冲液 10 μL,基因组模板 1 μL,上、下游引物各 1 μL,无菌水补充至终体积20 μL。反应参数:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸5 min,4℃冷却10 min。PCR反应结束后进行琼脂糖凝胶电泳,阳性结果应产生851 bp的特异条带。粪便收集回盲部内容物,称重后加入9倍的生理盐水,涡旋振荡混匀,作为10-1稀释度;依次继续进行10-2、10-3稀释度的稀释。3个稀释度样品各涂布2块HE平板,共6块,100 μL/块,平板晾干后倒置于37℃温箱中培养24 h,观察计数。粪便基因组提取参照试剂盒说明书进行,PCR反应条件同上。
1.7 肠道菌群细菌16S rRNA基因高通量测序样品的采集处理与分析
分别在小鼠免疫前(0 d)和免疫后(2、8 d)的3个时间点,采取腹部轻轻按压的方式,收集新鲜粪便4~5粒,装入标记好的菌种管,迅速封口,放入液氮中,从动物房回到实验室后,及时将样品转移到-70℃冰箱中。所有样品采集完成后,由美吉生物医药科技有限公司进行样品基因组DNA的提取、质量检定,以及16S rRNA基因高通量测序。根据测序结果,综合分析与评估口服疫苗对小鼠肠道菌群的影响。2组样本差异采用Welch′st-test进行统计学分析,并对P值计算假发现率(FDR)q值。
2 结果
2.1 侵袭性相关基因检测及侵袭力试验结果
对口服幽门螺杆菌疫苗候选株SH02、疫苗载体菌FWL01和弗氏2a志贺菌野生株2457T,通过PCR基因扩增的方法进行了侵袭性相关基因的检测,结果见图1。与弗氏2a志贺菌野生株2457T,SH02和FWL01菌株ipaBCDA基因簇和virG基因发生了缺失。其中,ipaBCDA基因簇直接参与细菌侵入上皮细胞,而virG的基因产物直接参与志贺菌从一个细胞到相邻细胞的侵袭。从这些直接或间接参与细菌侵袭功能的基因缺失情况来看,FWL01与SH02既缺失了侵袭上皮细胞的能力,也缺失了在细胞间侵袭的能力,所以不具有侵袭性。同时,我们对FWL01、SH02菌株和野生型弗氏2a志贺菌2457T进行了豚鼠角结膜侵袭性试验研究。结果表明,野生型弗氏2a志贺菌2457T具有对上皮细胞的侵袭能力,能够使试验的豚鼠角结膜发炎,7 d后角膜变得浑浊;而接种了SH02和FWL01的豚鼠,连续观察7 d,眼角膜和结膜均没有发生任何炎症反应,眼睛清澈明亮,说明SH02和FWL01菌株没有侵袭性。
2.2 SH02在小鼠体内组织分布与肠道存活规律检测结果

图1 2457T(A)、FWL01(B)和SH02(C)侵袭性相关基因PCR扩增结果
对SPF级BALB/c小鼠采用口服灌胃幽门螺杆菌疫苗候选株SH02的方式,进行了SH02在动物体内的组织分布与存活规律研究。结果表明,小鼠服苗后在肠道内分布有较多的疫苗株SH02。通过粪便检测结果可知(表2),服苗后24 h小鼠肠道粪便中含SH02活菌数平均为1.19×105CFU/g,48 h下降到 2.42×103CFU/g,72和 96 h则均没有分离到SH02。上述结果也得到对粪便样品提取基因组DNA后行PCR扩增结果的验证。在机体的各主要器官,包括小鼠心脏、肝脏、脾脏、肺脏和肾脏,在服苗后的 24、48、72、96 h,无论是从上述脏器的组织匀浆中进行选择性HE平板分离培养,还是提取这些组织脏器的基因组DNA用PCR方法扩增疫苗株尿素酶B抗原基因,结果均为阴性。
2.3 细菌16S rRNA基因高通量测序与分析结果
10只SPF级BALB/c小鼠口服灌胃幽门螺杆菌疫苗候选株SH02前(0 d)和灌服后2、8 d的30份粪便样品中全部提取到了基因组DNA,质量检定良好,符合16S rRNA基因高通量测序要求。利用338F-806R引物扩增,MiSeq平台测序,每份样品获得的有效序列均在3万条以上,总计110万条以上,465个OUT聚类分类单元,鉴定到161种细菌。测序结果分析表明,小鼠肠道菌群在门的水平上,主要由厚壁菌门和拟杆菌门组成,本次实验小鼠这2类菌的组成占95%以上;这2类占据肠道绝大多数的细菌,0 d组和2 d组、2 d组和8 d组、0 d组和8 d组的比较均没有统计学意义上的差异。在门的分类水平上进行比较,0 d组和2 d组小鼠肠道中变形菌门、放线菌门和蓝藻门的细菌均P<0.05,但q>0.05,差异不具有统计学意义(表3);2 d组和8 d组各类细菌均无差异(表4)。0 d组和8 d组小鼠肠道菌群仅脱铁杆菌门细菌P<0.01,q<0.05,差异具有统计学意义,其余门的细菌均无差异(表5)。脱铁杆菌门是一类通过专性或兼性厌氧代谢获得能量的细菌,可利用多种电子受体,其变化原因及其意义尚待进一步研究。综上所述,对肠道菌群细菌16S rRNA基因的高通量测序分析表明,口服幽门螺杆菌疫苗候选株SH02对小鼠肠道正常菌群不会产生明显的影响。
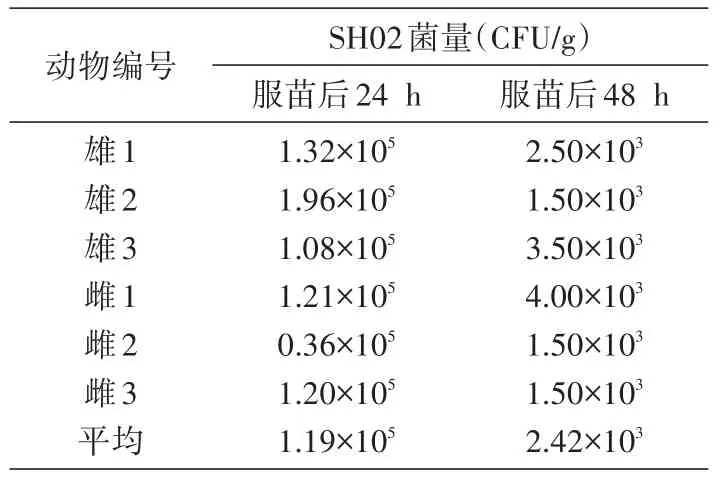
表2 小鼠粪便中SH02菌量统计表
3 讨论
幽门螺杆菌在世界范围内感染率高,感染者可以引起慢性胃炎、胃和十二指肠消化性溃疡、胃腺癌及胃淋巴瘤。2017年2月,WHO将幽门螺杆菌列为耐药严重,须高度优先开发新药的细菌。本实验室前期开发研制了口服幽门螺杆菌基因工程活菌载体苗SH02。
为了确保疫苗用载体菌株的安全性,我们在构建本疫苗株时选择了源于弗氏志贺菌2aT32疫苗株的FWL01作为载体菌。2aT32菌株的减毒机制已被美国Walter Reed陆军研究所的Venkatesan等[13]于上世纪90年代基本阐明,即在T32菌株的毒性大质粒上发生了与侵袭力相关基因的全部或部分缺失。我们用PCR扩增方式证明FWL01及SH02与侵袭性相关的ipaA、ipaD、virG基因扩增阴性,并且用豚鼠眼角结膜试验进一步验证,说明该菌株丧失了对上皮细胞的侵袭性。
国内外对弗氏2a志贺菌T32疫苗株进行了数万人的临床安全性试验,国内以此菌株为载体菌构建的2株痢疾双价活疫苗FS和FSM2117株也进行了大量临床安全性研究[14-15]。所有上述评价均未见发生严重副反应的报道,主要为首次服苗后胃肠道发生的腹痛、呕吐、腹泻,且主要为1级,为一过性反应。同时,疫苗在体内停留时间也比较短。涂光理等[16]于1997年在痢疾双价活疫苗FS大面积临床试验期间,选择成人高剂量组(免疫 3 次,剂量依次为 3.0×1010、6.0×1010和 6.0×1010CFU)通过粪便排菌检测进行了考察。结果表明,服完3剂后,被观察的83人中有56人排苗,排苗率67.47%,其中排苗1 d者32人(38.55%),连续排苗2 d者19人(22.89%),连续排苗3 d者4人(4.82%),连续排苗4 d者1人(1.20%)。
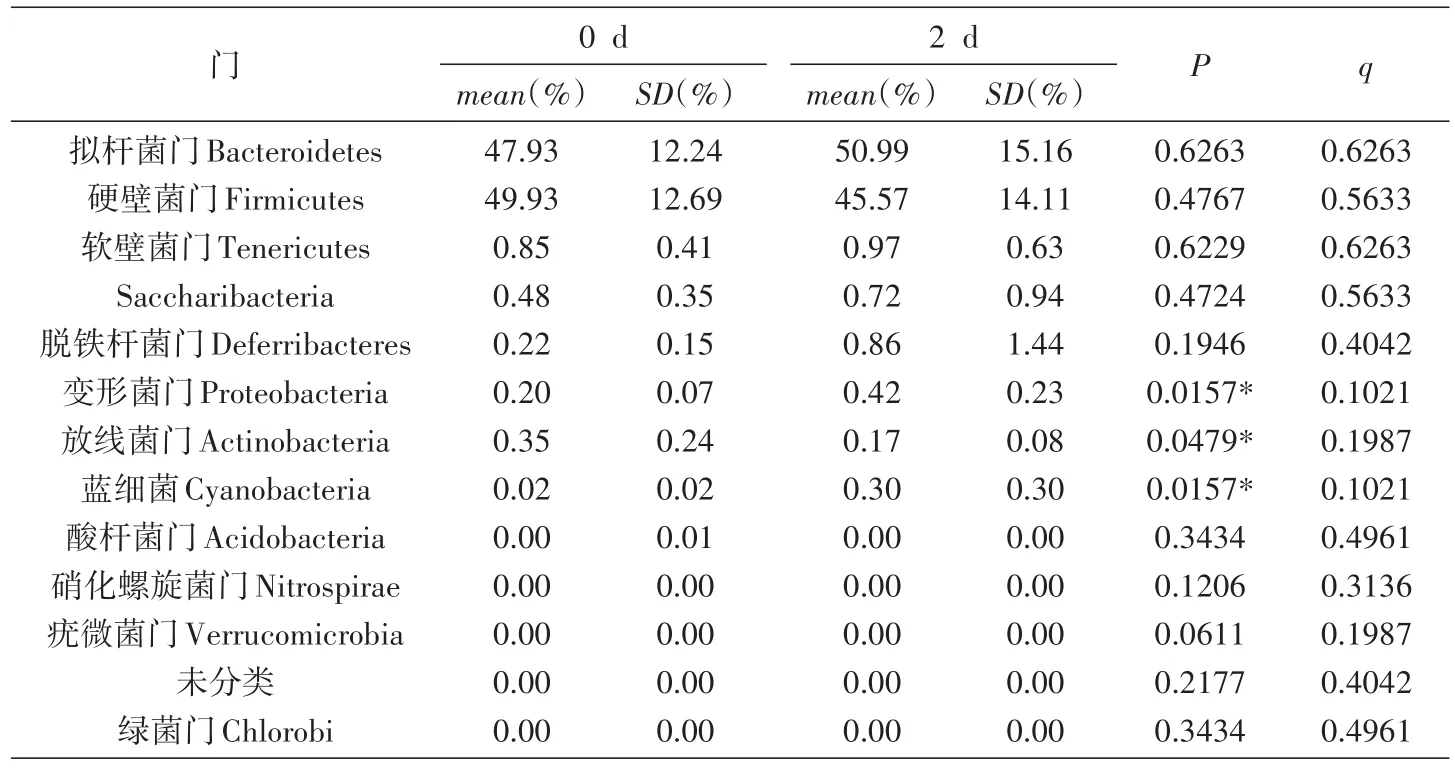
表3 在门的分类水平上0 d组和2 d组小鼠肠道菌群差异分析表

表4 在门的分类水平上2 d组和8 d组小鼠肠道菌群差异分析表
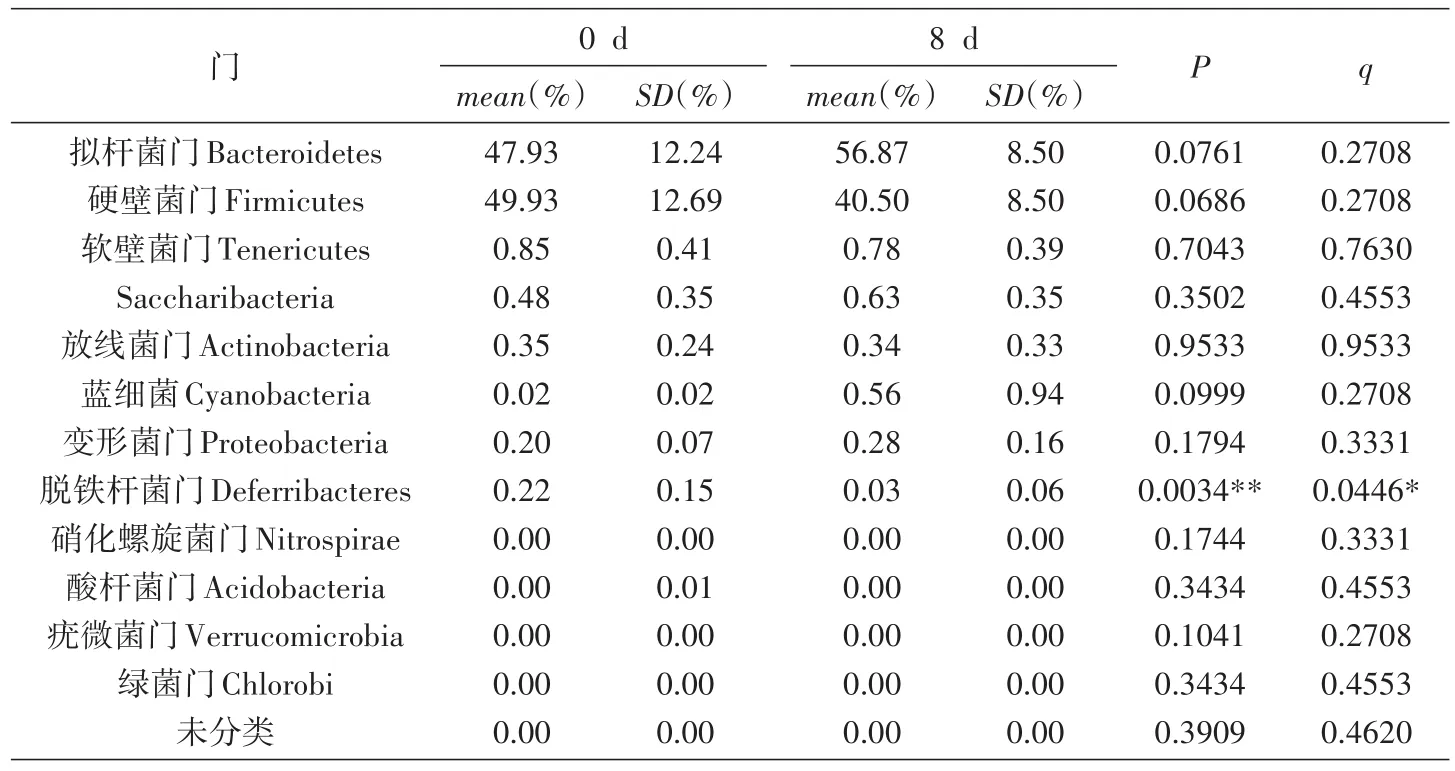
表5 在门的分类水平上0 d组和8 d组小鼠肠道菌群差异分析表
本实验通过小鼠灌胃免疫接种的方式,证明幽门螺杆菌疫苗候选株SH02在小鼠体内不具有组织侵袭性,灌胃免疫后不会分布到机体肠道外的各组织器官,且在小鼠肠道定植密度相对较低,存活时间也较短。用细菌分离培养的方式,免疫接种后的小鼠只能在灌胃接种后2 d内排泄的粪便标本中分离培养到细菌,预示不会发生明显的副作用,与以2aT32疫苗株为载体构建的志贺菌疫苗株所进行的临床安全性评价试验结果相类似。进一步对口服免疫幽门螺杆菌疫苗候选株SH02后小鼠肠道菌群中的细菌16S rRNA基因高通量测序与分析表明,口服幽门螺杆菌疫苗对小鼠肠道正常菌群没有产生明显的影响。该研究为疫苗应用带来的风险与获益评估提供了新的依据,可资借鉴。
[1] Warren J R,Marshall B J.Unidentified curved bacilli on gastric epithelium in active chronic gastritis[J].Lan⁃cet,1983,1:1273-1275.
[2] Graham D Y M H,Malaty H M,Evans D G,et al.Epidemiology of Helicobacter pylori in an asymptomat⁃ic population in the United States.Effect of age,race,and socioeconomic status[J].Gastroenterology,1991,100:1495-1501.
[3] World Gastroenterology Organization.Helicobacter pylo⁃ri in developing countries[Z].WGO Global Guidelines,2010:1-15.
[4] 张万岱,胡伏莲,萧树东,等.中国自然人群幽门螺杆菌感染的流行病学调查[J].现代消化及介入诊疗,2010,15(5):265-270.
[5] NIH Consensus Conference.Helicobacter pylori in pep⁃tic ulcer disease[J].JAMA,1994,272:65-69.
[6] Parsonnet J,Friedman G D,Vandersteen D P,et al.Helicobacter pylori infection and the risk of gastric carcinoma[J].N Engl J Med,1991,325:1127-1131.
[7] The EUROGAST Study Group.An international associ⁃ation between Helicobacter pylori infection and gastric cancer[J].Lancet,1993,341:1359-1362.
[8] World Health Organization.Infection with Helicobacter pylori.Schistosomes,liver flukes and Helicobacter py⁃lori[J].Int Agency Res Cancer,1994,61:177-241.
[9] Song Z,Zhou L,Wang Y,et al.A study to explore H.pylori antibiotic resistance and efficacy of eradica⁃tion therapy in China(multi-center,nation-wide,random⁃ized,control study)[J].Helicobacter,2011,16:17-118.
[10]Schroeder B O,Bäckhed F.Signals from the gut mi⁃crobiota to distant organs in physiology and disease[J].Nat Med,2016,22:1079-1089.
[11]Kitamoto H N,Kitamoto S,Kuffa P,et al.Pathogenic role of the gut microbiota in gastrointestinal diseases[J].Intest Res,2016,14(2):127-138.
[12]O′Toole P W,Jeffery I B.Microbiome-health interac⁃tions in older people[J].Cell Mol Life Sci,2018,75(1):119-128.
[13]Venkatesan M,Fernandez-Prada C,Buysse J M,et al.Virulence phenotype and genetic characteristics of the T32-ISTRATI Shigella flexneri 2a vaccine strain[J].Vaccine,1991,9:358-363.
[14]Meitert T,Pencu E,Ciudin L,et al.Vaccine strain Sh.flexneri T32-ISTRATI.Studies in animals and in volunteers.Antidysentery immunoprophylaxis and immu⁃notherapy by live vaccine VADIZEN(Sh.flexneri T32-ISTRATI)[J].Arch Roum Path Exp Microbiol,1984,43:251-278.
[15]涂光理,王建阳,崔长法,等.口服福氏2a和宋内氏双价痢疾活菌苗双盲对照现场观察[J].河南预防医学杂志,1999,10(1):8-10.
[16]涂光理,崔长法,王建阳,等.口服福氏2a和宋内氏痢疾双价活疫苗FS的双盲对照现场观察[J].中国生物制品学杂志,1999,12(3):178-180.

