干扰血红素加氧酶-1改善黑色素瘤细胞对顺铂耐药性的机制研究
程小耕,王梓乐,毕敬涛,汪琳,董志
1.重庆医科大学 药学院生化与分子药理研究室,重庆 400016;2.西南大学 动物科技学院,重庆 400715;3.北京积水潭医院,北京 100035;4.北京出入境检验检疫局,北京 100026
黑色素瘤是一种高度恶性的皮肤肿瘤[1],尽管已有长期且广泛的研究,但由于内质网应激保护、过表达多种耐药性蛋白及有效的DNA修复机制等多种复杂表型,以及转移速度快、恶性程度高、对化疗放疗均不敏感等特性使其难以治愈。铂类化合物是治疗黑色素瘤比较有效的药物,因此研究黑色素瘤对顺铂(cislpain,DDP)化疗敏感性提高的方法有广阔的临床应用前景。
血红素加氧酶-1(heme oxygnase-1,HO-1)是一种广泛存在于哺乳动物体内的抗氧化防御酶,是降解游离血红素重要的限速酶,其代谢终产物具有抗细胞凋亡、抗炎症和保护细胞等特性[2]。近年来大多数研究都证实HO-1在人体恶性肿瘤组织中异常高表达[3],对细胞的保护作用与肿瘤细胞增殖、侵袭、转移等生物学行为有着密切的关系,同时在化疗过程中是肿瘤产生抵抗反应的重要因素[4]。然而迄今,HO-1基因参与皮肤黑色素瘤化疗耐药及其机制的研究鲜见报道。在此,我们利用慢病毒介导的RNA干扰技术沉默HO-1基因的表达,观察干扰前后肿瘤细胞对顺铂敏感性的变化,探讨HO-1在黑色素瘤细胞耐药机制中的作用,为寻找逆转耐药途径提供理论基础,并在黑色素瘤的临床治疗中发现新的靶点。
1 材料和方法
1.1 材料
HEK-293T细胞、人皮肤黑色素瘤细胞A375由本实验室保存,采用含10%胎牛血清的DMEM培养液,于37℃、5%CO2孵箱中培养。硝酸纤维素膜购自Asra公司;pLKO.1-TRC、psPAX2和pMD2.G质粒购自Addgene公司;质粒提取及凝胶回收试剂盒购自康为世纪公司;反转录试剂盒、TRlzol购自Promega公司;嘌呤霉素购自碧云天公司;LipofectAMINE 2000转染试剂盒购自Invitro⁃gen公司;细胞DMEM培养液及胰酶购自HyClone公司;胎牛血清购自Natocor公司;顺铂购自江苏豪森药业股份有限公司;抗体β-actin、Bcl-2、Bax、Caspase-3购自CST公司;引物合成及序列测定由上海生工公司完成。
1.2 HO-1基因shRNA慢病毒载体的构建与鉴定
利用软件设计5条靶序列作为HO-1的RNA干扰序列,构建质粒,干扰HO-1质粒共转染293T细胞,Western印迹筛选有效靶点,根据其对HO-1的抑制效率,最终挑选的有效RNAi序列为5′-AATGCTGAGTTCATGAGGAAC-3′。 根 据 挑 选 的RNAi序列设计的HO-1短发夹框架结构为F(5′-CCGGAATGCTGAGTTCATGAGGAACCTCGAGGTTC CTCATGAACTCAGCATTTTTTTG-3′)和 R(5′-AAT TCAAAAAAATGCTGAGTTCATGAGGAACCTCGAG GTTCCTCATGAACTCAGCATT-3′),包含 19个碱基的正义链、6个核苷酸序列的loop环和互补19个碱基的反义链,在正义链和反义链的5′端分别加上限制性核酸内切酶AgeⅠ和EcoRⅠ的酶切位点。合成后退火成双链,与经AgeⅠ和EcoRⅠ双酶切消化后的慢病毒载体pLKO.1-TRC连接,转化感受态大肠杆菌并挑选阳性重组克隆进行PCR鉴定,连接成功的载体送公司测序,序列测定无误后将质粒命名为pLKO.1-TRC-HO-1。按照质粒提取纯化试剂盒的说明书纯化pLKO.1-TRC-HO-1和作为对照的空载体质粒pLKO.1-TRC,用于转染。
1.3 慢病毒包装
在25 mL细胞培养皿中接种对数生长期的293T细胞,当细胞密度约70%时将重组shRNA表达载体pLKO.1-TRC-HO-1、psPAX2和pMD2.G质粒与相应体积的Opti-MEM混合均匀,将DNA与LipofectAMINE 2000混合液转移至293T细胞的培养液中,8 h后更换正常培养基,48 h后收集细胞上清液,4℃、4000 r/min离心10 min除去细胞碎片,用0.45 μm滤器过滤上清液于40 mL超速离心管中,离心进行病毒浓缩、分装和保存。
1.4 HO-1低表达稳定株的建立
将生长良好的A375细胞在病毒感染前一天接种于培养瓶中,使其密度在感染时达70%~80%,加入 100 μL 病毒原液和 4 μL Polybrene(2 mg/mL),混匀,孵育12 h后更换完全培养基继续培养,48 h更换成含嘌呤霉素(1 μg/mL)的完全培养基,随后每2~3 d用该培养基换液一次,连续培养10 d后提取RNA和蛋白质检测。
1.5 细胞RNA提取和RT-PCR
用TRIzol提取细胞总RNA,逆转录参阅试剂盒说明书进行。用CFX Connect实时定量PCR仪(Bio-Rad公司)对上述获得的cDNA进行检测,总体积为20 μL(反应循环PCR扩增标准程序:95℃预变性2 min,95℃变性5 s,60℃延伸30 s,共 40个循环,延伸阶段收集荧光信号,循环结束后附加溶解曲线分析)。每例样品均设3个平行复孔,重复3次,取均值,收集数据,测定各样品的Ct值,计算目的基因的相对表达量为2-ΔΔCt。以持家基因GAPDH为内参照。相应引物序列见表1。
1.6 Western免疫印迹
收集细胞,弃去培养基,加入PBS清洗2次,加入200 μL蛋白裂解液,用细胞刮收集蛋白,12 000 r/min冷冻离心10 min,吸取上清,以BCA法进行蛋白定量。12%SDS-PAGE分离蛋白样品,100 V电压转移1.5 h至硝酸纤维素膜,预染蛋白质分子量标准标识蛋白位置。5%脱脂奶粉室温封闭1 h,用含5%BSA的TBST稀释一抗,4℃过夜,TBST洗膜3次,每次5 min,二抗室温孵育1 h,洗膜3次,每次5 min,ECL显色。
1.7 平板克隆形成实验
用细胞计数板计数3000个细胞,将细胞接种于60 mm培养皿,培养1周后将细胞用PBS清洗2次,加入2 mL多聚甲醛固定30 min,弃去多聚甲醛,加入适量结晶紫溶液染色,1~2 min后用水清洗,拍照。
1.8 CCK-8法检测HO-1敲低前后A375对顺铂敏感性的变化
收集病毒感染后的A375细胞,按5000个细胞接种于96孔板,每组设3个复孔,于37℃、5%CO2培养箱中培养24 h后,2组各加不同浓度的顺铂,48 h后每孔加入10 μL CCK-8,于培养箱中培养1 h,终止培养后用酶标仪测定各孔的D490nm值。
1.9 数据分析
目的基因的表达由RT-PCR结果计算的2-ΔΔCt和Image J软件计算的Western印迹灰度值行统计,采用SPSS17.0统计软件分析,所有数据均以x±s表示,多组之间比较采用单因素方差分析。
2 结果
2.1 HO-1低表达的稳定转染细胞株的建立
重组质粒纯化后,通过HO-1干扰慢病毒建立再转染A375细胞48 h后,经嘌呤霉素筛选10 d,获得具有抗性的单克隆细胞集落,发现在稳定细胞系中,HO-1干扰细胞(KD)形态略变细长,呈不规则形态(图1A)。扩大培养后收取细胞总RNA和蛋白质,RT-PCR和Western印迹(图1B)显示HO-1稳定细胞株中的HO-1 mRNA相对水平显著性下调(P<0.001),蛋白水平也明显下降。
2.2 HO-1基因影响A375细胞增殖能力
将3000个细胞分别接种于60 mm培养皿中培养7 d,细胞固定后用结晶紫染色,结果如图2A,干扰HO-1稳定细胞系中细胞明显少于正常A375细胞(对照)。CCK8法检测结果显示敲低HO-1后能够明显抑制细胞生长,差异具有统计学意义(P<0.01)(图2B)。此结果表明干扰HO-1基因可抑制人黑色素瘤细胞的增殖能力。

表1 Real-time PCR所用的引物序列
2.3 沉默HO-1增强A375细胞对顺铂的敏感性
为研究在A375细胞中沉默HO-1对顺铂的敏感性,本实验选用 4、5、6 μg/mL 顺铂分别处理A375和A375-shHO-1稳定细胞系,加药48 h后结晶紫染色,结果显示A375-shHO-1细胞存活率明显低于A375细胞(图3A);显微镜下观察,与A375细胞相比,A375-shHO-1细胞死亡率显著增高,在加入4 μg/mL顺铂处理后A375还能保持其细胞形态,但A375-shHO-1细胞形态已发生明显改变,甚至趋于凋亡(图3B)。
为进一步研究细胞对不同浓度顺铂的敏感性,采用药物浓度由低到高的梯度分别处理2种细胞,CCK8检测细胞存活率,结果(图3C)显示在低浓度顺铂(0.25~6 μg/mL)处理的情况下,A375-shHO-1细胞的抑制率可高达50%,而A375细胞抑制率只有22.6%,浓度越低的情况下(0.25~1 μg/mL),A375-shHO-1细胞抑制率比 A375细胞高 8倍以上。在高浓度顺铂(8~20 μg/mL)处理的情况下,A375-shHO-1细胞与A375细胞的抑制率没有明显差异,20 μg/mL顺铂处理时两者抑制率都达到约60%的高峰。这些结果表明沉默HO-1能加强细胞对药物的敏感性,低浓度药物处理效果更加明显。
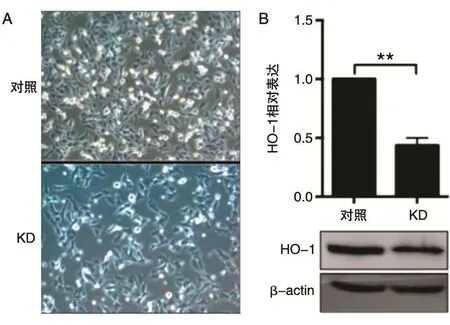
图1 HO-1 RNAi慢病毒感染后稳定细胞株的HO-1表达

图2 结晶紫染色和CCK8检测细胞增殖情况
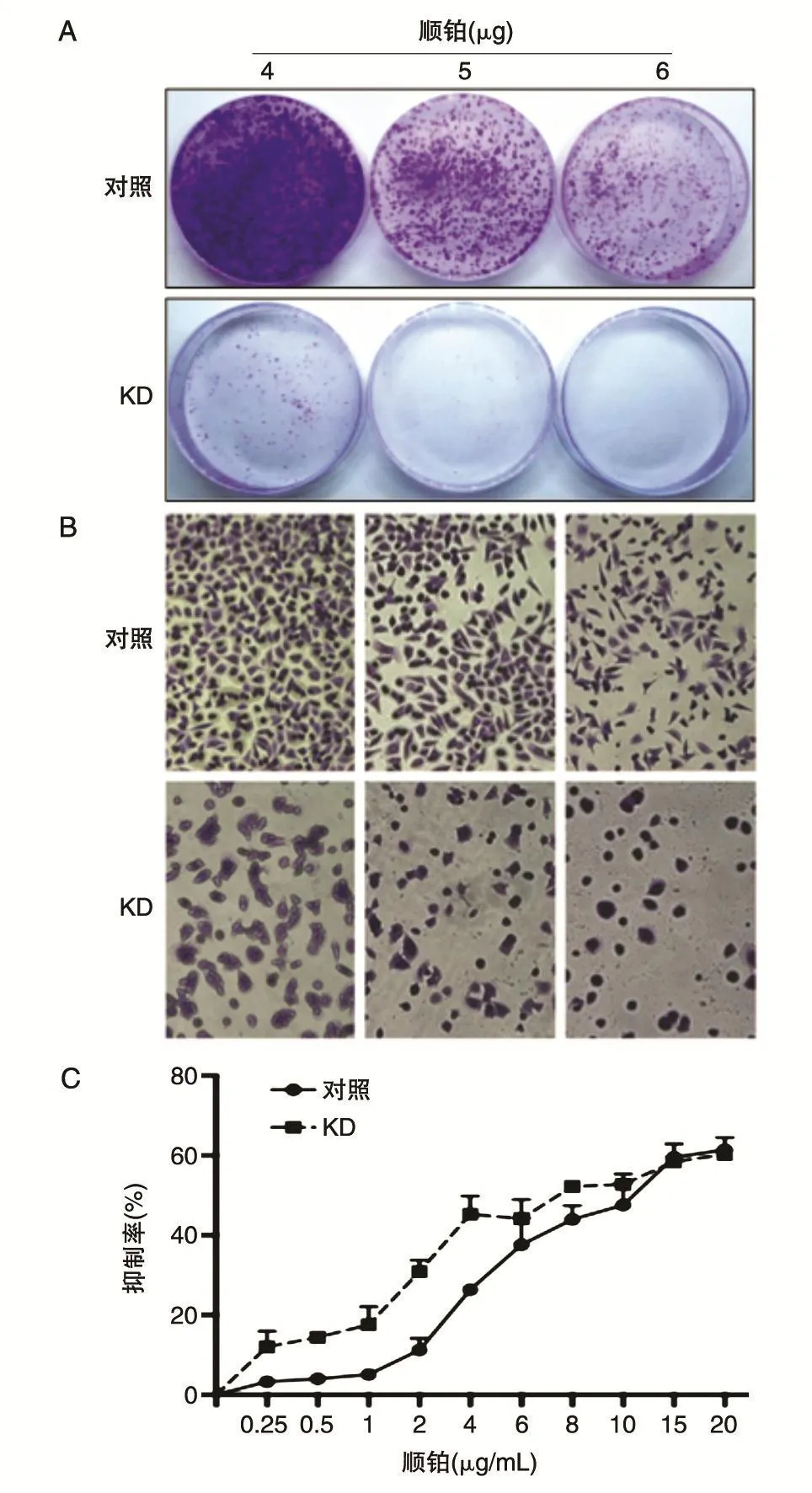
图3 敲低HO-1后不同浓度顺铂处理的A375细胞存活率
2.4 顺铂处理后敲低HO-1促进细胞凋亡
流式细胞术结果显示,在A375细胞中,敲减HO-1稳定细胞株凋亡率(5.74%)与对照组(4.16%)没有明显差异(图4A)。当在A375细胞株中加入4 μg顺铂,其对照组和shHO-1稳定细胞株凋亡率都显著提高,但shHO-1稳定细胞株凋亡率(48.32%)明显高于对照组(22.89%),差异具有统计学意义(P<0.01)(图4B)。
2.5 HO-1稳定敲低细胞经顺铂处理后凋亡相关蛋白的表达量增加
细胞经4 μg/mL顺铂处理后,real-time PCR检测结果显示,A375-shHO-1细胞与A375细胞相比,凋亡抑制基因Bcl-2的表达明显降低(P<0.05),而凋亡基因Bax的表达显著增高(P<0.01),总的Caspase-3水平无明显变化(图5A)。此外,2种细胞蛋白水平上检测相关凋亡基因Bcl-2、Bax、Caspase-3及active caspase-3的表达,Western印迹结果显示,敲低HO-1能够降低Bcl-2蛋白表达,增加Bax的蛋白表达,并活化Caspase-3(图 5B)。
3 讨论
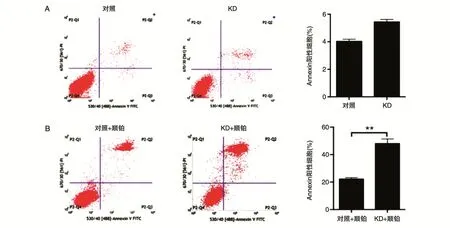
图4 敲低HO-1的表达对A375细胞凋亡率的影响
顺铂是临床上较为广泛应用的抗癌药物,目前用于乳腺癌、结肠癌、头颈癌等多种肿瘤[5-6],其作用机制主要是进入癌细胞的DNA碱基片段中,阻碍DNA的转录和复制,从而抑制肿瘤生长。然而化疗药物持续使用使癌细胞对化疗药物敏感性降低,从而产生对药物抵抗,导致化疗失败,因此它的耐药性成为亟待解决的问题之一。
血红素加氧酶是血红素氧化的限速酶,其降解衰老或破损的红细胞并释放出血红素,是止血和氧化应激反应的重要分子。以往认为血红素代谢产物不仅对机体无益,过量时还可对机体造成损害[7]。但深入的研究表明这些物质均具有细胞保护作用,可以抑制炎症细胞释放炎性因子,还可促进恶性肿瘤细胞的基因组不稳定性[8-9]。
研究发现,多种肿瘤细胞中均可见HO-1的高表达,在缺氧条件和放化疗时表达更是明显增加。HO-1的过量表达可能是肿瘤细胞适应较恶劣生长条件和产生放化疗抗性的主要原因之一。有研究发现高HO-1表达可以诱导神经母细胞瘤等肿瘤细胞的耐药性增加[10]。而近期有报道显示HO-1在伊马替尼治疗慢性髓细胞性白血病中也参与了药物的耐药性[4]。在皮肤黑色素瘤治疗中,HO-1对顺铂敏感性的影响机制尚未阐明,为此我们应用shRNA抑制HO-1的表达,在构建的稳定细胞株中发现A375-shHO-1细胞能够抑制细胞生长。加入药物顺铂处理后,HO-1敲减能增加A375对药物顺铂的敏感性。
耐药的产生与药物外排、DNA损伤的增加及细胞增殖或凋亡信号通路改变密切相关[11-13]。HO-1已被证明与Nrf2通路有关,影响其他转录因子 STAT3、CDP、Brn-3、CBF和 AP-2,而这些因子都直接或间接参与DNA修复机制和凋亡[14-15]。本研究发现,在采用化疗药物顺铂处理后,HO-1敲低可促进凋亡并调节凋亡相关基因Bcl-2、Bax的表达。Bcl-2是一种原癌基因,具有抑制凋亡的作用,而Bax基因属于Bcl-2家族,可与Bcl-2蛋白结合形成异源二聚体,抑制Bcl-2的功能,从而促进细胞凋亡[16]。本研究结果显示敲低HO-1能够上调Bax表达并抑制Bcl-2的表达,从而促进癌细胞凋亡。Caspase-3是白细胞介素1β转化酶(ICE)家族成员,是主要的效应Caspase,在细胞凋亡中处于核心地位,活化后的Caspase-3更能够调节凋亡相关线粒体通路及死亡受体通路,从而影响细胞生长。流式细胞术结果显示,在化疗药物处理下HO-1敲减促进黑色素瘤细胞凋亡,并且能够激活Caspase-3。
综上所述,我们的研究结果表明HO-1敲低可促进细胞凋亡,从而增加A375细胞对化疗药物的敏感性,同时可调控相关凋亡基因来降低A375的耐药性。本研究对黑色素瘤细胞化疗药物的开发研究及临床耐药性的解决提供了新的思路。
[1] Balch C M,Soong S J,Gershenwald J E,et al.Prog⁃nostic factors analysis of 17 600 melanoma patients:validation of the American Joint Committee on Cancer melanoma staging system[J].J Clin Oncol,2001,19(16):3622-3634.
[2] Chau L Y.Heme oxygenase-1:emerging target of can⁃cer therapy[J].J Biomed Sci,2015,22:22.
[3] Li Y,Su J,DingZhang X,et al.PTEN deletion and heme oxygenase-1 overexpression cooperate in pros⁃tate cancer progression and are associated with ad⁃verse clinical outcome[J].J Pathol,2011,224(1):90-100.
[4] Schaefer B,Behrends S.Translocation of heme oxygen⁃ase-1 contributes to imatinib resistance in chronic my⁃elogenous leukemia[J].Oncotarget,2017,8(40):67406-67421.
[5] Niehr F,Eder T,Pilz T,et al.Multilayered omicsbased analysis of a head and neck cancer model of cisplatin resistance revealsintratumoralheterogeneity and treatment-induced clonal selection[J].Clin Cancer Res,2017,doi:10.1158/1078-0432.CCR-17-2410.
[6] Ong Z Y,Chen S,Nabavi E,et al.Multi-branched gold nanoparticles with intrinsic LAT-1 targeting capa⁃bilities forselective photothermaltherapy ofbreast cancer[J].ACS Appl Materials Interfaces,2017,doi:http://dx.doi.org/10.1021/acsami.7b14851.
[7] Engelman J A,Berg A H,Lewis R Y,et al.Constitu⁃tively active mitogen-activated protein kinase kinase 6(MKK6)or salicylate induces spontaneous 3T3-L1 adi⁃pogenesis[J].J Biol Chem,1999,274(50):35630-35638.
[8] Berberat P O,Dambrauskas Z,Gulbinas A,et al.Inhi⁃bition of heme oxygenase-1 increases responsiveness of pancreatic cancer cells to anticancer treatment[J].Clin Cancer Res,2005,11(10):3790-3798.
[9] Liu Z M,Chen G G,Ng E K,et al.Upregulation of heme oxygenase-1 and p21 confers resistance to apop⁃tosis in human gastric cancer cells[J].Oncogene,2004,23(2):503-513.
[10]Furfaro A L,Traverso N,Domenicotti C,et al.The Nrf2/HO-1 axis in cancer cell growth and chemoresis⁃tance[J].Oxid Med Cell Longev,2016,2016:1958174.
[11]Rigalli J P,Tocchetti G N,Arana M R,et al.The phytoestrogen genistein enhancesmultidrugresistance in breast cancer cell lines by translational regulation of ABC transporters[J].Cancer Lett,2016,376(1):165-172.
[12]Li L,Zhu T,Gao Y F,et al.Targeting DNA damage response in the radio(chemo)therapy of non-small cell lung cancer[J].Int J Mol Sci,2016,17(6):839.
[13]Li W,Zhang H,Assaraf Y G,et al.Overcoming ABC transporter-mediated multidrug resistance:molecular mechanismsand noveltherapeutic drug strategies[J].Drug Resistance Updates,2016,27:14-29.
[14]Biswas C,Shah N,Muthu M,et al.Nuclear heme oxy⁃genase-1(HO-1) modulates subcellular distribution and activation of Nrf2,impacting metabolic and antioxidant defenses[J].J Biol Chem,2014,289(39):26882-26894.
[15]Tibullo D,Barbagallo I,Giallongo C,et al.Heme oxy⁃genase-1 nuclear translocation regulates bortezomibin⁃duced cytotoxicity and mediates genomic instability in myeloma cells[J].Oncotarget,2016,7(20):28868-28880.
[16]Wang L,He Y,Zhang Y,et al.Effects of active com⁃ponentsofFuziand Gancao compatibility on Bax,Bcl-2,and Caspase-3 in chronic heart failure rats[J].Evid Based ComplementAlternatMed,2016,2016:7686045.

