基于近红外量子点的荧光共振能量转移生物探针构建及应用
修景锐,胡思怡,李金华*,任 升,刘丽炜
(1.长春理工大学 理学院,吉林 长春 130022;2.深圳大学 光电工程学院,广东 深圳 518060)
1 引 言
荧光共振能量转移(FRET)是一种通过荧光物质间发生非辐射能量转移进行分析的光谱分析法[1-2]。自该理论提出以来,FRET已被广泛应用于农业、医药、司法鉴定和科学研究的各个领域中[3-8]。
近年来,FRET技术在空间分辨率、敏感性方面有很大的提高,根据FRET设计的传感器在生物学研究领域得到广泛应用,如检测生物大分子的构象变化、生物大分子之间的相互作用、生物分子间纳米尺度的距离等[9-12]。研究表明能量供受体的光学性质及传感器的组装方法对FRET传感器的检测性能有至关重要的影响[13],然而传统的能量供受体(如有机荧光染料、生物材料、镧系元素等)由于荧光强度低、光稳定性弱、对环境敏感、生物相容性较差,并且毒性较大,容易受到生物体内自发荧光和杂散光干扰,导致出现荧光强度下降、生物检测达不到预期目标等缺点,从而限制了FRET传感器的发展与应用[14-19]。
目前,南京工业大学课题组[20]将近红外FRET体系应用于光动力治疗方面进行研究,一定程度上改善了可见FRET体系的缺点,达到了更好的治疗效果,但目前近红外FRET体系作为敏感型探针的研究依然比较缺乏。
本文构建了近红外区域的FRET体系,供体为荧光发射峰在近红外的InP/ZnS量子点,受体为吸收在近红外的荧光染料Cy7(C45H44K3N3O16S4)。弥补了传统可见光量子点在生物应用中的缺陷。同时对该体系进行浓度和细胞微环境pH敏感性检测,结果表明FRET体系的荧光强度可直接反映细胞微环境的酸碱度变化,对体系pH值有较高的检测精度,本研究为FRET体系作为敏感型探针应用于癌症早期诊断提供了理论和实验依据。
2 材料与方法
2.1 实验试剂与仪器
实验试剂:醋酸铟(In(Ac)3),硬脂酸锌(Zn(St)2),十二烷基硫醇(DDT),购于Alfa公司;肉豆蔻酸(MA),购于TCI公司;1-十八烯(ODE),购自Sigma公司;二硫代苏糖醇(DTT),磷化锌(Zn3P2)购买于国药上海试剂公司。氢氧化钠,盐酸以上药品均购于国药试剂。荧光染料Cy7(C45H44K3N3O16S4),购于武汉斯奈德生命科技有限责任公司。实验所用溶剂如不作特殊说明均用超纯水(HPLC),购于Alfa公司。DMEM高糖培养液,其中含有10%的胎牛血清(FBS,Hyclone公司),100 μg/mL的盘尼西林和100 μg/mL的链霉素,均购于Gibco公司。
实验仪器:高精度电子天平(Sartorius,Quintix224-1cn),磁力搅拌器加热台(Thermo Scientific,Cimarec),超声清洗器,恒温水浴箱,移液器,紫外-可见-近红外分光光度计(Agilent,Cary 5000 UV-Vis-NIR),荧光分光光度计(Agilent,Cary Eclipse),透射电子显微镜, FLS980超快荧光寿命光谱仪,荧光倒置显微镜(DMI3000,Leica,德国)。
2.2 实验方法
量子点的制备:将0.2 mmol的醋酸铟,0.6 mmol的肉豆蔻酸和15 mL 1-十八烯在氮气保护下保持110 ℃加热1 h,获得In前驱液。将3 mL盐酸(4 M)注入磷化锌,生成的磷化氢气体通入到加热至240 ℃的In前驱液中,获得InP量子点。将0.6 mmol硬脂酸锌溶解于2 mL 1-十八烯中并加热至120 ℃后,将其注入InP量子点溶液中,形成InP/ZnS复合物,最后,将加热至260 ℃的十二烷基硫醇(0.6 mmol)加入InP/ZnS复合物,反应1 h后获得InP/ZnS量子点。
上一步骤中制备了油性的InP/ZnS量子点,我们接下来对油性量子点进行了表面修饰,以便其更好的生物应用,具体修饰方法如下:将1 mL甲醇,1 mL氯仿,4 mL MPA和油性量子点混合搅拌5 min,向搅拌后的混合溶液中加入3%的NH4OH,继续搅拌5 h,获得水溶性InP/ZnS量子点。
FRET体系的构建:将InP/ZnS量子点溶液和Cy7荧光染料摩尔比例1∶0、1∶0.01、1∶0.02、1∶0.03、1∶0.04和1∶0.05混合加入反应样品瓶中,在常温、常压条件下搅拌5 min,对混合溶液进行测定。
荧光光谱测定:在室温条件下,依次取1 mL的量子点与染料构建FRET体系溶液,以600 nm为激发波长,激发和发射狭缝为5 nm,记录620 nm到850 nm波长范围内的发射光谱变化。
傅里叶红外光谱测定:50 ℃下将InP/ZnS量子点,Cy7荧光染料和FRET体系烘干成粉末状备用。分别将3种待测样品与溴化钾粉末以1∶10的比例混合后充分研磨,将混合后的粉末进行压片处理,获得待测样品。
MCF-7乳腺癌细胞荧光成像:用于荧光成像的MCF-7乳腺癌细胞在使用前要分种在6孔培养板中。实验前的细胞需培养24 h,密度在60%~70%即可。用于荧光成像的FRET体系样品按照10~20 μg/mL的浓度溶于PBS中(pH=7.2)。向六孔板的每个孔中加入20~40 μL的样品,轻轻摇匀后,在37 ℃,5%CO2环境下培养4 h后,移去培养液,用PBS清洗3遍,在荧光倒置显微镜下观察细胞形态并进行荧光成像研究。
3 结果与讨论
3.1 InP/ZnS量子点-Cy7荧光染料FRET体系的构建
由图1可知,InP/ZnS量子点的发射光谱与Cy7染料的吸收光谱有较大的重叠面积,图中的阴影部分为重叠部分。而InP/ZnS量子点的发射光谱与染料的发射光谱相距较远,最大发射峰值相差60 nm,有效避免了供受体之间的荧光干扰。所以InP/ZnS量子点和Cy7荧光染料符合构建FRET体系的基本条件[21-22],其中InP/ZnS量子点和Cy7染料分别作为FRET体系的供体和受体。

图1 InP/ZnS量子点和Cy7荧光染料的吸收和发射光谱对比图 Fig.1 Comparison of absorption and emission spectra of InP/ZnS quantum dots and Cy7 fluorescent dyes
根据实验室经验,供体InP/ZnS量子点表面游离的羧基(—COOH)能与受体染料Cy7表面游离的氨基(—NH2)通过化学键和的方式相连接,以拉近供受体之间的距离。为了验证该结论,我们利用傅里叶红外光谱测试(FTIR)对InP/ZnS量子点与染料Cy7之间化学键合的情况进行验证。在图2中,InP/ZnS量子点溶液在1 650 cm-1(COO—)处有振动峰的存在,Cy7染料在3 438 cm-1(NH2)处有振动峰存在。供体InP/ZnS量子点与受体Cy7染料的结合是通过Cy7上的—NH2和量子点表面的—COOH(来自于量子点的表面修饰剂MPA),脱水缩合形成的肽键(—CO—NH—)。图2中曲线1代表了InP/ZnS量子点和Cy7染料构建的FRET体系,InP/ZnS-Cy7染料在1 576 cm-1(—CO—NH—)处的振动峰存在,确定了两种样品成功结合,这个1 576 cm-1的振动峰在InP/ZnS量子点和Cy7单独的红外光谱中均不存在。而且,伴随着1 576 cm-1(—CO—NH—)的出现InP/ZnS量子点上的1 650 cm-1(COO—)振动峰明显减弱,这进一步确认了InP/ZnS量子点与Cy7染料之间的化学键合过程的成功实现。
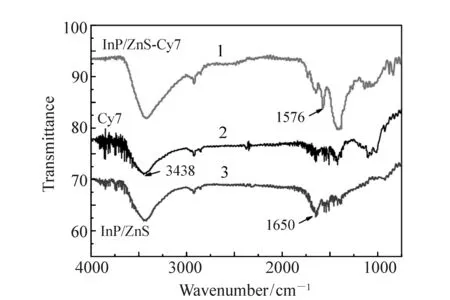
图2 InP/ZnS量子点,Cy7,FRET体系的FTIR光谱 Fig.2 FTIR spectra of InP/ZnS quantum dots, Cy7 fluorescent dyes and FRET system
3.2 InP/ZnS量子点和Cy7染料浓度对FRET体系的影响
不同浓度的InP/ZnS量子点与Cy7染料构建FRET体系。如图3(a)所示,当Cy7染料浓度不变时,随着量子点浓度的增加(0.1~0.5 μmol/L),Cy7染料的荧光强度会明显增强,可以看出量子点与染料之间发生了荧光共振能量转移。随着供体InP/ZnS量子点浓度的增加,FRET体系的荧光共振能量转移效率逐渐减小,如图3(b)所示,这是因为随着供体分子数量的增多,围绕在单个供体附近的受体分子平均数目减少,体系的荧光共振能量转移效率减少。本论文转移效率是基于荧光强度计算的,Styrer和Haugland 给出[23],同理,保持量子点浓度不变,改变Cy7染料的浓度,获得FRET体系的变化情况如图4所示。从图4(a)中可以看出,随着Cy7染料浓度的增加,量子点的荧光强度随之减小。通过公式(1),计算得到了改变Cy7染料后的荧光共振能量转移效率,如图4(b)所示。从图4(b)中可以看出,随着受体浓度的增加,FRET体系能量转移效率逐渐增大,但当QDs:Cy7小于1:250后,荧光共振能量转移效率达到最大,因为当Cy7染料浓度增加到一定程度时,量子点周围围绕的受体染料分子供数目达到饱和。
(1)
式中,ID-A、ID分别代表有受体和无受体时供体的荧光强度。这样,通过测量供体的荧光强度可以计算出荧光共振能量转移的效率E。

图3 改变InP/ZnS量子点浓度时的FRET体系(a)荧光光谱图(b)相应的FRET转换效率 Fig.3 FRET system when the InP / ZnS quantum dot concentration is changed. (a)Fluorescence spectra (b)FRET conversion efficiency

图4 改变Cy7浓度时的FRET体系(a)荧光光谱图(b)相应的FRET转换效率 Fig.4 FRET system when the Cy7 concentration is changed. (a)Fluorescence spectra (b)FRET conversion efficiency
3.3 pH值对FRET体系的影响
如图5所示,将Cy7染料和InP/ZnS量子点分别溶在pH值为4、7、10、12的去离子水中进行荧光光谱的测试。从图5(a)中可以看出,随着溶液pH值从4升至12,溶液中染料的荧光强度没有明显的改变,可以说明染料本身对pH值不敏感。但从图5(b)可以明显看出,随着溶液pH值的改变,量子点的荧光强度有明显的变化,强酸性条件下,量子点的荧光强度最弱,这是因为溶液中较为丰富的H+抑制了量子点表面羧基的解离。相反当溶液偏碱性时,其中会有含有丰富的OH-,能够促进羧基的解离,但过高的pH值同样会降低量子点的荧光。

图5 Cy7(a)和InP/ZnS量子点(b)在不同pH值溶液中的荧光光谱图 Fig.5 Fluorescence spectra of Cy7(a) and InP/ZnS quantum dots(b) in different pH solutions
测试了供受体对pH值的响应之后,通过调节FRET体系(InP/ZnS-Cy7)的pH值,验证该体系的对pH值的敏感性。癌细胞形成初期表现是pH值的微弱改变,因此,本文拟利用自行构建的FRET体系对pH值的敏感性实现对不同pH值缓冲液的监测,最终应用于癌细胞微环境检测,实现癌症早期诊断。如图5所示,验证了pH值的微弱改变(pH=6.7~9.1)对体系的荧光强度的影响。在一定范围内,pH值的降低,体系的荧光强度逐渐减弱,呈现出明显趋势,实验结果表明该体系可以作为pH值敏感型生物探针。

图6 FRET体系在不同pH值溶液中的荧光光谱图 Fig.6 Fluorescence spectra of FRET system in different pH solutions
3.4 FRET体系对生物微环境检测的应用
为了验证InP/ZnS-Cy7体系生物应用的可行性,首先采用MTT比色分析法对体系的细胞毒性进行测试,具体测试过程如下:
利用96孔板培养MCF-7乳腺癌细胞,FRET体系按照浓度梯度为4、2、1、0.5和0.25 nmol/mL溶解,向孔中分别加入不同浓度的待测样品,摇匀后置于CO2培养箱(37 ℃)中培养24 h,确保样品进入细胞并对细胞产生作用。24 h后,取出含有样品的96孔板,向每个孔中加入5 μg/mL的MTT溶液20 μL,摇匀后再培养4 h,活细胞的线粒体中的琥珀酸脱氢酶能使MTT还原为水不溶性的蓝紫色结晶甲瓒。抽取孔上层溶液后加入150 μL的二甲基亚砜(DMSO,购于Sigma),利用酶标仪在495 nm处对其进行扫描,得到细胞活性数据。如图7所示,24 h后,随着InP/ZnS-Cy7体系浓度的增加,细胞活性虽然有所降低,但总体细胞活性均保持在60%以上,具有良好的生物兼容性,可以进行相关的生物研究和应用。

图7 FRET体系的细胞毒性测试 Fig.7 Relative cell viability of MCF-7 breast cancer cell treated with FRET system
为了证明该体系可以作为荧光探针对生物微环境进行检测,便于未来应用于癌症的早期诊断研究中。我们应用所构建的近红外荧光探针对不同的细胞微环境进行了检测,分别采用高糖培养基(DMEM)、50%密度的巨噬细胞(RAW 264.7)培养48 h后的含有代谢产物的细胞外液、50%密度的MCF-7乳腺癌细胞培养48 h后的含有代谢产物的细胞外液作为检测溶液,测试所获的荧光光谱如图8所示。可以明显看到,探针的荧光随着细胞外液酸碱度的变化而产生明显变化,通过与精确pH试纸(MN,MACHEREY-NAGEL,德国)比对,该FRET体系对细胞微环境pH值检测精度可达到0.1,在乳腺癌细胞外液中的FRET体系的荧光强度最弱。

图8 FRET体系对不同细胞微环境的检测 Fig.8 Detection result of different cell microenvironment by FRET system
量子点良好的荧光信号决定了所构建的FRET体系除了能够实现癌细胞的pH值敏感度检测外,还能够实现癌细胞的荧光标记。图9显示了FRET体系对MCF-7乳腺癌细胞的成像实验。从明场图像可以看出对照组和实验组细胞生长状态良好,细胞形态正常,呈不规则多边形,没有发现细胞形态的变化,或细胞壁破损的情况,说明该FRET体系毒性较低。通过暗场荧光图可以看出,相比对照组,实验组的细胞内具有来自于FRET体系的明显荧光信号,证明该FRET体系可作为荧光探针对乳腺癌进行荧光标记。
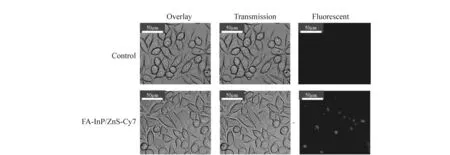
图9 FRET体系对MCF-7乳腺癌细胞的荧光标记 Fig.9 Fluorescently label in MCF-7 breast cancer cells by FRET system
4 结 论
本文采用近红外InP/ZnS量子点与近红外Cy7染料构建FRET体系,通过改变体系中量子点和Cy7染料的浓度对FRET体系转移效率的影响进行了讨论分析。最后,研究了不同pH值溶液对FRET体系的影响,结果显示Cy7染料本身对pH值并不敏感,FRET体系对pH值的敏感性主要源于量子点对pH值的敏感性,当溶液pH值处在7~10时,FRET体系具有较高的FRET转移效率。细胞测试结果表明,FRET探针的荧光信号随着细胞外液酸碱度的变化而产生明显变化,可用于生物微环境中对癌细胞的检测。同时,乳腺癌细胞外液中的FRET体系的明显荧光信号可以应用于癌细胞成像,实现了FRET体系的双重功能。
[1] 胡珊.荧光共振能量转移体系的研究及其在均相免疫分析中的应用[D].武汉:华中科技大学,2010.
HU SH. Sudy on fluorescence resonance energy transfer system and its application in homogeneous immunoassay[D]. WuHan:Huazhong University of Science and Technology,2010.(in Chinese)
[2] FORSTER T. Intermolecular energy migration and fluorescence[J].Ann.Physics,1948,2:55-75.
[3] 郭尧君.荧光实验技术及其在分子生物学中的应用[M].北京:科学出版社,1979.
GUO Y J.FluorescenceExperimentalTechniquesandTheirApplicationsinMolecularBiology[M]. Beijing:Science Press,1979.(in Chinese)
[4] LAKOWICZ J R.EnergyTransfer:InPrinciplesofFluorescenceSpectroscopy[M]. New York:Plenum Press,1983.
[5] CLEGG R.FluorescenceImagingSpectroscopyandMicroscopy[M]. NewYork:Wiley,1996.
[6] ANGELIS D A D.FluorescenceResonanceEnergyTransferFret[M]. Encyclopedia of Medical Genomics and Proteomics.2004:1420.
[7] FENG Y SH,LIU L W,HU S Y,etal.. Förster resonance energy transfer properties of a new type of near-infrared excitation PDT photosensitizer: CuInS2/ZnS quantum dots-5-aminolevulinic acid conjugates[J].RSCAdv.,2016,6:55568-55576.
[8] FENG Y SH,LIU L W,HU S Y,etal.. Four-photon-excited fluorescence resonance energy transfer in an aqueous system from ZnSe:Mn/ZnS quantum dots to hypocrellin A[J].OpticsExpress,2016,24(17):19627-19637.
[9] KIKUCHI K,TAKAKUSA H,NAGANO T. Recent advances in the design of small molecule-based FRET sensors for cell biology[J].TrendsinAnalyticalChemistry,2004,23(6):407-415.
[10] JANSSEN A,BEERLING E,MEDEMA R,etal.. Intravital FRET imaging of tumor cell viability and mitosis during chemotherapy[J].PLoSOne,2013,8(5):e64029.
[11] YUAN L,LIN W,ZHENG K,etal.. FRET-based small-molecule fluorescent probes:rational design and bioimaging applications[J].AccountsofChemicalResearch,2013,46(7):1462-1473.
[12] TAO H L,LIAO X F,etal.. Determination of trace Hg2+ions based on the fluorescence resonance energy transfer between fluorescent brightener and CdTe quantum dots[J].JournalofLuminescence,2014,146: 376-381.
[13] JIANG G F,TANG Y. A novel two-photon fluorescent probe for hydrogen sulfide in living cells using an acedan-NBD amine dyad based on FRET process with high selectivity and sensitivity[J].NewJournalofChemistry,2017,41(14):6769-6774.
[14] WANG Y,SI B,LU S,etal.. Near-infrared excitation of CdTe quantum dots based on fluorescence resonance energy transfer and their use as fluorescent sensors[J].Sensors&ActuatorsBChemical,2017,246:127-135.
[15] 张旭霞,李斌,张黎明,等.有机-无机复合纳米材料的传感应用及机理[J].中国光学,2015,8(4):651-666.
ZHANG X X,LI B,ZHANG L M,etal.. Sensing application and mechanism of organic-inorganic nanocomposites[J].ChineseOptics,2015,8(4):651-666.(in Chinese)
[16] 翟英歌,楚学影,徐铭泽,等.ZnS∶Cu-罗丹明B的荧光共振能量转移性质[J].发光学报,2017,38(8):1028-1032.
ZHAI Y G,CHU X Y,XU M Z,etal.. Properties of fluorescence resonance energy transfer of ZnS:Cu-rhodamine B[J].ChineseJournalofLuminescence,2017,38(8):1028-1032.(in Chinese)
[17] 袁曦,郑金桔,李海波,等.Mn掺杂ZnSe量子点变温发光性质研究[J].中国光学,2015,8(5):806-813.
YUAN X,ZHENG J J,LI H B,etal.. Temperature-dependent photoluminescence properties of Mn-doped ZnSe quantum dots[J].ChineseOptics,2015,8(5):806-813.(in Chinese)
[18] 王英帅,周颖,王珺楠,等.金纳米棒核/二氧化硅壳纳米复合结构的可控制备及细胞成像[J].中国光学,2013,6(5):743-749.
WANG Y SH,ZHOU Y,WANG J N,etal.. Controlled synthesis and cell imaging of gold nanorod-silica core-shell nanoparticles[J].ChineseOptics,2013 6(5):743-749.(in Chinese)
[19] 刘姝妤,钟绵增,孟秀清,等.ZnO/ZnS核-壳量子点的双光子吸收效应[J].发光学报,2015,36(2):249-255.
LIU SH Y,ZHONG J Z,MENG X Q,etal.. Two-photon absorption in ZnO/ZnS core-shell quantum dots[J].ChineseJournalofLuminescence,2015,36(2):249-255.
[20] 刘惠玲.纳米材料内部FRET体系的设计及在单/双光子光动力治疗中的潜在应用[D].南京:南京工业大学,2016.
LIU H L. Design of FRET system in nanomaterials and its potential application in single/two photon photodynamic therapy[D]. Nanjing:Nanjing University of Technology,2016.(in Chinese)
[21] REMEDIOS C G,MOENS P D. Fluorescence resonance energy transfer spectroscopy is a reliable “ruler” for measuring structural changes in proteins-dispelling the problem of the unknown orientation factor[J].JournalofStructuralBiology,1995,115(2):175-185.
[22] LIU L. Quantum dots:the new development of FRET[J].ProgressinChemistry,2006,18(2):337-343.
[23] STEYER L,HAUGLANG R P. Energy transfer:a spectroscopic ruler[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1967,58(2):719.
- 中国光学的其它文章
- Laser-induced periodic surface structures with ultrashort laser pulse
- 新型二维材料在固体激光器中的应用研究进展
- 纳米尺度下的局域场增强研究进展
- Influence of the geometric parameters of the electrical ring resonator metasurface on the performance of metamaterial absorbers for terahertz applications
- Grating diffractive behavior of surface plasmon wave on meta-surface
- 基于光谱指数的蜜橘成熟度评价模型研究

