茶多酚对冷藏鲈鱼鲜度变化及 肌原纤维蛋白氧化的影响
鞠 健,乔 宇,李冬生,廖 李,熊光权,汪 兰
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工分中心,湖北武汉 430064; 2.湖北工业大学生物工程与食品学院,湖北武汉 430068; 3.江南大学食品学院,江苏无锡 214122)
鲈鱼(Lateolabraxjaponicus),又名花鲈、鲈板、寨花等,是常见的经济鱼类之一,也是发展淡水养殖的主要品种,其肉质鲜美、营养丰富,富含蛋白质、维生素、钙、镁、锌、硒等营养元素,具有补肝肾、益脾胃、化痰止咳之功效,因此深受各国消费者的喜爱[1]。然而,由于鲈鱼肌肉中脂肪含量较高,因此极易产生氧化酸败等问题,这不仅会使产品产生不愉快的酸败味,而且还会使产品发生褪色、褐变等现象,从而使产品品质发生劣变,降低了产品的商业价值。因此,如何抑制鲈鱼在运输、贮藏、加工和销售过程中的氧化酸败,保证其产品品质和安全显得尤为重要。
众所周知,茶多酚(Tea polyphenols)是茶叶中主要的生物活性物质[2],无毒无异味,具有较强的抗氧化性,作为一种天然抗氧化剂,现为卫生部批准的食品添加剂。茶多酚作为天然抗氧化剂与其他天然抗氧化剂(如VC、VE、迷迭香提取物等)比较,具有独特的高效抗氧化效果[3]。鉴于茶多酚的高效抗氧化效果及无毒无异味的特点,使其在食品保鲜中的应用受到了越来越多的关注。例如范凯等[4]研究了茶多酚结合辐照处理对冷藏鲈鱼品质的影响;鞠健等[5]研究了茶多酚结合包装对鲈鱼在冷链物流过程中品质的影响;在此基础上鞠健等[6]还研究了茶多酚结合气调包装对鲈鱼品质的影响。目前,虽然关于茶多酚在鲈鱼保鲜中的应用的研究已有部分相关报道,但他们均集中于对鲈鱼冷藏品质的研究,而关于茶多酚对冷藏鲈鱼肌原纤维蛋白氧化的研究却鲜有报道。
本实验以鲈鱼为研究对象,将其在0.20%的茶多酚溶液中浸渍60 min后在4 ℃条件下贮藏,通过测定蛋白的相关氧化指标,研究茶多酚对鲈鱼贮藏过程中肌原纤维蛋白的抗氧化效果,为从蛋白质氧化角度防止鱼肉类制品在贮藏过程中品质下降提供参考。
1 材料与方法
1.1 材料与仪器
鲜活鲈鱼 湖北省武汉市洪山区武商量贩农科院店;硫酸、盐酸、氯化钠、乙醇、冰乙酸、氧化镁、1,1,3,3-四乙氧基丙烷、无水碳酸钠、碳酸氢钠、硼酸、酒石酸钾钠、氢氧化钠等 均为分析纯;溴甲酚绿、甲基红、次甲基蓝、Ca2+-ATPase酶试剂盒 连云港市鑫源化工股份有限公司;2-硫代巴比妥酸(生化试剂)、茶多酚(纯度 90%)、无菌蒸煮袋(12 cm×17 cm) 国药集团化学试剂有限公司。
UV-3802型分光光度计 上海尤尼科仪器有限公司;SPX-250B-Z型生化培养箱 上海博讯实业有限公司医疗设备厂;F93型荧光分光光度计 上海棱光技术有限公司;GL-25MS型高速冷冻离心机 上海卢湘仪离心机仪器有限公司;FG2便携式pH计 梅特勒-托利多仪器(上海)有限公司;BS-210型称量天平 Sartorius Instruments Ltd.德国。
1.2 实验方法
1.2.1 样本处理 将鲜活鲈鱼置于装有水的白色泡沫箱中运回实验室,即杀后,去头和内脏,取背部两边肌肉切成大小约为4 cm×3 cm×2 cm的鱼块80块,用无菌水清洗,将鱼肉随机分成2组,每组40块。根据国家食品添加剂使用限量和相关文献报道[7-9]并结合预实验经验,将茶多酚的浓度配制成0.2%(w/v)。对照组和茶多酚处理组分别用蒸馏水和0.2%(w/v)茶多酚溶液浸渍处理60 min,在4 ℃条件下沥干后用无菌蒸煮袋包装封口,置于4 ℃冰箱中贮藏,分别于第0、2、4、6、8、10 d测定各指标。
1.2.2 K值的测定 参照Choia等[10]方法。
K(%)=100×(HxR+Hx)/(ATP+ADP+AMP+IMP+HxR+Hx)
式中:HxR为次黄嘌呤核苷含量;Hx为次黄嘌呤含量;ATP为三磷酸腺苷含量;ADP为二磷酸腺苷含量;AMP为腺苷酸含量;IMP为肌苷酸含量;单位均为μmol/g。
1.2.3 挥发性盐基总氮(TVB-N)值的测定 参照GB/T 5009.44-2003《肉与肉制品卫生标准的分析方法》[11]。
1.2.4 肌原纤维蛋白盐溶性的测定 参照周茹等[12]的方法。釆用双缩脲方法绘制蛋白浓度标准曲线:分别取6只试管,加入0、0.2、0.4、0.6、0.8、1.0 mL牛血清蛋溶液(10 mg/mL),用蒸馏水定容至1 mL,然后分别加入4 mL双缩脲试剂,于25 ℃下放置30 min,在540 nm下测吸光度。分别以吸光度和浓度为X和Y轴,建立回归方程y=0.0543x+0.0176(R2=0.9997)。
1.2.5 Ca2+-ATPase酶活性的测定 使用Ca2+-ATPase酶试剂盒测定。
1.2.6 表面疏水性的测定 参照Benjakul 等[13]的方法进行。
1.2.7 总巯基和活性巯基含量的测定 参照孙丽[14]的方法进行。
1.3 数据分析
采用Origin 8.5进行作图,SPSS 11.0统计软件进行单因素方差分析,p<0.05为差异显著,p<0.01为差异极显著,实验数据用X±S表示。
2 结果与分析
2.1 K值的变化
K值是用来评价鱼等水产品新鲜程度的一项重要指标,它主要是通过鱼肉等水产品中ATP含量的变化来表示。依据Saito等[15]报道当K值小于等于20%时,鱼肉为一级新鲜度;大于20%小于等于50%时为二级新鲜度;高于50%时为不新鲜。K值的变化受到许多因素的影响,如鱼的种类、捕鱼的应激状态和贮藏温度等。由图1可知,鱼肉的初始K值为17.34%,这表明初始鱼肉非常新鲜。尽管对照组和茶多酚处理组中的样品的K值在整个贮藏期间逐渐增加,但茶多酚处理组中样品的K值在4~10 d间显著低于(p<0.05)对照组。到贮藏末期第10 d时,对照组中样品的K值达到了50.37%,然而茶多酚处理组中样品的K值为41.23%,由此可见,在贮藏末期第10 d时茶多酚处理组中样品的K值显著低于(p<0.05)对照组。这表明0.2%的茶多酚可以有效地抑制ATP的降解及相关产物的生成。Li等[16]报道,大黄鱼在冷藏期间使用壳聚糖结合茶多酚处理可以有效抑制K值的增加,与空白对照组相比降低了19.31%。

图1 鲈鱼在冷藏过程中K值的变化Fig.1 Changes in K value of weever during chilled storage
2.2 TVB-N值的变化
TVB-N是动物性食品在贮藏期间,由于肌肉中的内源酶和微生物共同作用导致蛋白质分解而产生的三甲胺、二甲胺、氨和其他氮类化合物。由图2可知,所有实验组中TVB-N的含量随着贮藏时间的延长均呈现出不断增加的趋势。整个贮藏期间茶多酚处理组中TVB-N的含量显著低于(p<0.05)对照组,到贮藏结束第10 d时对照组和茶多酚处理组中TVB-N的含量分别为21.5 mg N/100 g和18.3 mg N/100 g。根据GB 2733-2015《鲜、冻动物性水产品卫生标准》的规定,鱼肉的TVB-N值不得超过限量值20 mg/100 g,超出即为不可食用。这可能是因为茶多酚具有较好的抗氧化与抑菌作用,从而导致非蛋白化合物氧化脱氨基的速度减慢所致。鞠健等[17]报道,鲈鱼在冷藏期间使用茶多酚结合Nisin处理可以有效抑制TVB-N值的增加,与空白对照组相比到贮藏末期第20 d时降低了53.63%。因此,茶多酚可以较好的抑制鲈鱼在贮藏期间TVB-N的形成。
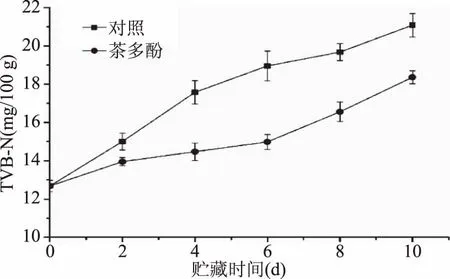
图2 鲈鱼在冷藏过程中挥发性盐基氮变化Fig.2 Changes in TVB-N of weever during chilled storage
2.3 肌原纤维蛋白溶出量的变化
由图3可以看出,在整个贮藏期间鲈鱼肌原纤维蛋白的溶出量随着贮藏时间的延长而不断下降,这可能是因为氧化降低了蛋白的溶解性。对照组和茶多酚处理组中肌原纤维蛋白的溶出量从最初时的205 mg/g到贮藏结束第10 d时分别下降到了94.7、114.5 mg/g且第10 d的处理组比对照组高出20.91%。由此可见,茶多酚处理组中肌原纤维蛋白的溶出量显著低于(p<0.05)对照组。肌原纤维蛋白的溶出量受多种因素的影响,Sompongsew等[18]认为巯基氧化形成二硫键也会导致肌球蛋白重链的聚集,从而降低其溶出量。在本研究中,肌原纤维蛋白的溶出量降低可能是因为在贮藏过程中,肌原纤维蛋白发生变性或降解所导致。汪金林等[19]在研究茶多酚对冷藏养殖大黄鱼品质的影响时表明,茶多酚处理可以较好地抑制大黄鱼肌肉在冷藏期间肌原纤维蛋白溶出量的下降。

图3 鲈鱼在冷藏过程中肌原纤维蛋白溶出量的变化Fig.3 Solubility changes of myofibril protein from weever muscle during chilled storage
2.4 Ca2+-ATPase活性的变化
肌球蛋白中的ATPase酶具有生理活性,能够受到金属离子的激活。当钙离子存在时,ATPase酶被赋予活性,此时便称为Ca2+-ATPase酶[20]。Ca2+-ATPase酶活的大小取决于肌球蛋白的变性程度。因此,该指标的大小能够反映肌球蛋白变性程度[21]。Benjakul等[22]研究也表明,在低温贮藏期间肌原纤维蛋白Ca2+-ATPase活性是评价肌肉蛋白质变性的重要指标。如图4所示,在整个贮藏期间,随着贮藏时间的延长,鱼肉肌原纤维蛋白Ca2+-ATPase活性呈现快速下降的趋势。对照组和茶多酚处理组中Ca2+-ATPase活性由最初时的1.29 U/mgprot到贮藏末期第10 d 时分别下降到了0.21、0.33 U/mgprot,且第10 d时处理组比对照组高出57.14%。由此可见,对照组中Ca2+-ATPase活性显著(p<0.05)低于茶多酚处理组。这可能是因为茶多酚较强的抗氧化作用延缓了肌球蛋白的变性。

图4 鲈鱼在冷藏过程中Ca2+-ATPase活性的变化Fig.4 Changes in Ca2+-ATPase activity of myofibril protein from weever muscle during chilled storage
2.5 表面疏水性的变化
蛋白质的表面疏水性能够反映蛋白质分子内部疏水基团的暴露程度[23]。疏水基团暴露越多,肌原纤维蛋白的表面疏水性越大,意味着它的变性程度也越大,所以可用它来反映蛋白质的变性程度。由图5可知,在整个贮藏期间肌原纤维蛋白的表面疏水性均呈不断升高的趋势,到贮藏末期第10 d时茶多酚处理组中肌原纤维蛋白的表面疏水性显著低于对照组(p<0.05),其值分别为207.3和177.9 S0ANS。这与 Morzel等[24]对骨骼肌的研究结果是一致的。这可能是因为在贮藏过程中蛋白质构像发生变化,一些疏水性的脂肪族与芳香族氨基酸侧链基团从蛋白分子内部暴露出来,促进了蛋白折叠的发生,导致了疏水值的增加。Hill等[25]认为巯基的氧化也会导致蛋白质疏水性的增加,而茶多酚具有较强的抗氧化性,在冷藏期间能够较好的抑制蛋白巯基的氧化,延缓蛋白质的变性速度。
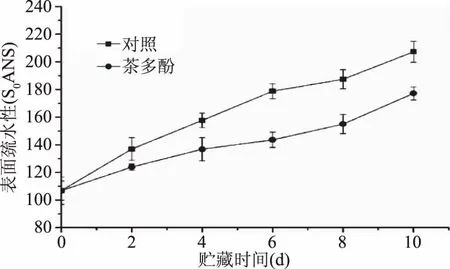
图5 鲈鱼在冷藏过程中表面疏水性的变化Fig.5 Changes in surface hydrophobicity of myofibril protein from weever muscle during chilled storage

表1 各指标之间的相关性分析Table 1 The correlation analysis of the evaluation indexes
注:*p<0.05,**p<0.01。2.6 总巯基和活性巯基的变化
在蛋白质的功能基团中,巯基具有很强的反应活性,且对于维持蛋白质的结构和功能具有重要作用。在贮藏期间巯基氧化生成二硫键,导致巯基含量的下降。因此,巯基含量可以作为蛋白氧化的一个重要指标[26]。由图6和图7可知,总巯基和活性巯基的含量在整个贮藏期间呈不断下降的趋势,对照组和茶多酚处理组中总巯基的含量由最初时的0.151 mmol/g分别下降到贮藏末期第10 d时的0.038和0.045 mmol/g,且第10 d时处理组比对照组高出18.42%;活性巯基的含量由最初时的0.125 mmol/g分别下降到贮藏末期第10 d时的0.019和0.036 mmol/g,且第10 d时处理组比对照组高出89.47%。茶多酚处理组中总巯基和活性巯基的含量在整个贮藏期间均显著低于(p<0.05)对照组。本研究中巯基含量下降的原因可能与肌原纤维蛋白空间内部结构的变化有关。在整个贮藏期间巯基氧化生成二硫键,导致肌原纤维蛋白的空间结构遭到破坏,疏基含量下降。巯基含量的减少与Ca2+-ATPase活性下降的趋势一致,也验证了此结论。

图6 鲈鱼在冷藏过程中总巯基含量的变化Fig.6 Changes in total sulfhydryl content of myofibril protein from weever muscle during chilled storage
2.7 蛋白氧化指标和新鲜度的相关性分析
将表征新鲜度的指标K值和TVB-N值与蛋白质氧化指标进行了皮尔逊相关分析(表1),结果发现表征新鲜度的指标K值和TVB值均与总巯基、活性巯基、肌原纤维蛋白溶出量呈极显著负相关(p<0.01),K值和TVB值与表面疏水性呈极显著正相关性(p<0.01),表明肌原纤维蛋白的氧化与鲈鱼的新鲜度有很好的相关性,这种关联性给予我们判别新鲜度很好的启示,今后可以通过蛋白组学技术进一步鉴定氧化蛋白质,找到表征鲈鱼新鲜度的指示蛋白。
3 结论
在4 ℃冷藏条件下,茶多酚处理可以较好的保持鲈鱼在贮藏期间的鲜度和品质。能够显著地抑制鲈鱼在贮藏期间K值、TVB-N值和表面疏水性的增加(p<0.05);在整个贮藏期间肌原纤维蛋白的溶出量、Ca2+-ATPase活性、巯基和活性巯基的含量均显著高于(p<0.05)空白对照组。这表明茶多酚对冷藏鲈鱼肌原纤维蛋白具有较好的保鲜效果。K值和TVB值均与总巯基、活性巯基、肌原纤维蛋白溶出量呈极显著负相关(p<0.01),与表面疏水性呈极显著正相关性(p<0.01)。
[1]李颖畅,刘明爽,李乐,等. 蓝莓叶多酚对冷藏鲈鱼品质的影响[J]. 中国食品学报,2015(2):120-125.
[2]Li T,Hu W,Li J,et al. Coating effects of tea polyphenol and rosemary extract combined with chitosan on the storage quality of large yellow croaker(Pseudosciaenacrocea)[J]. Food Control,2012,25(1):101-106.
[3]熊青,谢晶,钱韵芳,等. 茶多酚复合保鲜剂对冷藏南美白对虾品质的影响[J]. 食品科学,2014,35(2):287-291.
[4]范凯,廖李,程薇,等. 茶多酚结合辐照对鲈鱼冷藏品质的影响[J]. 核农学报,2016,30(9):1780-1785.
[5]鞠健,程薇,乔宇,等. 茶多酚结合包装对鲈鱼冷链物流过程中品质的影响[J]. 食品工业科技,2016,37(23):57.
[6]鞠健,乔宇,汪兰,等. 茶多酚结合气调包装对冷藏鲈鱼品质的研究[J]. 食品研究与开发,2016(22):173-178.
[7]王丹丹,李婷婷,刘烨,等. 茶多酚对冷藏带鱼品质及抗氧化效果的影响[J]. 食品科学,2015,36(2):210-215.
[8]中华人民共和国国家标准委员会.食品添加剂使用标准 GB 2760-2014[S]. 北京:中国标准出版社,2014.
[9]Li T T,Hu W Z,Li J R,et al. Coating effects of tea polyphenol and rosemary extract combined with chitosan on the storage quality of large yellow croaker(Pseudosciaenacrocea)[J].Food Control,2012,25(1):101-106.
[10]Choia Y J,Linb T M,Tomlinsonb K,et al. Effect of salt concentration and temperature of storage water on the physicochemical properties of fish proteins[J]. LWT-Food Science and Technology,2008,41(3):460-468.
[11]中华人民共和国国家标准委员会.GB/T 5009.44-2003肉与肉制品卫生标准的分析方法[S].北京:中国标准出版社,2003.
[12]周茹,倪渠峰,林伟伟,等. 肌原纤维蛋白溶解度对盐离子浓度的依赖性[J]. 中国食品学报,2015(3):32-39.
[13]Benjakul S,Seymour T A,Morrissey M T,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food Science,1997,62(4):729-733.
[14]孙丽. 金枪鱼肉在蒸煮过程中品质特性变化的研究[D].无锡:江南大学,2009.
[15]Saito T,Arai K I,Matsuyoshi M. A new method for estimating the freshness of fish[J]. Bulletin of the Japanese Society of Scientific Fisheries,1959,24(9):749-750.
[16]Li T,Hu W,Li J,et al. Coating effects of tea polyphenol and rosemary extract combined with chitosan on the storage quality of large yellow croaker(Pseudosciaenacrocea)[J]. Food Control,2012,25(1):101-106.
[17]鞠健,汪超,李冬生,等. 茶多酚和迷迭香结合nisin对冷藏鲈鱼鲜度和品质的影响[J]. 食品科学技术学报,2016,29(6):107-110.
[18]Sompongse W,Itoh Y,Obatake A.Effect of cryoprotectants and a reducing reagem on the stability of myofibril protein during ice storage[J]. Fisheries Science,1996,62(1):73-79.
[19]汪金林. 茶多酚对冷藏养殖大黄鱼品质影响的研究[D]. 杭州:浙江工商大学,2013.
[20]李阳. 白鲢鱼肉挥发性物质与鱼肉肌球蛋白结合能力的初步研究[D]. 武汉:湖北工业大学,2015.
[21]鸿巢章.水产食品学[M].上海:上海科学技术出版社,1992:213-223.
[22]Benjakul S,Visessanguan W,Tueksuban J. Changes in physico-chemical properties and gel-forming ability of lizardfish(Sauridatumbil)during post-mortem storage in ice[J]. Food Chemistry,2003,80(4):535-544.
[23]Mutilangi W A M,Panyam D,Kilara A. Functional properties of hydrolysates from proteolysis of heat-denatured whey protein isolate[J]. Journal of Food Science,1996,61(2):270-275.
[24]Morzel M,Galellier P,Sayd T,et al.Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J].Meat Science,2006,73(3):536-543.
[25]Hill A R,Irvine D M,Bullock D H. Precipitation and recovery of whey proteins:A review[J]. Canadian Institute of Food Science and Technology Journal,1982,15(3):155-160.
[26]Benjakul S,Seymour T A,Morrissey M T,et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food science,1997,62(4):729-733.

