应用多重实时荧光PCR检测 蜡样芽胞杆菌毒力基因
刘 芳,陈国培,王远洋,郭正洋,陈 晶,刘钟栋,兰全学,*
(1.深圳市计量质量检测研究院,广东深圳 518000;2.河南工业大学,河南郑州 450000)
蜡样芽胞杆菌(Bacilluscereus)是一类在周围环境中广泛存在,革兰氏阳性兼性厌氧菌。该菌是一种常见的食源性致病菌,淀粉类,肉类,乳制品均有蜡样芽胞杆菌引起的食物中毒的报道[1]。该菌可引起呕吐和腹泻两种常见的食物中毒症状,呕吐毒素是一种小的热和酸稳定循环肽,因此被食用后在胃部不能被消化,在感染数个小时后即可引起呕吐;腹泻毒素则是由一组热不稳定的蛋白质组成,感染了蜡样芽胞杆菌的食物进入肠道后,细菌增殖代谢产生肠毒素,在8~16 h后引发腹泻[2-3]。
目前常用的检测蜡样芽胞杆菌的方法为传统生化方法,实验周期长(>72 h),重复性差,操作繁琐。免疫学检测方法利用抗原抗体免疫机理对蜡样芽胞杆菌进行检测,容易产生交叉反应,特异性不强,且价格昂贵,存在较大的应用局限性。近年来,由于实时荧光PCR重现性好、特异性强,作为快速准确的核酸分子定量和定性的手段,越来越多的运用于分子生物学领域。利用PCR技术检测蜡样芽胞杆菌的文献不少,例如王振国[4]利用溶血性肠毒素hblA基因作为目的基因,使用PCR方法来鉴定蜡样芽胞杆菌,结果特异性、灵敏性良好。Wehrle[5]等溶血性肠毒素hbl,非溶血性肠毒素nhe和细胞毒力基因cytK设计引物构建多重PCR体系,对引起腹泻的蜡样芽胞杆菌进行了检测。蒋培余等[6]设计了一个多重实时荧光PCR体系来鉴定蜡样芽胞杆菌和金黄色葡萄球菌。但是,蜡样芽胞杆菌肠毒素的特异性一直受到质疑,M L Chen等[7]以蜡样芽胞杆菌的16S rRNA和gyrB为目的基因设计引物使用PCR方法分辨蜡样芽胞杆菌和苏云金芽胞杆菌,结果表明部分苏云金芽胞杆菌同样含有上述基因,有相同的扩增片段。Bjarne Munk Hansen[8]利用PCR方法对蜡样芽胞杆菌和苏云金芽胞杆菌的肠毒力基因进行检测,发现部分苏云金芽胞杆菌也携带肠毒力基因。

表1 菌株列表Table 1 The table of experimental strains
实时荧光PCR由于快速、准确和特异性强等优点,在蜡样芽胞杆菌检测方向的应用越来越受到人们的重视,由于蜡样芽胞杆菌携带多个毒力基因,多重实时荧光PCR在其检测上则显得更加适用。本文以蜡样芽胞杆菌的主要毒力基因(呕吐毒素ces基因,与肠毒素相关的溶血素hblA,hblC,hblD基因,非溶血性肠毒素nheA,nheB,nheC基因,肠毒素entFM基因,细胞毒素bceT基因)设计特异性引物,建立多重实时荧光PCR体系对其进行检测。
1 材料与方法
1.1 材料与仪器
菌株 实验菌株见表1;碳水化合物鉴定试剂条API 50CH、肠杆菌和其他非苛养革兰氏阴性杆菌鉴定试剂盒API 20E、Premix预混合液RR390A(TAKALA)、引物和探针 均由上海生工生物工程股份有限公司合成;所用培养基 均购自北京陆桥技术股份有限公司;血琼脂平板 购自郑州安图生物工程股份有限公司。
Vitek 2 Compact全自动微生物鉴定系统 法国梅里埃公司;3-30K冷冻离心机 SIGMA;ND-1000分光光度计 Gene Company Limited;MX3005P实时荧光PCR仪 美国安捷伦公司;D1100金属干浴器 Labnet Internationnal。
1.2 实验方法
1.2.1 DNA的提取 在30 ℃下用营养肉汤培养24 h,取450 μL菌液,无菌生理盐水洗涤,12000×g离心2 min,弃上清,重复洗涤离心一次,加入450 μL裂解液(100 mg/L蛋白酶K,10 mmol/L Tris-HCI,15 mmol/L NaCl,10 mmol/L EDTA,4 g/L SDS pH8.0),重悬细胞,55 ℃孵育3 h。加450 μL平衡酚(酚∶氯仿∶异戊醇=25∶24∶1),混匀,12000×g离心10 min,转移上层水相。加入450 μL氯仿∶异戊醇(24∶1),混匀,12000×g离心10 min。转移上层水相,加入45 μL 3 mol/L乙酸钠(pH5.2)和450 μL异丙醇,混匀,置于-20 ℃冰箱30 min后,12000×g离心15 min,弃去上清。以500 μL 70%乙醇洗涤2次,晾干后,加入50 μL TAE,混匀-20 ℃保存备用[9]。

表2 引物和荧光探针核苷酸序列Table 2 The primers and probes
合成ces基因质粒作为PCR体系扩增的阳性模板。
1.2.2 引物和探针设计 从NCBI中获取相应毒力基因的序列,进行同源性比较,选取保守序列,设计相应的引物探针。引物和探针序列以及体系中的浓度见表2。
1.2.3 反应体系的建立 反应体系:2×Premix预混合液(包含dNTPS,Mg2+,Taq酶,缓冲液)10 μL,cDNA 2 μL,引物探针浓度见表2,无菌去离子水补至20 μL。
扩增条件:95 ℃,3 min;95 ℃ 5 s;60 ℃ 40 s,进行40个循环[10]。每次实验均使用空白对照。
以ATCC 10876、ATCC 11778、ATCC 14579、ATCC 7064提取的DNA以及ces基因质粒作为实验用DNA模板进行多重实时荧光PCR体系的建立。
1.2.4 特异性 以蜡样芽胞杆菌(ATCC 14579)的DNA作为阳性对照模板DNA,无菌去离子水作为空白对照模板DNA,分别对副溶血性弧菌,大肠埃希氏菌,志贺氏菌等细菌纯培养后提取的DNA(DNA提取方法同1.2.1)进行呕吐毒素ces基因,溶血性肠毒素hblA,hblC,hblD基因,非溶血性肠毒素nheA,nheB,nheC基因,肠毒素entFM以及bceT基因的多重实时荧光PCR反应的检测[11]。
1.2.5 灵敏性 使用营养肉汤振荡培养蜡样芽胞杆菌(ATCC 14579)24h,用无菌生理盐水制备10-1~10-88个梯度的菌液,分别使用1.2.1的方法提取DNA,同时对每个梯度菌液用MYP平板涂布计数。以蜡样芽胞杆菌ATCC 14579的各梯度的DNA作为标准菌株模板,无菌去离子水作为空白对照,对多重体系的灵敏性进行测试[12]。
1.3 数据处理
基因的PCR扩增图谱均由实时荧光PCR仪MX3005P产生,后由Photoshop 7.0进行处理。
2 结果与分析
2.1 多重实时荧光PCR体系的建立
利用荧光PCR体系对蜡样芽胞杆菌标准菌株毒力基因的扩增图谱如图1~图3,每个体系的基因扩增曲线有着较明显的荧光增加量的区别,三个基因扩增结果较为容易区分。
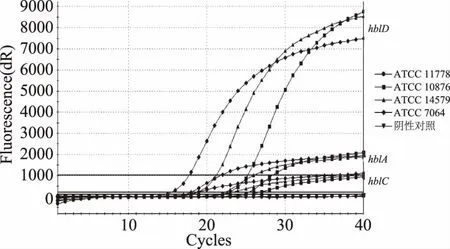
图1 标准菌株的三重hblA,hblC,hblD基因的 荧光PCR体系扩增图谱Fig.1 Amplification plot of the triple PCR system for hblA,hblC and hblD genes to the standard strains
Guinebretiere MH[13]实验中蜡样芽胞杆菌ATCC14579携带hblA,hblC,hblD基因。Hansen BM[8]研究结果显示ATCC10876携带hblA,hblC,hblD基因和nheA,nheB,nheC基因;ATCC11778携带nheA,nheB,nheC基因,但不携带hblA,hblC,hblD基因;ATCC7064携带hblA,hblC,hblD基因和bceT基因。Seav-Ly Tran[14]研究显示ATCC14579携带ent-FM基因。本文应用多重体系对蜡样芽胞杆菌、苏云金芽胞杆菌、巨大芽胞杆菌、ces基因的检出率为0%,hblA,hblC,hblD基因检出率均为38.5%,nheA,nheB,nheC基因分别为46.2%、61.5%、38.5%,entFM和bceT基因分别为76.9%和61.5%。苏云金芽胞杆菌(CICC20695)携带nheB,nheC,entFM,bceT基因;枯草芽胞杆菌(CICC10721和ATCC9372)携带entFM,bceT基因;巨大芽胞杆菌(CICC23035)、枯草芽胞杆菌(CICC10275)、蕈状芽胞杆菌(CICC21473)均未携带毒力基因。结果表明,ces基因的分布稀少;这些毒力基因在蜡样芽胞杆菌不同菌株之间的分布不尽相同;相关毒力基因并不是蜡样芽胞杆菌特有的,在芽胞杆菌属中也有可能存在。

表3 芽胞杆菌属细菌毒力基因分布情况Table 3 Distribution of toxin genes in Bacillus

图2 标准菌株的三重nheA,nheB,nheC基因的 荧光PCR体系扩增图谱Fig.2 Amplification plot of the triple PCR system for nheA,nheB and nheC genes to the standard strains
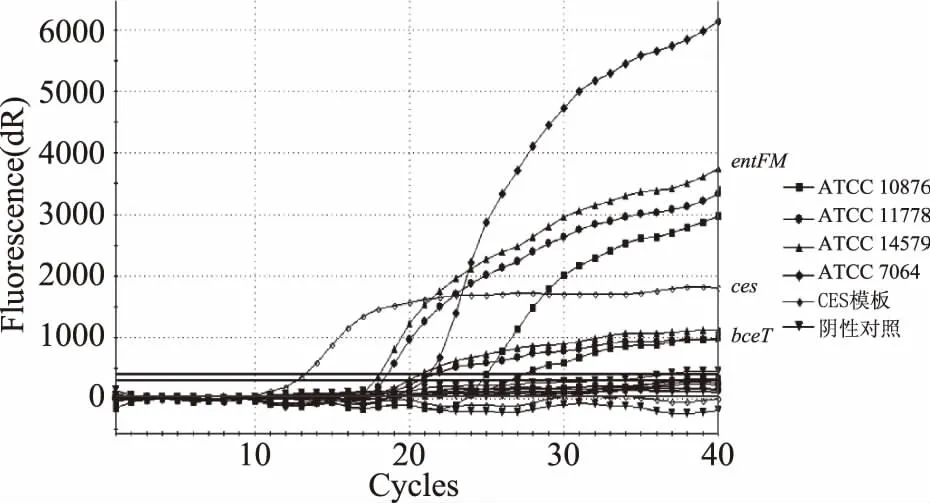
图3 标准菌株的三重ces,entFM和bceT 基因的荧光PCR体系扩增图谱Fig.3 Amplification plot of the triple PCR system for ces,entFM and,bceT genes to the standard strains
注:“+”表示PCR扩增结果为阳性,“-”表示PCR扩增结果为阴性。蕈状芽胞杆菌和枯草芽胞杆菌进行毒力基因的检测(表3),三个多重实时荧光PCR体系对蜡样芽胞杆菌的毒力基因携带情况与文献相符。
2.2 多重实时荧光PCR体系的特异性分析
对多重体系的特异性进行验证,扩增结果如图4~图6。从图中可以看出,除了阳性对照(ATCC14579)的扩增结果为阳性,非芽胞杆菌属细菌扩增结果均为阴性,上述体系对于对应的基因在本次研究的各种菌中具有较好的特异性。

图4 三重hblA,hblC,hblD基因的 荧光PCR体系特异性实验Fig.4 Specificity test of the triple PCR system for hblA,hblC and hblD genes

图5 三重nheA,nheB,nheC基因的 荧光PCR体系特异性实验Fig.5 Specificity test of the triple PCR system for nheA,nheB and nheC genes
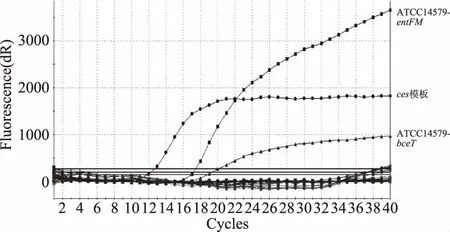
图6 三重ces,entFM和bceT基因的 荧光PCR体系特异性实验Fig.6 Specificity test of the triple PCR system for entFM,bceT and ces genes
2.3 多重实时荧光PCR体系的灵敏性分析
经MYP涂布培养,蜡样芽胞杆菌(ATCC14579)原液的浓度为6.3×106CFU/mL。利用不同稀释倍数的菌液提取的DNA进行多重实时荧光PCR测试。选择多重体系中的hblD、nheB、bceT三个基因的扩增曲线进行灵敏性测试。在图7~图9中,6.3×106~6.3×101CFU/mL的不同浓度菌液提取的DNA均有扩增,多重体系对蜡样芽胞杆菌的最低检出限为6.3×101CFU/mL。

图7 hblD基因的灵敏性实验Fig.7 Sensitivity test of hblD gene

图8 nheB基因的灵敏性实验Fig.8 Sensitivity test of nheB gene
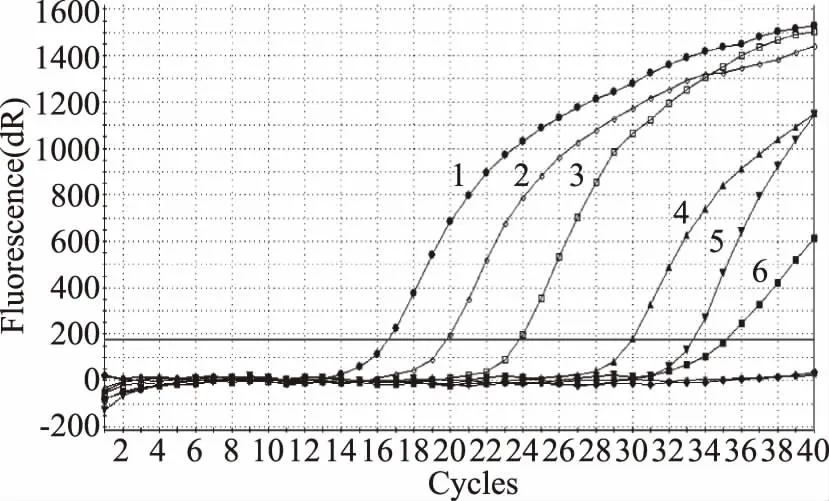
图9 bceT基因灵敏性实验Fig.9 Sensitivity test of bceT gene注:1~6分别代表以浓度为6.3×106,6.3×105,6.3×104,6.3×103,6.3×102,6.3×101 CFU/mL旳 菌液所提取的DNA模板多重PCR扩增结果。
3 讨论与结论
针对蜡样芽胞杆菌的毒力基因ces,hblA,hblC,hblD,nheA,nheB,nheC,entFM以及bceT基因设计引物和探针,本文利用TaqMan探针法建立了多个多重实时荧光PCR体系。从图1可以看出,每个体系的几种基因的扩增曲线有着较明显的荧光增加量的区别,三个基因扩增结果较为容易区分。另外,多重PCR体系的结果与各个毒力基因对应的单重体系的结果相吻合,也验证了其准确性。图2中除了阳性对照外,其他菌扩增结果均为阴性,说明多重PCR体系在属的水平上具有良好的特异性。利用梯度稀释后提取的DNA进行多重PCR实验,结果表明三个多重体系都在6.3×101CFU/mL水平上有扩增,其最低检出限为6.3×101CFU/mL,与李志勇等[15]的6.1×101CFU/mL的灵敏度基本一致。
利用多重PCR体系对蜡样芽胞杆菌、枯草芽胞杆菌、苏云金芽胞杆菌等13株芽胞杆菌进行实验,其基因携带情况如表3。其中四株标准菌株ATCC 10876[8],ATCC 11778[8],ATCC 14579[13-14],ATCC 7064[8]的基因携带情况与文献中的相符。实验结果表明,毒力基因hblA,hblC,hblD在每个菌中的携带情况高度一致,nheA,nheB,nheC基因在ATCC 7064,CICC 23828,CICC 10041分布并不一致,在其他菌中的携带情况一致,闫韶飞等[16]称hblA,hblC,hblD三个基因全为阳性时菌株才具有毒性,nheA,nheB,nheC都为阳性时毒性最强,本文hblA,hblC,hblD三个基因均为阳性者如ATCC 10876、ATCC 14579、ATCC 7064、CICC 21261等具有毒性,nheA,nheB,nheC基因都为阳性的ATCC 10876、ATCC 11778、ATCC 14579、CICC 21261具有强毒性;entFM存在于所有蜡样芽胞杆菌中,这与entFM基因在蜡样芽胞杆菌普遍存在的说法相符[17]。苏云金芽胞杆菌也含有相关的肠毒力基因nheB、nheC、entFM、bceT,说明肠毒力基因在芽胞杆菌属中特别是苏云金芽胞杆菌也有可能携带[18]。实验菌株中没有ces基因阳性菌株,验证了ces基因在蜡样芽胞杆菌或者芽胞杆菌属中分布较少的说法。
随着对食品中蜡样芽胞杆菌的越来越重视,对其毒力基因的研究也在加深。本文设计的多重PCR体系涵盖了呕吐毒素ces基因,溶血性肠毒素hblA,hblC,hblD基因,非溶血性肠毒素nheA,nheB,nheC基因,肠毒素entFM以及bceT基因等蜡样芽胞杆菌的毒力基因。实验结果表明上述体系的特异性良好,灵敏度可以达到63 CFU/mL。因此,TaqMan探针法可更快速,准确,简便对相关基因进行扩增检测,对蜡样芽胞杆菌的毒力基因更深入的研究提供依据和便利。
[1]周帼萍,梁天光,丁淑娟. 1986-2007年中国 299起蜡样芽胞杆菌食物中毒案例分析[J].中国食品卫生杂志,2009,21(5):450-454.
[2]PE Granum.Bacilluscereus[J]. Michael P Doyle,1997,17(12):343-353.
[3]NotermansS,CA Batt. A risk assessment approach for foodborneBacilluscereus and its toxins[J]. Symposium,1998,84(27):51S-61S.
[4]王振国,刘金华,肖成蕊.利用PCR技术检测致病性腊样芽胞杆菌的研究[J]. 生物技术,2005,15(5):45-47.
[5]Wehrle E,Moravek M,Dietrich R,et al. Comparison of multiplex PCR,enzyme immunoassay and cell culture methodsfor the detection of enterotoxinogenicBacilluscereus[J]. Journal of Microbiological Methods,2009,78(3):265-270.
[6]蒋培余,于新芬,潘劲草. 多重实时荧光PCR检测金黄色葡萄球菌和蜡样芽胞杆菌[J]. 现代预防医学,2009,36(11):2104-2107.
[7]M L,Chen H Y,Tsen. Discrimination ofBacilluscereusandBacillusthuringiensiswith 16S r RNA and gyr B gene based PCR primers and sequencing of their annealing sites[J]. Journal of Applied Microbiology,2002,92:912-919.
[8]Hansen BM,Hendriksen NB. Detection of EnterotoxicBacilluscereus andBacillusthuringiensisStrains by PCR Analysis[J]. Applied and Environmental Microbiology,2001,67(1):185-189.
[9]曹国清. 酚/氯仿抽提法提取绵羊凝血块中基因组DNA[J]. 安徽农业科学,2009,37(34):1677-16772.
[10]沈圣,余娟. TaqManTM实时荧光PCR快速检测蜡样芽胞杆菌的初步研究[J].中国卫生检验杂志,2003,16(12):1434-1436.
[11]VesaMantynen,Kristina Lindstrom. A Rapid PCR-Based DNA Test for EnterotoxicBacilluscereus[J]. Applied and Environmental Microbiology,1998,64(5):1634-1639.
[12]王振国,刘金华,徐宝梁.应用实时荧光 PCR检测致病性蜡样芽胞杆菌[J]. 生物技术通讯,2006,17(1):040-042.
[13]Guinebretiere MH,Broussolle V,Nguyen-The C.Enterotoxigenic Profiles of Food-Poisoning and Food-BorneBacilluscereusStrains[J]. Journal of Clinical Microbiology,2002,40(8):3053-3056.
[14]SL Tran,E Guillemet,M Gohar et al.Cwp FM(Ent FM)is aBacilluscereuspotential cell wall peptidase implicated in adhesion,biofilm formation,and virulence[J]. Journal of bacteriology,2010,192(1):2638-2642.
[15]刘志勇,赵雪涛,陆敏. Real-time PCR 测定食品中蜡样芽胞杆菌的数量[J]. 中国卫生检验杂志,2012,22(8):1858-1863.
[16]闫韶飞,闫旭,甘辛.我国市售婴儿配方乳粉中蜡样芽胞杆菌污染及其毒力基因调查[J]. 中国食品卫生杂志,2015,27(3):286-290.
[17]I Nooratiny,AM Sahilah. Detection of enterotoxin targetedentFMandhblAgenes by inoculatingBacilluscereus(Strain BC1)into ready-to-eat food(RTF)and drink samples using polymerase chain reaction(PCR)[J]. International Food Research Journal,2013,20(4):1895-1899.
[18]黄必旺,黄志鹏,关雄.苏云金芽胞杆菌肠毒素的研究进展[J]. 中国农学通报,2008,24(3):292-295.

